Argomento della lezione
CITOCHINE
DELL’IMMUNITÀ INNATA
I parte
1
Le citochine dell’immunità innata
sono prodotte nelle fasi precoci
delle risposte immuni nei confronti
dei microrganismi e di altri
antigeni, quindi durante le prime
fasi dell’infiammazione ed hanno
la funzione di:
regolare ed attivare le diverse
funzione dell’immunità innata
attivare la risposta acquisita
2
INFIAMMAZIONE
DEFINIZIONE
È un meccanismo biologico che si attiva in risposta ad un danno
tissutale
TIPI DI STIMOLI LESIVI
ESOGENI:
ENDOGENI
Fisici (traumi, ustioni)
Chimici (sostanze tossiche)
Biologici (parassiti, microrganismi)
Disordini metabolici
Alterazioni immunitarie
INFIAMMAZIONE
In funzione della durata nel tempo l’infiammazione può essere:
ACUTA: si risolve entro qualche ora o pochi giorni
Ha scopo difensivo e favorisce l’intervento di componenti del
Sistema Immunitario
nelle sedi in cui si verifica un danno biologico e dà avvio alla
ricostruzione del tessuto
ed alla riparazione del danno
CRONICA: persiste per settimane o mesi
PROCESSO INFIAMMATORIO
Il processo infiammatorio viene distinto
schematicamente in :
1)
2)
Angioflogosi (acuta)
Istoflogosi (cronica)
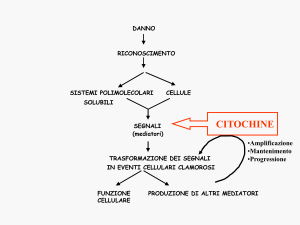
La risposta infiammatoria è innescata dal legame dei PRR
con i PAMP e DAMP
6
Citochine dell’immunità innata
7
Le prime citochine che vengono prodotte sono:
•TNF-α
α;
•IL-1
Triade infiammatoria
•IL-6
•chemochine
8
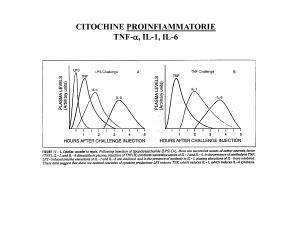
Cinetica di produzione delle citochine infiammatorie (TNF-α, IL-1, IL-6)
in risposta ad uno stimolo “modello” (LPS)
N.B.: IL-10 è una citochina anti-infiammatoria
9
Fattore di Necrosi Tumorale-α
α (TNF-α
α)
Il TNF-alfa è il principale mediatore
delle risposta infiammatoria acuta nei
confronti dei batteri gram-negativi
(LPS) e di altri microrganismi
patogeni.
In
alcuni
casi
è
responsabile
delle
complicanze
sistemiche che si possono verificare
in un processo infiammatorio (shock
settico)
10
Fattore di Necrosi Tumorale-α
α (TNF-α
α)
E’ prodotto dai fagociti mononucleati, cellule endoteliali
ecc.
Le principali funzioni biologiche del TNF- α consistono:
1. nel favorire il reclutamento dei neutrofili e dei monociti
nei focolai d’infezione, inducendo l’espressione delle
molecole d’adesione (selectine e i ligandi delle integrine)
sulle cellule endoteliali
2. nel stimolare la produzione di IL-1, IL-6 e chemochine
3. nell’attivare le funzioni microbicide dei neutrofili e
macrofagi
11
Fattore di Necrosi Tumorale-α
α (TNF-α
α)
4. nell’indurre la febbre (pirogeno endogeno)
5. nell’aumentare da parte degli epatociti la sintesi delle
proteine della fase acuta (proteina amiloide serica,
fibrinogeno)
6. nell’indurre la cachessia (danno al tessuto muscolare
ed adiposo)
7. nel causare trombosi intravascolare
8. nell’inibire la clonazione delle cellule staminali del
midollo osseo
12
Recettori
Vi sono due distinti recettori per il
TNF:
Recettore di tipo I (TNF-RI)
Recettore di tipo II (TNF-RII)
Entrambi i recettori sono espressi
sulla membrana di molte cellule.
Si trovano anche in forma solubile
13
Trasmissione del segnale
del TNF-RI
14
Attività biologiche del TNF-α
α
15
La sepsi è una delle più frequenti complicazioni nel
paziente chirurgico e una delle principali cause di
mortalità nelle terapia intensive.
La sepsi può essere causata da infezione da batteri
Gram-negativi, Gram-positivi, miceti (in particolare
Candida), o più raramente virus.
La sepsi può avvenire anche in assenza di documentata
infezione, e in questi casi le tossine microbiche,
particolarmente le endotossine di batteri Gram-negativi
(lipopolysaccharide, LPS), e le citochine endogene sono
state implicate nella patogenesi della sindrome dello
shock settico .
Infatti, anche se l’attivazione del sistema immune
durante un’infezione è in genere protettiva, lo shock
settico si sviluppa in un significativo numero di paziente
in conseguenza di una risposta immune inappropriata. 16
La sepsi si può presentare con un ampio spettro di gravità.
Lo shock settico rappresenta la forma più grave di risposta
dell’ospite all’infezione
Nonostante i progressi in campo antibiotico e di terapia di
supporto del malato critico, la sepsi è ancora oggi
associata ad elevata mortalità (~40–50%), anche con terapie
adeguate.
Lo sviluppo di shock settico e conseguente sindrome da
insufficienza multi-organo (MODS) sono associate a
prognosi infausta
17
Eventi patogenetici sequenziali
nello shock settico
18
Interleuchina-1 (IL-1)
La funzione dell’IL-1, come per il TNF, consiste nel mediare la
risposta infiammatoria in seguito ad un’infezione o ad altri
stimoli flogistici.
E’ prodotta dai fagociti monucleati attivati.
Esistono due forme (IL-1α
α e IL-1β
β) con un’omologia del 30%.
E’ l’unica citochina con un inibitore naturale (IL-1Ra)
Agisce, stimolando:
•L’infiammazione locale
•L’espressione delle molecole d’adesione
•Il rilascio delle chemochine
•La proliferazione dei linfociti T CD4+ e delle cellule B
19
INTERLEUCHINA-6 (IL-6)
L’interleuchina-6 (IL-6) è il prototipo della citochina pleiotropica; ha
un ruolo importante nella risposta di fase acuta, in quella
immunitaria e nell’emopoiesi.
E’ prodotta da varie cellule, come linfociti T e B, monociti/macrofagi,
fibroblasti, epatociti, astrociti, cellule vascolari endoteliali e molte
cellule cancerose.
Molte delle sue attività biologiche sono sovrapponibili a quelle del
TNF-α
α e dell’IL-1 (insieme formano la triade infiammatoria).
20
Attività biologiche dell’IL-6
•Induce la febbre
•Induce la sintesi del fibrinogeno negli epatociti
•Sinergico con IL-3 nello stimolazione
dell’emopoiesi (neutrofili)
•Induce la differenziazione delle cellule B
•Fattore di crescita autocrino per i mielomi
•Promuove la crescita degli ibridomi
•Induce la produzione dell’IL-17 e l’inibizione delle
cellule T regolatorie
21
Effetti pleiotropici e ridondanti di TNF-α
α, IL-1 e IL-6
TNF-α
α
IL-1
IL-6
+
+
+
+
+
+
Aumento della
permeabilità
vascolare
+
+
+
Aumento
espressione delle
CAM
+
+
-
+
+
+
+
+
+
+
-
-
Effetti
Pirogeno
endogeno
Sintesi delle
proteine di fase
acuta
Induzione di
chemochine
Induzione di IL-6
Cachessia
Inibizione a
livello del
midollo osseo
22
Farmaci “biologici”
I farmaci biologici sono tra i maggiori progressi ottenuti dalla
medicina negli ultimi anni in campo terapeutico.
•Queste nuove terapie posseggono una grande selettività d'azione
che consente di ottenere, nella maggior parte dei casi, una notevole
efficacia terapeutica in tempi brevi con riduzione degli effetti
collaterali rispetto alle terapie tradizionali di tipo "chimico".
•I farmaci biologici finora prodotti sono anticorpi monoclonali,
citochine (interferoni e interleuchine), proteine di fusione e fattori
di crescita tissutali.
•Tali prodotti possiedono l'enorme vantaggio di poter interferire in
modo selettivo, a vari livelli e con modalità di azione differenti nei
processi immunologici .
23
Ab monoclonali
24
Meccanismo d’azione degli Ab
monoclonali anti-TNF-α
25
RHEUMATOID ARTHRITIS
Chronic, autoimmune disease
characterized by:
Severe joint inflammation
Increased synovial fluid and thickened
synovial membrane
Destruction of bone and cartilage in
several joints
Elevated levels of pro-inflammatory
cytokines
TNF-α, IL-1, IL-6
Women are 3 times more likely to develop
If untreated for 2+ more years, irreversible damage occurs
26
Etanercet
Human p75
Human IgG1
Etanercept
L’etanercet è un frammento del
recettore del TNF-α (recettore
solubile);
usato
nel
trattamento
dell’artrite
reumatoide.
Blocca l’azione del TNF-α/β.
•Effetti collaterali: reazioni
cutanee in sede di iniezione
(~35%), cefalea (~20%) e
immuno-soppressione con un
aumento delle infezione alle vie
aeree
superiori,
sindromi
influenzali, aumento del rischio
di infezione (e riacutizzazione)
della TBC.
27
Infliximab
Mouse
Human
Infliximab
L’infliximab è un Ab monoclonale
chimerico contenente una regione umana
ed una murina variabile che lega il TNF-α
Usato essenzialmente nella terapia
dell’artrite reumatoide e del morbo di
Crohn.
Effetti collaterali: reazioni cutanee in
sede di iniezione, febbre, orticaria,
ipotensione, immunodepressione con
aumento rischio di infezioni alle vie aeree,
incluso TBC e del tratto genito-urinario
(sepsi), aumento del rischio di infezione
da herpes zoster.
28
Adalimumab
Human
IgG1
Adalimumab
Anticorpo monoclonale
ricombinante completamente
umano, specifico per TNFalfa. Si lega al TNF-alfa con
elevata affinità e specificità,
bloccando l’attività biologica
della forma libera e di quella
legata alla membrana
Gli effetti collaterali sono:
infezioni delle vie respiratorie
superiori, dolore nel sito
d’iniezione, cefalea e rash .
29
Monoclonal antibodies
Infliximab
Adalimumab
Anti-TNF-α antibody
Soluble receptors
Etanercept
TNFα
Soluble
TNFα receptors
TNF Receptors
30
Effetti dell’anticorpo monoclonale anti-TNF
sull’artrite reumatoide
31
RITUXIMAB
Rituxan® by Genentech
Anti-B cell (CD20) antibody
First approved in 1997 for use in B-cell lymphoma
Given in combination with Methotrexate
Directed for patients who do not respond to Anti-TNF
treatments
Indicates the rheumatoid arthritis has a B cell
component to its pathology
32
Effetti dell’anticorpo monoclonale anti-CD20
sull’artrite reumatoide
33
Inibitori dell’IL-1
Anakinra è un farmaco ricombinante umano che
mima l’antagonista per il recettore dell’IL-1.
Blocca il recettore dell’IL-1.
Usato essenzialmente nella terapia dell’artrite
reumatoide.
•Effetti collaterali: reazioni cutanee in sede di
iniezione, immunodepressione con aumento del
rischio malattie infettive.
•
34
ANAKINRA
35