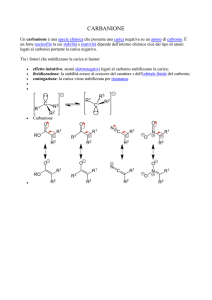
chimica tessile
CHIMICA del CARBONIO
1
IL CARBONIO
e la chimica del CARBONIO
• Il carbonio è uno degli elementi chimici principali che costituiscono piante e animali (composti o
sostanze organiche), ma anche sostanze chimiche ottenute dall’uomo (materiali plastici, tessuti..).
• È presente come costituente di molecole complesse (formate da molti atomi di diversi elementi
chimici), oppure in forma pura (cioè costituito da soli atomi di carbonio) come diamante oppure
grafite.
Il carbonio puro trova molte applicazioni in diversi campi.
• I diamanti sono pietre preziose e vengono usati per la fabbricazione di strumenti che richiedono
durezza e resistenza all'uso, come le puntine dei giradischi.
• La grafite viene usata in molti casi come lubrificante in metalmecccanica
ma anche nelle pile a secco (usate per i walkman e altre apparecchiature) o nelle vernici
• Nelle pile a secco (usate per i walkman e altre apparecchiature) coe
elettrodo
• Nella fabbricazione di vernici
• La «mina» delle matite è un miscuglio di grafite e argilla; gli strati di
grafite vengono staccati dalla punta della matita in seguito alla
frizione con il foglio di carta. La quantità di argilla determina la
durezza della matita.
• Il carbone di legna (carbone attivo, charbon actif) ha la proprietà di assorbire sulla sua superficie
grandi quantità di gas; perciò è utilizzato negli impianti di depurazione delle acque, nelle maschere
antigas e per eliminare le sostanze coloranti dalle soluzioni (ad esempio nella raffinazione dello
zucchero).
• Ferro e carbonio, mescolati insieme formano una lega , come per esempio l'acciaio.
• Il nerofumo, l'additivo che rende nera la gomma dei pneumatici, viene utilizzato nella produzione
di carta carbone, inchiostri da stampa e lucidi da scarpe.
chimica tessile
CHIMICA del CARBONIO
2
⇒ In più, il carbonio si combina con altri atomi di carbonio oppure con alcuni altri elementi
chimici( ossigeno, idrogeno, azoto, zolfo, fosforo), per formare un'infinità di composti (diversi
milioni), che comprendono i materiali plastici, le vernici, i tessuti, i medicamenti, i coloranti, i
costituenti dei tessuti viventi (grassi, zuccheri, proteine) e altri ancora.
Più in dettaglio partendo dai composti più semplici:
• Il carbonio si trova anche nell'atmosfera, sotto forma di anidride carbonica (CO2) In anni recenti è
stato dimostrato che l'accumulo atmosferico di CO2 proveniente dagli scarichi delle combustioni
industriali o dalle attività umane contribuisce al cosiddetto effetto serra, che provoca un graduale
riscaldamento della Terra.
• Il monossido di carbonio (CO) è un gas combustibile, è inodore, incolore, insapore ed
estremamente velenoso: respirare anche una piccola quantità di monossido di carbonio può portare
progressivamente alla morte.
•
Con il cloro (Cl), il carbonio forma per esempio il cloroformio (CHCl3), usato una
volta come anestetico ma ora solo come solvente, il tetracloruro di carbonio (CCl4) un’altro
solvente, la trielina (C2HCl3 ) e il percloroetilene (C2Cl4) che venivano usati come solventi e
smacchianti per grassi e oli nella pulizia dei tessuti a secco.
• Questi composti sono però molto tossici, per cui devono essere prese le misure
necessarie per evitare i contatti con queste sostanze (lavatrici a circuito
chiuso e automatiche).
• Attenzione in caso di fughe di prodotti per guasti alle guarnizioni dei
macchinari, oppure alla presenza di resti di solvente dopo il al lavaggio di
articoli foderati o sacchi a pelo
• Il carbonio si combina anche con cloro e fluoro e forma i clorofluorocarburi (abbreviati con la
sigla CFC), usati fino ad oggi negli impianti frigoriferi e nelle confezioni spray. Oggi i CFC sono
vietati, perché la loro dispersione nell'atmosfera danneggia lo strato di ozono, che protegge la
Terra dalle radiazioni solari ultraviolette.
chimica tessile
CHIMICA del CARBONIO
3
⇒ Gli idrocarburi, composti da carbonio e idrogeno (COMPOSTI binari (C e H)), sono i
costituenti principali del petrolio e del gas naturale (metano).
⇒ È soprattutto a partire delle sostanze chimiche presenti nel petrolio grezzo (circa 200 tipi
differenti!!) che vengono prodotte dopo diverse purificazioni e trasformazioni i materiali plastici.
Utilizzo del petrolio per produrre materie plastiche e altri prodotti di sintesi
chimica tessile
CHIMICA del CARBONIO
ALCANI CnH2n +2
• solo legami semplici nella molecola
Tre modi per rappresentare
una molecola di metano CH4
H
H
C
H
H
H
H C
H
H
H
C
C
H
H
C H
H
H
BUTANO C4H10
ALCHENI
CnH2n
• un solo legame doppio nella molecola
etene
butene
pentene
C2H4
C4H8
C5H10
CH2 CH2
CH2 CH-CH2- CH3
CH2 CH-CH2- CH2- CH3
H
H
C
DIENI diversi legami doppi nella
molecola
C
H
H
C
H
ALCHINI CnH2n -2
• un solo legame triplo nella molecola
H
H
C
H
H
C
C
C
H
H
C
H
4
chimica tessile
CHIMICA del CARBONIO
5
IDROCARBURI ciclici di tipo AROMATICO
∗ Gli idrocarburi aromatici costituiscono una classe particolare di idrocarburi insaturi ciclici
(alcuni composti di questo gruppo sono odorosi).
∗ Un esempio è tipico è il BENZENE e i suoi derivati (fenolo, anilina, toluene)
H
H
H
H
H
Diverse possibilità di
rappresentazione delle strutture
del benzene. I doppi legami non
hanno una posizione fissa , quindi
vengono indicati con un cerchio
Il benzene (molto velenoso!!) è un punto di partenza per ottenere numerose
altre sostanze
H
Come altre sostanze (medicamenti) sono dei prodotti di SINTESI, cioè sostanze
complesse ottenute da sostanze semplici per aggiunta di vari gruppi di atomi e sempre tramite reazioni
chimiche.
Formule chimiche di alcuni derivati del benzene
∗
chimica tessile
CHIMICA del CARBONIO
∗ Rappresentazione di molecole organiche
RIASSUNTO IDROCARBURI
Idrocarburi saturi: contengono solo legami semplici
Idrocarburi insaturi: contengono anche legami doppi o tripli (alcheni, dieni, alchini)
6
chimica tessile
CHIMICA del CARBONIO
7
Gruppi alchilici
Gruppi di atomi ottenuti sottraendo un atomo di idrogeno ad un alcano
Questi gruppi possono dunque sostituirsi ad atomi di idrogeno nelle catene di
carbonio
alcani
CH4
CH3
gruppi alchilici
CH3
CH3 CH2 CH3
CH3 CH2 CH2 CH3
metano
etano
propano
butano
CH3 metile
CH2 CH3 etile
CH2 CH2 CH3 propile
CH2 CH2 CH2 CH3butile
I gruppi funzionali
• sono dei gruppi ben definiti di atomi che sono generalmente formati da
combinazioni di carbonio, ossigeno, idrogeno, azoto .
• Questi gruppi di atomi sono legati a dei gruppi alchilici (anche ciclici o
aromatici) e determinano le caratteristiche chimiche dell’intero composto
chimica tessile
CHIMICA del CARBONIO
Vediamo ora in dettaglio gli ALCOOLI
ALCOOLI
composti che presentano gruppi ossidrilici
.
OH legato a un gruppo alchilico
H
H
C
O H
METANOLO
H
H
H3C
C
O H
ETANOLO
H
H
H3C CH2 C
O H
1-PROPANOLO
H
• Gli alcool possono avere anche più di un gruppo -OH
• I DIOLI (o glicoli) ne hanno 2. Vediamo per esempio il glicole etilenico (il più comune antigelo,
usato anche come reagente per la sintesi della fibra tessile poliestere)
CH2-OH
CH2-OH
• Alcool con tre gruppi -OH. Esempio : glicerina
CH2-OH
CH-OH
CH2-OH
Con la glicerina oltre saponi e altri prodotti simili, si fabbrica la NITROGLICERINA, facendo
reagire apppunto la glicerina con acido nitrico (e acido solforico)
8
chimica tessile
CHIMICA del CARBONIO
AMMINE
Composti che presentano un atomo di azoto legato a uno o più atomi di
carbonio appartenenti a gruppi alchilici.
H3C
H3C
NH3
AMMONIACA
NH2
METILAMMINA
CH2 NH2
H3C
NH
ETILAMMINA
DIMETILAMMINA
H3C
ACIDI CARBOSSILICI
composti che presentano il gruppo carbossilico
-COOH
O
R C
O H
9
chimica tessile
CHIMICA del CARBONIO
10
• acido propionico: odore e sapore di formaggio; acido butirrico: odore di burro rancido
• acidi carbossilici con una lunga catena idrocarburica formano gli acidi grassi, componenti dei
grassi (lipidi)
• I composti organici visti finora possono esistere come tali oppure combinarsi tra di loro.
• Queste combinazioni possono essere tra unità identiche o tra unità diverse tra loro.
⇒ Per esempio una molecola di alcool può legarsi ad una molecola di acido
carbossilico per formare un ESTERE (con eliminazione di una molecola
d’acqua), che ha caratteristiche chimiche diverse dai costituenti di partenza.
⇒ Formazione del gruppo
COOR
⇒ Ecco alcuni esteri (sono per esempi aromi e profumi di frutti): osserva il cambiamento di
caratteristiche chimiche con i composti di partenza.
chimica tessile
CHIMICA del CARBONIO
Nel caso invece della formazione di lunghe catene di composti,
prendiamo l’esempio dell’etilene
⇒ L’etilene (detto anche etene), si combina con altre molecole di etilene per formare il
POLIETILENE.
Le unità sono dette MONOMERI, le catene sono dette POLIMERI.
Il processo chimico è detto di POLIMERIZZAZIONE
11
chimica tessile
CHIMICA del CARBONIO
Struttura chimica
• La struttura chimica, la grandezza e la disposizione delle macromolecole determinano le
caratteristiche chimico-fisiche del prodotto.
Le fibre tessili sono costituite da un insieme di macromolecole (polimeri) con le seguenti
caratteristiche generali:
• struttura a catena lineare
• disposte in modo ordinato
• orientate secondo un’asse preferenziale
• trattenute insieme da forze intermolecolari, che permettono un impacchettamento delle
macromolecole e quindi una struttura compatta e cristallina
12
chimica tessile
CHIMICA del CARBONIO
13
IL POLIESTERE
fibre di poliestere e di cotone al microscopio
• Il POLIESTERE è un polimero lineare che di solito contiene circa 20'000 unità per catena.
Le catene quando sono allineate si attraggono tramite interazioni dipolo-dipolo, uno dei tre tipi di legami deboli
che avvengono tra molecole diverse.
• Ogni unità risulta generalmente dall’unione di un di un diolo (alcool con due gruppi -OH, come per esempio
il glicole etilenico usato tra l’atro anche nei fluidi anticongelanti), con acido bicarbossilico (per esempio
l’acido tereftalico)
POLIESTERE (Dacron® , Trevira®, Terital®, Tergal®)
• Il polimero fuso può fondere
senza decomporsi per poi
venire forzato in una filiera
attraverso dei fori molto sottili
e solidificando sotto forma di
fibre
• Queste fibre vengono poi stirate fino a raggiungere una lunghezza che è 5 volte quella originaria. Durante
il processo di stiramento, le molecole del polimero si allineano in modo da sistemarsi parallelamente
all’asse della fibra. Questo fa si che le molecole si impacchettino strettamente l’una vicino all’altra, in modo
che il filo diventa più resistente.
chimica tessile
CHIMICA del CARBONIO
14
• Questo stretto impacchettamento delle molecole di polimero rende anche più difficile a molecole esterne la
penetrazione nella fibra, per cui il poliestere stirato è chimicamente più resistente e assorbe meno acqua
del polimero non stirato: per la stessa ragione è difficile tingere le fibre poliestere in quanto le molecole di
colorante riescono abbastanza difficilmente a sistemarsi tra le catene di polimero.
• Esistono però delle tecniche di colorazione che permettono di ovviare a questo problema.
chimica tessile
CHIMICA del CARBONIO
15
IL POLIAMMIDE (Nylon)
• Il POLIAMMIDE (PA) è un polimero lineare. Le catene quando sono allineate si attraggono tramite legami
idrogeno.
• Esistono diversi tipi di poliammide (PA 6.6 ; PA 6 ; PA 11) che indicano il numero di atomi di carbonio in
ogni monomero (unità di base) di una catena.
• I monomeri sono legati tra di loro mediante polimerizzazione:
• Nel caso del PA 6.6 si avrà la policondensazione tra un una diammina (ammina con due gruppi NH2 e
contenente 6 atomi di carbonio) e un acido bicarbossilico (acido con due gruppi -COOH, contenente in tutto
6 atomi di carbonio) con eliminazione di una molecola di acqua (H2O)
Tra i due monomeri si formerà un gruppo ammidico
• Le catene di PA cristallizzano facilmente, visto che si possono allineare molto bene
tra di loro.
⇒ Questa caratteristica influenza le proprietà della fibra:
∗ Tenacità elevata
∗ resistenza alle flessioni e all’usura (tra le migliori fibre)
∗ resistenza alla gualcitura discreta
⇒ La tenacità può essere differente a seconda del grado di polimerizzazione (numero di monomeri per catena)
e da come viene stirata all’uscita dalla filiera (vedi anche poliestere)
chimica tessile
CHIMICA del CARBONIO
16
Relazioni tra le diverse materie prime per la produzione dei componenti del NYLON (poliammide)
PETROLIO
Cicloesano
Catrame di
carbone
Benzolo
Acido Adipico
HOOC-(CH2)4-COOH
Cicloesanone
Pula di riso
o avena
Furano
Adiponitrile
PETROLIO
Butilene
Idrocaburi semplici
ETILENE
Butadiene
Esametilendiammina
H2N-(CH2)6-NH2
Melassa di cereali
alcool etilico
La cellulosa: cotone, lino, viscosa, acetato
H2C
• La cellulosa è un polimero formato da monomeri di
GLUCOSIO
H
C OH
HO C
H
C
H
OH
O H
H
C
C
OH
OH
• la polimerizzazione avviene per policondensazione
con eliminazione di una molecola d’acqua.
H2C
H
C OH
HO C
H
C
H
OH
O H
H
C
OH
C
H
O
C
OH
C
H
H2C
OH
H
C
H2C
C
H
O
C
O H
OH
C OH
HO C
H
C
H
OH
O H
H
C
C
OH
Polimero di CELLULOSA
OH
• Guardando attentamente si osserva che i monomeri di glucosio sono rovesciati di 180° uno rispetto
all’altro.
I gruppi -OH presenti su ogni monomero (che è poi, come visto, una molecola di glucosio) possono
formare legami idrogeno, tra le diverse catene di cellulosa.
Questi gruppi -OH possono reagire con acido acetico CH3COOH formando un gruppo -COOCH3 (estere)
: se uno solo dei gruppi -OH viene sostituito avremo MONOACETATO se tutti e tre i gruppi -OH
vengono sostituiti avremo TRIACETATO. e dare per esempio delle molecole di ACETATO
⇒ IL COTONE è composto dal 85% di cellulosa, dal 5% di altre fibre e da un 10% di acqua
• Il LINO è composto da circa 70%-84% di cellulosa; il resto da altre fibre simili alla cellulosa,
dal 6% di lignina (che rende la fibra diversa dal cotone), dal 10% di acqua.
• La VISCOSA è cellulosa rigenerata a partire dalla pasta di legno (come l’acetato)
• Il CUPRO viene ottenuta dalla cellulosa contenuta nei linters di cotone mediante il
procedimento cuproammoniacale per solubilizzazione in [Cu(NH3)4 ](OH)2
chimica tessile
CHIMICA del CARBONIO
Il grado di polimerizzazione (vale a dire il numero n di monomeri per catena) varia secondo la fibra
Origine
Grado di polimerizzazione “n”
abete
cotone grezzo
juta
lino
ramié
linters di cotone
600
2100
2200
2400
2600
3000
Fibra
Viscosa
acetato
cupro
Grado di polimerizzazione “n”
400-500
200
500-600
17
chimica tessile
CHIMICA del CARBONIO
18
PROTEINE: Alfa e beta cheratina
LANA E SETA
Le fibre tessili di origine animale più comuni sono:
• La lana
• I “peli lanosi”non proveniente dalla pecora
• la seta
Chimicamente sono fibre proteiche, formate da catene di amminoacidi:
La lana e i peli lanosi sono costituiti da α− cheratina
La seta da fibroina e sericina
R
H
N
H
C
H
O
C
O
H
Un amminoacido è composto da un gruppo amminico -NH2, da un
gruppo carbossilico -COOH legati a un atomo di carbonio centrale.
A questo atomo di carbonio sono legati un atomo di idrogeno e un
gruppo di atomi, che indichiamo per semplicità R.
Esistono circa 20 tipi di gruppi R, e quindi 20 tipi di amminoacidi
Una proteina sarà formata dalla policondensazione diversi amminoacidi, in numero e in sequenza
assolutamente specifico per ogni proteina
Tra i due monomeri si formerà un gruppo ammidico
La struttura tridimensionale dell’alfa cheratina (lana naturale non sottoposta ad alcuna sollecitazione) è
diversa da quella della beta cheratina (fibre di lana sotto tensione) e della fibroina (seta).
chimica tessile
ELICA ALFA
stabilizzata da ponti idrogeno (alfa cheratina)
CHIMICA del CARBONIO
19
FOGLIETTO RIPIEGATO
(beta cheratina e fibroina)
Fibre poliacriliche
Le fibre poliacriliche sono prodotte dalla polimerizzazione (solitamente radicalica) dell'acrilonitrile;
talvolta per modificarne le proprietà all'acrilonitrile si aggiungono altri co-monomeri quali l'acrilato di
metile e l'acetato di vinile. Si veda lo schema sottostante per la relativa struttura molecolare.
Talvolta vengono usati altri copolimeri non acrilici per usi particolari, come ad esempio il cloruro di
vinile per ottenere fibre a bassa infiammabilità (modacrylic fibres), oppure con lo stirene (nelle
plastiche).
chimica tessile
CHIMICA del CARBONIO
20
Fibre poliuretaniche e poliureiche
Solitamente i poliuretani sono utilizzati nella fabbricazione di materiali di imbottitura (sotto forma di
schiume); ma per il settore tessile c'è un'importante eccezione: il Lycra (chiamato tecnicamente
Spandex). Vediamo la sua struttura molecolare.
Altri esempi di poliuretani e poliuree (che spesso sono comunque venduti come poliuretani a causa del
nome “disgustoso”).
Link utili
http://pslc.ws/macrogcss/level2.html
http://www.pslc.ws/macrog/index.htm
http://www.pslc.ws/italian/floor2.htm
chimica tessile
CHIMICA del CARBONIO
21
IL CARBONIO
Il carbonio è un elemento molto versatile. In natura è meno abbondante di altri elementi (come
ossigeno e silicio), ma è facilmente reperibile: la grafite e il diamante sono due forme di carbonio puro
che hanno proprietà fisiche molto diverse.
I diamanti sono cristalli trasparenti ottaedrici, incolori se puri, con colorazioni che vanno dall'azzurro
pallido al nero lucente se contengono impurità. Il dia-mante è la sostanza più dura che si conosca, è un
isolante elettrico ma, opportunamente drogato, si comporta come un semiconduttore. è anche il miglior
conduttore di calore; questa proprietà, unita alla durezza, rende il diamante un ottimo abrasivo, perché
può consumare tutte le altre sostanze senza surriscaldarsi per l'attrito. La maggior parte dei diamanti è
estratta dalle miniere del Sudafrica, altri provengono dal Sud America. I diamanti sono anche prodotti
artificialmente ad alte temperature e pressioni; in genere sono usati negli utensili per tagliare il vetro e
altre sostanze molto dure.
La grafite è un solido nero e lucido; è un ottimo conduttore di elettricità. Si estrae in forma cristallina
o si ottiene scaldando carbone e pece in forni ad altissima temperatura.
ìi diamante e la grafite sono due forme allotropiche del carbonio: sono entrambi solidi cristallini, ma
hanno strutture diverse e quindi diverse proprietà. Nel diamante ogni atomo di carbonio è legato ad
altri quattro atomi in una struttura tridimensionale rigida (v. figura). Nella grafite gli atomi di carbonio
sono disposti in strati; in ogni strato gli atomi sono legati in maglie esagonali. Gli strati possono
scivolare gli uni sugli altri, perciò la grafite è scivolosa al tatto e può essere usata come lubrificante. .
Recentemente è stata scoperta un'altra forma pura del carbonio, che consiste di molecole discrete; la
più stabile di queste molecole giganti è il buckminsterfullerene (C60). Il nome deriva da Buckminster
Fuller, l'ingegnere che ha inventato le cupole geodesiche. La molecola C60 ha una forma cava simile
a$quella di un pallone di calcio.
Si ottiene facilmente in laboratorio bruciando la paraffina sulla fiamma di un bruciatore bunsen. Si
forma così una «fuliggine» che è composta quasi interamente di molecole C60 e, in misura minore, di
molecole più piccole con una struttura simile. Il buckminsterfullerene non è una curiosità da
laboratorio; la sua forma quasi sferica, ad esempio, lascia prevedere che possa essere uno straordinario
lubrificante, che riduce al minimo l'attrito fra due superfici in contatto.
Il carbonio è uno dei costituenti principali di piante e animali. E contenuto in molecole complesse, che
iniziano ad essere trasformate alla morte degli organismi. Così, per graduale decomposizione delle
molecole organiche i resti dei vegetali si arricchiscono di carbonio e si forma il carbone. Scaldando
carbone in assenza di aria si ottiene il coke, costituito da grafite per il 90-95%. Il carbone di legna,
costituito da minuscoli cristalli di grafite, si ottiene per distillazione del legno o delle ossa. Il nerofumo
è un residuo di grafite che si produce bruciando gas naturale in ambiente povero di aria.
Il carbonio trova molte applicazioni in diversi campi. I diamanti sono pietre i, preziose e vengono usati
per la fabbricazione di strumenti che richiedono durezza e resistenza all'uso, come le puntine dei
giradischi. La grafite viene usata in molti casi come lubrificante, ma anche nelle pile a secco, nelle
vernici e nei detersivi. La «mina» delle matite è un miscuglio di grafite e argilla; gli strati di grafite
vengono staccati dalla punta della matita in seguito alla frizione con il foglio di carta. La quantità di
argilla determina la durezza della matita.
Il carbone di legna ha la proprietà di assorbire sulla sua superficie grandi quantità di gas; perciò è
utilizzato negli impianti di depurazione delle acque, nelle maschere antigas e per eliminare le sostanze
coloranti dalle soluzioni (ad esempio nella raffinazione dello zucchero). Il coke è un combustibile ed è
usato, negli altiforni per estrarre il ferro puro dai suoi minerali. Ferro e carbonio, in lega, formano
l'acciaio. Il nerofumo, l'additivo che rende nera la gomma dei pneumatici, viene utilizzato nella
produzione di carta carbone, inchiostri da stampa e lucidi da scarpe.
In più, il carbonio si combina con altri' elementi e forma un'infinità di composti. Gli idrocarburi,
composti da carbonio e idrogeno, sono i, costituenti principali del petrolio e del gas naturale. Gli
idrocarburi e i loro derivati sono così numerosi che un intero settore della chimica, la chimica
chimica tessile
CHIMICA del CARBONIO
22
organica, si occupa di studiarli e di trasformarli per ottenere nuovi prodotti. Il carbonio si trova anche
nell'atmosfera, sotto forma di diossido di carbonio (CO2). In anni recenti è stato dimostrato che
l'accumulo atmosferico di CO2 proveniente dagli scarichi delle combustioni industriali o dalle attività
umane contribuisce al cosiddetto effetto serra, che provoca un graduale riscaldamento della Terra. Il
monossido di carbonio (CO) è un gas combustibile, è inodore, incolore, insapore ed estremamente
velenoso: respirare anche una piccola quantità di monossido di carbonio può essere mortale. Con il
cloro, il carbonio forma il cloroformio (CHC13), un anestetico, e il tetracloruro di carbonio (CC14),
che viene usato come solvente. Il carbonio si combina anche con cloro e fluoro e forma i
clorofluorocarburi (abbreviati con la sigla CFC), usati fino ad oggi negli impianti frigoriferi e nelle
confezioni spray. Oggi i CFC sono vietati, perché la loro dispersione nell'atmosfera danneggia lo
strato di ozono, che protegge la Terra dalle radiazioni solari ultraviolette.
Due forme cristalline allotropiche del carbonio. (a) Diamante: ogni atomo di carbonio è legato ad altri
quattro atomi e forma una unità tetraedrica che si ripete nelle tre dimensioni dello spazio. Le distanze
fra gli atomi di carbonio sono state esagerate. (b) Grafite: gli strati possono facilmente scivolare gli uni
sugli altri. In ogni strato gli atomi di carbonio sono disposti in maglie esagonali.