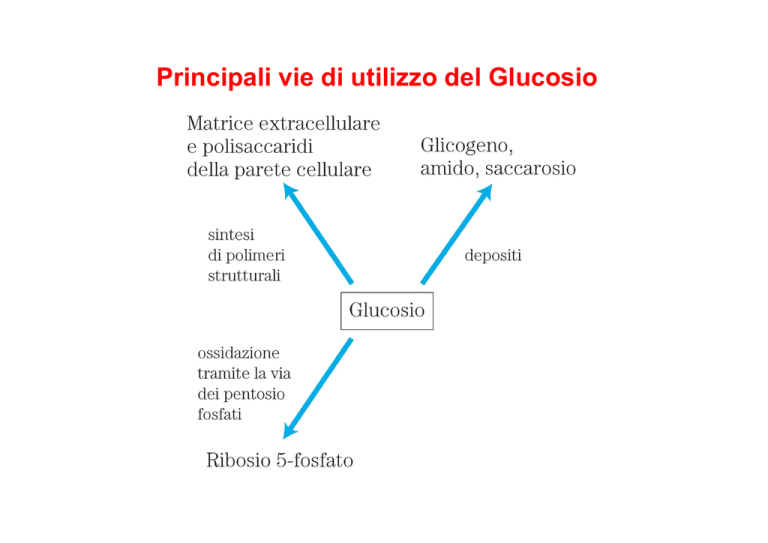
Principali vie di utilizzo del Glucosio
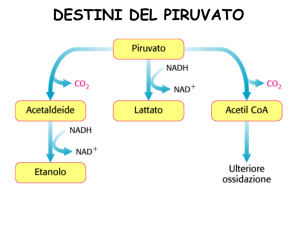
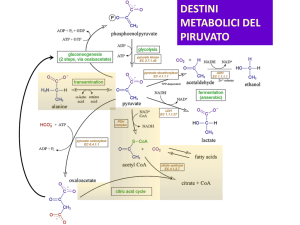
DESTINO DEL PIRUVATO
Il piruvato, può seguire due vie.
• La via fermentativa
• La via della respirazione
cellulare
In presenza di ossigeno, il
piruvato, viene ossidato
completamente a CO2 e
H2O, attraverso il processo
di respirazione cellulare
Fermentazione
Etanolo/ Ac. Lattico
Respirazione cellulare
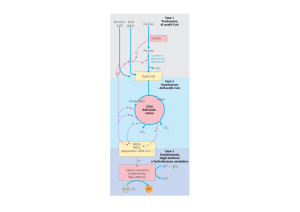
Fase 1
1) Catabolismo di acidi grassi
2) Glucosio
3) Amminoacidi
Fase2
Ciclo dell’acido citrico: ossidazione dell’acetil CoA
con produzione di NADH,FADH2, GTP
Fase 3
Trasferimento di elettroni dal NADH eFADH2
ai trasportatori di elettroni con riduzione dell’O2
Fosforilazione ossidativa che consente di
produrre ATP
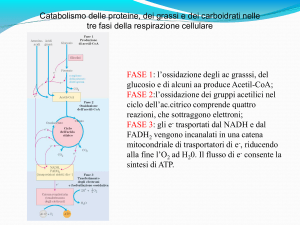
Fasi della respirazione cellulare
La respirazione cellulare ha luogo in 3 fasi:
- prima fase : il piruvato forma un composto a 2 atomi di
carbonio, ossia il gruppo acetilico inserito nell’Acetil-CoA.
-seconda fase : tali gruppi acetilici entrano nel ciclo
dell’acido citrico che provvede a ossidarli per via enzimatica a
CO2. In questo processo, l’energia rilasciata dall’ossidazione
viene conservata mediante la riduzione contemporanea di
due trasportatori di elettroni NAD+ e FAD, che divengono
NADH e FADH2.
-terza fase : i cofattori ridotti sono ossidati a loro volta
liberando protoni H+ ed elettroni. Gli elettroni vengono
trasferiti attraverso trasportatori che compongono la catena
respiratoria, sino all’ossigeno che si riduce formando acqua.
Durante questo processo viene rilasciata una notevole
quantità di energia, tramutata in ATP per mezzo della
cosiddetta fosforilazione ossidativa
Decarbossilazione del piruvato e Formazione di acetil-CoA
Il piruvato, derivato dalla glicolisi, viene ossidato nei
mitocondri ad opera di tre enzimi che compongono il
complesso della piruvato deidrogenasi che catalizza
una reazione di decarbossilazione ossidativa :
il gruppo carbossilico del piruvato viene rilasciato come
CO2. I due atomi di carbonio rimanenti costituiscono il
gruppo acetilico legato al coenzima A
PROCESSO IRREVERSIBILE
Fase I: formazione di acetil-CoA
catalizzatore: complesso multienzimatico della
piruvato deidrogenasi
TRE enzimi + CINQUE coenzimi
Localizzazione: nei mitocondri delle cellule eucariotiche
nel citosol delle cellule procariotiche
E1 = piruvato deidrogenasi (piruvato decarbossilasi) - TPP
E2 = diidrolipoil transacetilasi – acido lipoico
E3 = diidrolipoil deidrogenasi – FAD
+ NAD+ , CoASH
(il complesso multienzimatico contiene più copie dei tre enzimi)
Fanno parte del complesso anche due proteine regolatrici:
una chinasi e una fosfatasi
Complesso della piruvato deidrogenasi
(da E.coli)
Regione
centrale
formata da 24
molecole di E2
Circondata da 24 molecole di E1 e da12
molecole di E3
Complesso PDH isolato
da rene bovino.
60 copie di E2
E2 con più domini lipoilici
E2 presenta tre domini funzionali distinti
TPP = coenzima di E1: piruvato deidrogenasi
(piruvato decarbossilasi)
La Tiamina pirofosfato (TPP)
derivato della tiamina (Vitamina B1)
R2
R1
-
E2: diidrolipoil transacetilasi
Coenzima = acido lipoico
(lipoato)
COENZIMA A: accettore del gruppo acetile
CoA-SH
E3: diidrolipoil deidrogenasi
Coenzima: FAD = Flavin Adenin Dinucleotide
(idrochinone)
E3: diidrolipoil deidrogenasi
Coenzima: NAD = Nicotiammide Adenin Dinucleotide
E1: decarbossilazione del piruvato e formazione
di idrossietil-TPP
CO2
idrossietil-TPP
Attacco nucleofilo
del carbanione della
TPP sul carbonio
carbonilico del
piruvato
Fermentazione alcolica
Piruvato
Piruvato
decarbossilasi
Acetaldeide
ADH
Etanolo
Protonazione
del carbanione
Rilascio di CO2
Formazione di
un carbanione
stabilizzato per
risonanza
E1: trasferimento del gruppo acetile e di elettroni al lipoato
idrossietil-TPP
CoA-SH
E2: transesterificazione in cui il gruppo SH del CoA si
sostituisce al gruppo -SH di E2.
E3 diidrolipolil deidrogenasi: riossidazione del lipoato
FAD
NADH + H+
FADH2
NAD+
Sito attivo della diidrolipoil deidrogenasi
D. Voet, J.G. Voet, C.W. Pratt,
FONDAMENTI DI BIOCHIMICA
2/E, Zanichelli Editore S.p.A.
Copyright © 2007
Incanalamento dei substrati
Mutazioni nella PDH o carenza di Tiamina nella dieta sono causa di alterazioni
della funzionalità neuronale (Beriberi)
Regolazione della piruvato deidrogenasi
1. Regolazione allosterica:
Attivatori:
NAD+
CoA-SH
AMP
Inibitori:
NADH
acetil-CoA
ATP
2. Regolazione da modificazione covalente:
inattivazione mediante specifica chinasi che fosforila E1
(la piruvato deidrogenasi chinasi è attivata da NADH e acetil-CoA)
attivazione medante fosfatasi che defosforila l’enzima
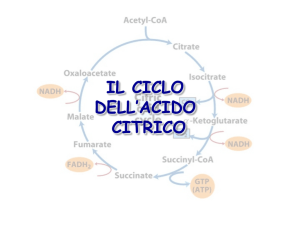
CICLO DEGLI
ACIDI TRICARBOSSILICI
Reazione
:condensazione
Formazione del citrato
: l’acetil-CoA viene condensato con
l’ossalacetato per formare citrato, reazione catalizzata dalla citrato sintasi.
Nella reazione il C del gruppo acetilico si lega al C-2 dell’ossalacetato.
La grande variazione di energia libera è essenziale per l’operatività del ciclo.
La citrato sintasi è attivata allostericamente da Ca2+ed ADP ed è inibita da
ATP NADH , succinilCoA e acilCoa derivanti dagli acidi grassi.
La reazione dipende inoltre dalla disponibilità dei substrati
Modificazioni conformazionali della citrato sintasi
Forma aperta
Forma chiusa che lega l’ossalacetato
Ognuna delle due subunità dell’enzima omodimerico è costituita da due
domini;
L’ossalacetato legandosi induce un cambiamento conformazionale nel
dominio flessibile creando un secondo sito attivo per l’acetil CoA.
Quando nel sito attivo si forma il citroil –CoA un’altra modifica
conformazionale determina l’idrolisi del tioestere con il rilascio di CoA
Il legame tioestere attiva gli idrogeni metilici
Asp375 estrae un protone dal gruppo metilico
L’enolato si riarrangia per attaccare il
carbonio carbonilico dell’ossalacetato
His 274 estrae un protone precedentemente
ceduto
His320 si comporta da acido cedendo un
protone
Viene idrolizzato il legame tioestere
Si libera citrato e CoA
Reazione
:isomerizzazione
Formazione dell’isocitrato :reazione di isomerizzazione del citrato,
per mezzo dell’enzima aconitasi.
L’enzima è inibito da fluoroacetato, usato come veleno ratticida
Il Centro ferro zolfo dell’aconitasi agisce sia nel legame del substrato
nel sito attivo sia nell’aggiunta o rimozione catalitica dell’acqua
Reazione
:ossidazione e decarbossilazione
Ossidazione dell’isocitrato : per mezzo dell’isocitrato deidrogenasi che
opera una decarbossilazione ossidativa convertendolo ad α-chetoglutarato e
CO2 .
Enzima attivato allostericamente da ADP , che indica un basso livello energetico
E’ inibito da ATP e NADH i cui livelli sono elevati quando la cellula ha riserve
energetiche abbondanti
Isocitrato deidrogenasi NAD-dipendente = mitocondri
Isocitrato deidrogenasi NADP-dipendente= citoplasma
Reazione
:ossidazione e decarbossilazione
Inibitori: succinil-CoA, ATP, GTP, NADH
L’α-chetoglutarato
viene convertito a succinil-CoA e CO2 mediante
decarbossilazione ossidativa per mezzo dell’ α-chetoglutarato deidrogenasi, in questa
tappa il NAD+ è l’accettore finale degli elettroni.
Reazione
:fosforilazione a livello di substrato
Succinil-CoA sintetasi
o
succinato tiochinasi
Scissione del succinil CoA a succinato :
Il GTP prodotto da questa reazione nel mitocondrio è prevalentemente usato dall'enzima
mitocondriale nucleoside difosfo chinasi per una reazione di transfosforilazione in cui
viene prodotto ATP a partire da ADP:
Il GDP necessario per la reazione della succinil-CoA sintetasi viene così rigenerato
GTP + ADP
Mg2+
GDP + ATP
nucleoside difosfato chinasi
fosforilazione a livello di substrato
GTP
GDP
Reazione
:ossidazione
*
*enzima associato alla membrana mitocondriale interna
Ossidazione del succinato a fumarato:. Gli elettroni dal succinato passano al
FAD riducendolo. Il FADH2 cede gli equivalenti riducenti alla catena di trasporto
degli elettroni della membrana interna del mitocondrio.
Reazione :idratazione
Idratazione del fumarato: di natura reversibile, catalizzata dalla fumarasi
che converte i fumarato in malato;
Reazione
:ossidazione
Ossidazione del malato : l’ultima reazione del ciclo consente di
ossidare il malato in ossalacetato mediante L-malato deidrogenasi (NAD
dipendente)
REGOLAZIONE DEL CICLO DI KREBS
- Disponibilità di substrato
- Inibizione da accumulo di
prodotti
- Inibizione allosterica retroattiva
regolazione dei primi enzimi del
ciclo da parte di prodotti di reazioni
successive
7,5
1,5
10
Acetil-CoA + 3 NAD+ + FAD + GDP + Pi + 2 H2O
2 CO2 + 3 NADH + FADH2 + CoA-SH + GTP + 3 H+
Formazione di
coenzimi ridotti e di
ATP nell’ossidazione
aerobica del glucosio
Stechiometria della riduzione dei coenzimi e della formazione di ATP
nell’ossidazione aerobica del glucosio attraverso le tre fasi della
respirazione cellulare
NADH/FADH2
Glucosio
Glucosio 6P
Fruttosio 6P
Glicolisi
2 1,3 Bifosfoglicerato
-1ATP
2NADH
3/5
2 1,3 Bifosfoglicerato
2 3Fosfoglicerato
2ATP
2 Fosfoenol piruvato
2 Piruvato
2ATP
2 Piruvato
Ciclo di
Krebs
-1ATP
Fruttosio 1,6 Bifosfato
2 Gliceraldeide 3 P
ATP
2 Aceti-CoA
2 chetoglutarato
2 Isocitrato
2 chetoglutarato
2 succinil CoA
2 succinato
2 malato
2 succinil CoA
5
2NADH
5
2NADH
5
2 succinato
2 fumarato
2 ossalacetato
TOTALE
2NADH
2ATP/GTP
2FADH2 3
2NADH
10 + 2
5
30-32
Regolazione del flusso di
metaboliti nel ciclo di Krebs
da parte della piruvato
deidrogenasi e degli enzimi
coinvoti nel ciclo di Krebs
Nei batteri anaerobici il ciclo dell’acido citrico è incompleto
perché manca la -chetoglutarato deidrogenasi
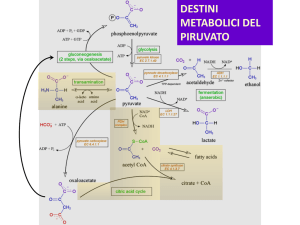
Il ciclo di Krebs è una via anfibolica:
- riceve intermedi del catabolismo di carboidrati,
acidi grassi, amminoacidi
……………è anche fonte di precursori per molte vie
biosintetiche
In rosso le reazioni anaplerotiche che riforniscono il ciclo degli intermedi sottratti
Prelevano intermedi del ciclo TCA per le vie biosintetiche
Biosintesi del glucosio
(Gluconeogenesi)
L’ossalacetato prodotto nei
mitocondri è trasformato in
malato che è trasportato
attraverso la membrana
mitocondriale e poi
ritrasformato in
ossalacetato e convertito in
PEP
Biosintesi degli acidi grassi
Processo che avviene nel citosol che richiede Acetil-CoA che
non può essere trasportato attraverso i mitocondri, pertanto è
prodotto nel citosol.
L’acetil-CoA citosolico è prodotto dalla scissione del citrato,
che può attraversare al membrana mitocondriale.
ATP + citrato+ CoA
ADP+ Pi + ossalacetato+ Acetil-CoA
ATP citrato liasi
Biosintesi degli amminoacidi
COO CH2
+ NADH+ H + + NH4
CH2
H C NH3 +
COO -
Riforniscono il ciclo di Krebs di intermedi
Piruvato
carbossilasi
+ HCO3- + ATP
ossalacetato + ADP + Pi
- attivazione da acetil-CoA
il coenzima della piruvato carbossilasi è la BIOTINA
RUOLO DELLA BIOTINA NELLA REAZIONE
CATALIZZATA DALLA PIRUVATO
CARBOSSILASI
HCO3 - + Piruvato + ATP
Ossalacetato+ ADP+ Pi
IL BRACCIO DELLA BIOTINA LEGATO ALLA LYS DELLA PIRUVATO
CARBOSSILASI (ENZIMA TETRAMERICO) SPOSTA LA CO2
TRASFERENDOLA DAL SITO ATTIVO DI UN MONOMERO A QUELLO DEL
MONOMERO ADIACENTE
Meccanismo d’azione della
piruvato carbossilasi
e ruolo della biotina nella
carbossilazione del piruvato in
ossalacetato
Bracci biologici
CICLO DEL GLIOSSILATO
Il ciclo del gliossilato è presente
nelle piante in alcuni invertebrati
e nei microrganismi e produce
intermedi a 4 atomi di carbonio a
partire da acetato
Il succinato prodotto può essere
convertito in ossalacetato, che
può essere usato per sintetizzare
glucosio
attraverso
la
gluconeogenesi.
Relazione tra
il ciclo del gliossilato
e quello dell’acido citrico
Il
ciclo
del
gliossilato è attivo
durante
la
germinazione dei
semi
di
alcune
piante e in certi
microrganismi che
possono
vivere
usando
acetato
come unica fonte
di carbonio.
Regolazione coordinata
del ciclo del gliossilato
e dell’acido citrico
Se c’è un ridotto rifornimento energetico
La fosfatasi viene attivata, defosforila
l’isocitrato deidrogenasi attivandola,
favorendo il ciclo dell’acido citrico