RAPPRESENTAZIONE SCHEMATICA ENERGIA RELATIVA ORBITALI
E
3s
≈ 2s
3p
3d
3d
3d
3s
2p
2s
3p
3s
2p
2s
1s
3p
2p
1s
IDROGENO (Z = 1)
LITIO (Z = 3)
1s
POTASSIO (Z = 19)
Per Z = 1 (atomo di idrogeno: monoelettronico) l’energia degli orbitali dipende solo dal numero
quantico principale n. Per Z > 1 (atomi polielettronici) l’energia dipende sia dal numero quantico n
che dal numero quantico secondario l. Quindi, per Z > 1 E2s< E2p e E3s< E3p< E3d
PERCHÈ? EFFETTO SCHERMO
Se in un atomo ci sono più elettroni, questi risentiranno non solo della FORZA ATTRATTIVA del
NUCLEO (e- nucleon+), ma anche della FORZA REPULSIVA tra gli ELETTRONI (e- e-).
Si osserva uno SCHERMAGGIO della CARICA NUCLEARE (di valore Z), nei confronti di un e-, da
parte degli e- PIU’ INTERNI.
CARICA EFFICACE Zeff = Z - S
Z = n° atomico = n° eS = schermo degli e- interni
CARICA EFFICACE (Zeff) è sempre minore della carica nucleare effettiva, esprime la carica risentita
da ogni singolo elettrone valutando l’effetto schermante del nucleo esercitato da tutti gli altri
elettroni.
DISTRIBUZIONE DI PROBABILITÀ RADIALE
ORBITALI 3s, 3p, 3d
Ψ 2 • 4π r2
CAPACITÀ PENETRANTE
3s > 3p > 3d
Zeff (3s) > Zeff (3p) > zeff (3d)
3d
+
3p
3s
r
L’elettrone nell’orbitale s spende più tempo vicino al nucleo dell’elettrone p avente lo stesso numero
quantico n.
Per n = 2: 2s è PIÙ PENETRANTE di 2p perché 2s SCHERMA 2p. Quindi 2p risente di una carica
nucleare Zeff minore dell’elettrone 2s e E2s < E2p
Analogo discorso vale per gli orbitali d
Per n = 3: 3s è PIÙ PENETRANTE (SCHERMA) 3p
3p è PIÙ PENETRANTE (SCHERMA) 3d
E3s < E3p < E3d
CONFIGURAZIONE ELETTRONICA
Come ordinare gli elettroni all’interno degli orbitali negli atomi nello stato fondamentale
Gli elettroni vanno ad “OCCUPARE” gli ORBITALI disponibili a PIÙ BASSA ENERGIA in modo da
rendere MINIMA L’ENERGIA DELL’ATOMO, seguendo le seguenti regole:
a) PRINCIPIO DI ESCLUSIONE DI PAULI
b) PRINCIPIO DI MASSIMA MOLTEPLICITÀ (REGOLA DI HUND)
I tre numeri quantici (n, l, m) consentono di definire l’orbitale (Ψn,l,m) e la sua energia (E = f(n,l)), ma
non definiscono ancora il singolo elettrone perché non tengono conto dello SPIN dell’elettrone.
SPIN dell’ELETTRONE
L’elettrone ruota su se stesso creando un CAMPO
MAGNETICO in 2 direzioni: ms = -1/2 e ms = +1/2
PRINCIPIO DI ESCLUSIONE DI PAULI: Ogni orbitale (Ψn,l,m) può contenere solo 2 elettroni e un
elettrone avrà ms = -1/2 e l’altro avrà ms = +1/2. Ovvero, gli elettroni accoppiati nello STESSO
ORBITALE devono avere SPIN OPPOSTO. In questo modo il campo magnetico risultante è uguale a
0 (minore repulsione magnetica).
Es:
(atomo di He) orbitale 1s (Ψ1,0,0) 2e- accoppiati con SPIN OPPOSTO (Ψ1,0,0,-1/2) e (Ψ1,0,0,+1/2)
REGOLA DI HUND: ∑ms MASSIMA
GLI ORBITALI DEGENERI (STESSA ENERGIA) VENGONO “OCCUPATI” DAGLI ELETTRONI COSÌ
CHE LA SOMMA VETTORIALE DEGLI SPIN (∑ms) SIA MASSIMA. GLI ELETTRONI CERCANO DI
DISPORSI IL PIÙ LONTANO POSSIBILE: MINOR REPULSIONE ELETTRICA. Ovvero gli elettroni si
dispongono negli ORBITALI DEGENERI con SPIN PARALLELO e solo dopo si accoppiano coi
precedenti.
3 orbitali p (DEGENERI)
3e-
Metodo AUFBAU
4e-
3 orbitali d (DEGENERI)
5e-
6e-
NUMERO MASSIMO DI ELETTRONI PER LIVELLO = 2n2
STRUTTURA ELETTRONICA DEGLI ELEMENTI
(ATOMI NELLO STATO FONDAMENTALE)
E
5s
4s
≈
3s
2s
1s
4d
4p
3d
Tecnezio, [Kr] 5s2 4d5
Stronzio,
Rubidio, [Kr]
[Kr] 5s
5s12
10
10
10
10
10
24s
2
24p
24p
214p
564 32
10
24p
Germanio,
Arsenico,
Selenio,
Bromo,
[Ar]
[Ar]
[Ar]
[Ar]
3d
3d
3d
3d
4s
4s
4s
4s
4p
Gallio,
3d
Cripto,[Ar]
[Ar]
3d
4s
4p
I serie di transizione
2 2s
2 2s
2 2p
2 2p
6 3s
6 3s
1 3p
1 3p
6 4s
6 4s
2 1
Calcio, 1s1s
Potassio,
2 2p6 3s2 3p6
Argon, 1s2 2s
22s
21s
22
22p
22p
22s
62p
6623s
62p
22
23p
6
23s
43p
522 33p1
3p
Cloro,
Zolfo,
Fosforo,
Silicio,
Alluminio,
1s
1s
1s221s
2s
2s
2s
2p
3s
3s
3s
3p
3p
3° livello completato (molto stabile)
Sodio,
Magnesio,
1s2 2s
1s222p
2s62 3s
2p16 3s2
2p
2 2p6
Neon, 1s222s
2
2 222p
12325 24
2
22p
Boro,
Azoto,
1s
1s
2s
Fluoro,
Ossigeno,
1s2s
1s
2s
2s
2p
2p
Carbonio,
1s
2s
2p
2° livello completato (molto stabile)
Litio,
1s21s
2s212s2
Berillio,
Elio, 1s2
Idrogeno, 1s1
1° livello completato (configurazione molto stabile)
STRUTTURA ELETTRONICA DEGLI ELEMENTI
(ATOMI NELLO STATO FONDAMENTALE)
All’aumentare di Z l’energia degli orbitali diminuisce.
Variazione dei livelli energetici degli orbitali atomici al crescere
del numero atomico Z (non in scala)
Inversione dei livelli energetici 4s, 4p, 3d.
Per Z ≤ 20 E4s < E3d
Per Z > 20 E4s > E3d
Scandio: [Ar] 4s2 3d1
Titanio: [Ar] 4s2 3d2
Vanadio: [Ar] 4s2 3d3
Cromo: [Ar] 4s1 3d5
Manganese: [Ar] 4s2 3d5
Ferro: [Ar] 4s2 3d6
Nichel: [Ar] 4s2 3d8
CONFIGURAZIONI
ELETTRONICHE
INATTESE
Ci saremmo aspettati
Rame: [Ar] 4s1 3d10
4s2 3d4
Zinco: [Ar] 4s2 3d10
4s2 3d9
Cobalto: [Ar] 4s2 3d7
PROPRIETÀ MAGNETICHE DEGLI ELEMENTI
DERIVANO DALLA CONFIGURAZIONE ELETTRONICA DEGLI ATOMI
- Atomi con ELETTRONI SPAIATI (∑ms ≠ 0) diventano piccoli magneti e vengono attratti da un
campo magnetico. Tali sostanze vengono dette PARAMAGNETICHE. Dalla forza di attrazione
magnetica si può determinare il numero di elettroni spaiati nell’atomo.
- Atomi con solo ELETTRONI ACCOPPIATI (∑ms = 0) sono debolmente respinti da un campo
magnetico e sono detti DIAMAGNETICI (il campo magnetico esterno perturba il moto degli elettroni
ed induce un campo magnetico (Legge di Lorenz) che ha direzione opposta al campo magnetico
applicato).
Ossigeno
(O2)
•O
O•
Il paramagnetismo, quando presente, maschera il diamagnetismo,
essendo prevalente in ordine di grandezza.
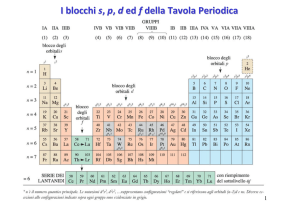
CLASSIFICAZIONE PERIODICA DEGLI ELEMENTI
LA TAVOLA PERIODICA
Con il meccanismo dell’AUFBAU (riempimento), applicato agli atomi ordinati secondo Z
crescente e andando a capo (PERIODO) dopo aver raggiunto la configurazione ns2 np6 (propria
del gas nobile), ovvero dopo aver raggiunto l’OTTETTO (8 e- sull’ultimo livello: sistema sferico
particolarmente stabile), si evidenzia il ripetersi PERIODICO delle STRUTTURE ELETTRONICHE
ESTERNE lungo il GRUPPO
GRUPPI
PERIODI
CLASSIFICAZIONE PERIODICA DEGLI ELEMENTI
LA TAVOLA PERIODICA
Scendendo lungo un GRUPPO si ritrova la STESSA CONFIGURAZIONE ELETTRONICA ESTERNA,
ovvero stesso numero di e- nel guscio (livello n) più esterno e presenti negli stessi tipi di orbitali.
n° GRUPPO = n° e- più esterni = n° e- di valenza (coinvolti nella FORMAZIONE DEI LEGAMI).
8
1A
2A
3A 4A 5A 6A 7A
Poiché le strutture elettroniche esterne degli
elementi sono periodiche, essendo solo gli edi valenza quelli che entrano in gioco nella
formazione dei legami, allora anche le
PROPRIETÀ CHIMICO-FISICHE degli elementi
sono FUNZIONE PERIODICA di Z (n° atomico)
e sono SIMILI lungo IL GRUPPO (stesso n° e-).
s
-
1A – 1 e di valenza (metalli ALCALINI)
2A – 2 e- di valenza (metalli ALCALINO-TERROSI)
1
p
H
1
s
Li
3
Be
4
2
p
Na Mg
11 12
K Ca
19 20
Elementi di transizione
Sc Ti
21 22
Rb Sr
37 38
p
2
p
3
p
4
p
5
F
9
He
2
B
5
C
6
N
7
O
8
Ne
10
Al
13
Si
14
P
15
S Cl Ar
16 17 18
V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr
23 24 25 26 27 28 29 30 31 32 33 34 35 36
Y Zr Nb Mo Tc Ru Rh Pd Ag
39 40 41 42 43 44 45 46 4
7
Cs Ba La Hf Ta W Re Os Ir Pt Au
55 56 57 72 73 74 75 76 77 78 79
Fr Ra Ac
87 88 89
1
6
Cd In Sn Sb Te
48 49 50 51 52
I Xe
53 54
Hg Tl Pb Bi Po At Rn
80 81 82 83 84 85 86
Ce Pr Nb Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
58 59 60 61 62 63 64 65 66 67 68 69 70 71
Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lw
90 91 92 93 94 95 96 97 98 99 100 101 102 103
PROPRIETÀ PERIODICHE DEGLI ELEMENTI
Dipendono dall’andamento di Z, o meglio di Zeff.
Zeff = Z – S = Carica nucleare sentita dagli e- più esterni (di valenza). S = schermatura e- più interni.
Determina
a) DIMENSIONI DELL’ATOMO (RAGGIO ATOMICO)
b) ENERGIA DI IONIZZAZIONE (EI o I)
c) AFFINITA’ ELETTRONICA (EA)
Come varia Zeff
Ricordando che
Zeff
gli elettroni nello stesso livello n hanno scarsa azione di schermo
gli elettroni nei livelli sottostanti (n-1) hanno elevata azione di schermo
AUMENTA LUNGO UN PERIODO (aumenta la forza attrattiva del nucleo mentre i nuovi e-,
si posizionano sullo stesso livello, non hanno particolare potere schermante
VARIA POCO LUNGO IL GRUPPO (Z e S aumentano entrambi e di conseguenza si hanno
variazioni poco significative).
Zeff è la carica nucleare sentita dall’elettrone esterno, quindi DETERMINA
L’ESTENSIONE NELLO SPAZIO DELL’ORBITALE occupato dall’elettrone, ossia
LE DIMENSIONI DELL’ATOMO
DIMENSIONI ATOMICHE: IL RAGGIO ATOMICO
RAGGIO ATOMICO: metà della
distanza di avvicinamento tra due
atomi dello stesso elemento in
una molecola (gas o in un
cristallo metallico).
RAGGI ATOMICI
SPERIMENTALI
ratomo = ½ d
H
d
H
d = 74 pm, r = 37 pm
rA ∝ n2/Zeff
Quindi:
rA
DIMINUISCE
LUNGO
PERIODO (n = cost.; Zeff aumenta) e
AUMENTA
LUNGO
GRUPPO
(n
aumenta; Zeff ~cost.)
I valori sopra riportati si riferiscono agli atomi isolati ma sono estrapolati
METALLI - RAGGIO METALLICO:
metà della distanza tra i nuclei di
due atomi in contatto tra loro nel
metallo solido cristallino.
Na
Na
d
NON
METALLI
RAGGIO
COVALENTE: metà della distanza
tra i nuclei di due atomi identici
uniti da un legame covalente (con
sovrapposizione di orbitali).
Cl + Cl
Cl2
r=1/2 d < rA isolato
d
GAS NOBILI: esistono solo
come ATOMI ISOLATI. I dati
sono estrapolati come se
esistesse un’ipotetica molecola.
ENERGIA O POTENZIALE DI IONIZZAZIONE
EI = Energia necessaria per rimuovere (distanza infinita) 1 e- da un atomo o ione gassoso
X(g)
X+ + e- + EI
E’ l’opposto dell’energia coulombiana che attrae l’elettrone al nucleo.
Si esprime in eV (1.6022•10-19 J) o in KJ/mol [1.6•10-19 J x 6.022•1023 = 96.48 KJ/mol (di e-)]
COME VARIA L’ENERGIA DI
IONIZZAZIONE?
EI = -Ecoul = (e- x Zeff) / rA
AUMENTA MOLTO LUNGO IL PERIODO
Zeff aumenta mentre rA diminuisce
DIMINUISCE POCO LUNGO IL GRUPPO
Zeff ∼ costante mentre rA aumenta
ENERGIA O POTENZIALE DI IONIZZAZIONE
Be: 1s2 2s2
Be+: 1s2 2s1
B: 1s2 2s2 2p1
B+: 1s2 2s2
Un orbitale pieno (s2) è più stabile (simmetria
sferica). Ecco perché il Boro ha EI < del Berillio
N: 1s2 2s2 2p3
N+: 1s2 2s1 2p2
O: 1s2 2s2 2p4
O+: 1s2 2s2 2p3
I tre orbitali p semipieni sono più stabili (simmetria
sferica). Ecco perché l’Ossigeno ha EI < dell’azoto
LE ENERGIE DI IONIZZAZIONE SUCCESSIVE,
FINALIZZATE ALL’ESPULSIONE DI UN SECONDO O
TERZO ELETTRONE (SECONDARIA, TERZIARIA, ETC.)
SONO SEMPRE NETTAMENTE SUPERIORI ALLA
ENERGIA DI IONIZZAZIONE PRIMARIA (CRESCE Zeff)
CARATTERE METALLICO
Quanto minore è EI tanto più facilmente si forma X+, quindi tanto maggiore è il
CARATTERE METALLICO dell’elemento (80% degli elementi ha carattere metallico). Ne
consegue che il carattere metallico DIMINUISCE lungo il PERIODO e AUMENTA lungo il
GRUPPO.
AFFINITÀ ELETTRONICA
EA = Energia liberata quando a un atomo neutro (isolato = gassoso) viene addizionato 1 eX(g) + e-
X- +
EA
Si esprime in eV (1.6022•10-19 J) o in KJ/mol [1.6•10-19 J x 6.022•1023 = 96.48 KJ/mol (di e-)].
COME VARIA L’AFFINITÀ
ELETTRONICA?
EA ∝ Zeff / rA
AUMENTA LUNGO IL PERIODO
(in valore assoluto)
Zeff aumenta mentre rA diminuisce
DIMINUISCE LUNGO IL GRUPPO
(in valore assoluto)
Zeff ∼ costante mentre rA aumenta
RAGGI IONICI
Si ricavano sperimentalmente dalle distanze fra ioni nel cristallo ionico. Es.: Li+Fa)
eee-
Atomo
Li
1s2 2s1
+
+
+
CATIONE
Li+
1s2
rcatione << ratomo
b)
Atomo + eF + e1s2 2s2 2p5 + e-
CATIONE
F1s2 2s2 2p5
ranione >> ratomo
180
F r+
C s+
160
Rb+
140
120
S r 2+
100
N a+
C a 2+
80
60
40
20
R a 2+
B a 2+
K+
L i+
B e 2+
B 3+
C 4+
M g 2+
A l 3+
S i 4+
P 5+
C I 7+
Sc 3+
C r 6+ 7+
Mn
C d 2+
3+
Y
A g 2+
4+
In 3+
Zr
Z n 2+
Sn 4+
4+
P
d
3+
Ga
S b 5+
7+
T
c
4+
Ge
I 7+
B r 5+
0
Z
H g 2+
L a 3+
H f 4+
T l 3+
P b 4+
B i 5+
P t 4+
A t 7+
R e 7+
A c 3+