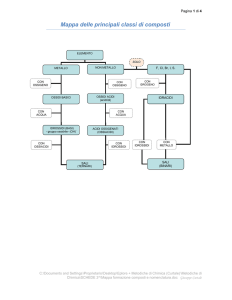
NOMENCLATURA
Gli elementi chimici possono essere classificati in due grosse categorie:
- metalli
- non metalli
I metalli danno luogo a una serie basica di composti, mentre i non metalli danno luogo a
una serie acida. Ovvero:
Serie basica:
Metallo + O2 → Ossido (basico);
Ossido (basico) + H2O → Idrossido (base)
Serie acida:
Non metallo + O2 → Anidride (ossido acido);
Anidride + H2O → Acido (ossiacido)
I sali (che possono essere sali binari o sali ternari) sono ottenuti facendo reagire un
composto acido con un composto basico.
Nomenclatura chimica tradizionale e nomenclatura IUPAC
La nomenclatura tradizionale si basa sull’uso di determinati prefissi e suffissi.
La nomenclatura IUPAC invece utilizza opportuni prefissi moltiplicativi allo scopo di
evidenziare il numero di atomi o raggruppamenti di atomi presenti in una molecola. I
prefissi moltiplicativi sono i seguenti:
1 - mono
2 - di
3 - tri
4 - tetra
5 - penta
6 - esa
7 - epta
8 – octa
Regole per la costruzione dei composti binari
Ogni composto è rappresentabile con una formula i cui simboli esprimono, sinteticamente,
i tipi di atomi e il loro numero. Per esempio una molecola di CO 2, diossido di carbonio,
contiene un atomo di carbonio e due atomi di ossigeno. Il numero due, in basso a destra di
O, si chiama indice numerico e ci indica quanti atomi di ossigeno ci sono nella molecola o
nella formula. A destra del C non ci sono numeri; per convenzione il simbolo nudo
sottintende il numero uno.
Gli atomi formano legami utilizzando gli elettroni degli orbitali esterni: condividendoli,
cedendoli o catturandoli dagli atomi vicini. Da qui deriva il concetto di valenza.
In passato, quando non era chiara la natura del legame chimico, si confrontavano le
formule dei composti con quelle di composti analoghi contenenti idrogeno oppure
ossigeno. La valenza di un elemento era data dal numero di idrogeni o dal doppio degli
ossigeni necessari per rimpiazzare l'elemento considerato. Per esempio, in AgCl l'argento
sostituisce un idrogeno di HCl, quindi Ag ha valenza 1.
Conoscere la valenza degli elementi combinati è di fondamentale importanza per
assegnare i nomi e scrivere le formule corrette dei composti. Per ricavare le valenze
dobbiamo conoscere le configurazioni elettroniche dei composti.
Analogo al concetto di valenza è quello di numero di ossidazione legato al primo dalla
relazione Valenza = Numero di ossidazione senza segno. Lo stato di ossidazione (o
numero di ossidazione) di un elemento chimico in un composto è definito come la
differenza tra il numero di elettroni di valenza dell'atomo considerato e il numero di
elettroni che ad esso rimangono dopo aver assegnato tutti gli elettroni di legame all'atomo
più elettronegativo di ogni coppia. Il numero di ossidazione (abbreviato in "n.o.") è positivo
se gli elettroni vengono ceduti, mentre è negativo se vengono acquistati.
NB. Nella tavola periodica è indicato il numero di ossidazione perciò occorre “togliere” il
segno per ottenere la valenza.
Il Fluoro ha un solo numero di ossidazione (-1) perciò avrà solo
una valenza: 1
Il coloro ha 5 numeri di ossidazione (-1, 1, 3, 5 e 7) ma 4 valenze:
1, 3, 5 e 7 (la valenza che deriva dal numero di ossidazione 1 e 1 è la stessa)
I composti binari sono composti formati da due soli elementi chimici. Per convenzione,
l'elemento con elettronegatività minore (e quindi con il numero di ossidazione positivo)
viene scritto per primo e l'elemento più elettronegativo (con numero di ossidazione
negativo) per secondo. Vi sono comunque eccezioni a tale regola di cui diremo nei singoli
casi.
Il simbolo di ciascun elemento chimico è seguito da un numero a pedice, detto indice, che
indica quanti atomi di quell'elemento sono presenti nel composto. Gli indici sono apposti in
modo tale che, sommando i rispettivi numeri di ossidazione, la molecola risulti neutra.
Per calcolare gli indici in modo semplice è sufficiente utilizzare il numero di ossidazione del
primo elemento come indice del secondo e viceversa. Ad esempio se volessimo scrivere la
formula chimica di un composto binario formato da un elemento A il cui numero di
ossidazione sia +2 e da un composto B il cui numero di ossidazione sia -3, avremo:
Si noti che l'elemento con il numero di ossidazione positivo (il meno elettronegativo) è
stato scritto per primo. Tale metodo di costruzione dei composti binari è detto "Regola
dell'incrocio" e garantisce la neutralità della molecola. Infatti nella molecola sono presenti
complessivamente 3 atomi di A (= 6 cariche positive) e 2 atomi di B (= 6 cariche negative).
Se dopo aver calcolato gli indici questi risultino divisibili per uno stesso numero, gli indici
vanno semplificati.
Per esempio da un elemento X con numero di ossidazione +4 e un elemento Y con
numero di ossidazione -2, avremo il seguente composto binario:
A questa regola fanno eccezione alcuni composti, come ad esempio l'acqua ossigenata
(perossido di idrogeno, appartenente alla famiglia dei perossidi), H2O2, in cui gli indici non
vanno semplificati.
Numeri di ossidazione
1) Gli atomi allo stato elementare, come K, N2, Fe, hanno numeri di ossidazione zero.
2) Uno ione monoatomico ha un numero di ossidazione uguale alla carica dello ione. Per
esempio Cu2+ ha numero di ossidazione +2 mentre Cl- ha numero di ossidazione -1
3) L'idrogeno ha solitamente numero di ossidazione + 1
4) L'ossigeno ha numero di ossidazione -2 in tutti i composti.
6) La somma algebrica dei numeri di ossidazione di tutti gli atomi di un composto neutro è
uguale a zero.
7) La somma algebrica dei numeri di ossidazione di tutti gli atomi in uno ione poliatomico è
uguale alla carica dello ione.
Esempi:
1) Determinare il numero di ossidazione di P in H3PO4
In base alla regola numero 3 l’idrogeno ha numero di ossidazione +1
In base alla regola numero 4 l’ossigeno ha numero di ossidazione -2
In base alla regola numero 6 la somma algebrica dei numeri di ossidazione di tutti gli atomi
del composto è uguale a zero. Indicando con X il numero di ossidazione di P si ha quindi:
3 ·(+1) + X + 4 · (-2) = 0 da cui X = +5
2) Determinare il numero di ossidazione di Mn nello ione MnO4 1Lo ione a n.o. pari -1.
In base alla regola numero 4 l’ossigeno ha numero di ossidazione -2
In base alla regola numero 7 la somma algebrica dei numeri di ossidazione di tutti gli atomi
nello ione poliatomico è uguale a -1
Indicando con X il numero di ossidazione di Mn si ha quindi:
X + 4 · (-2) = -1 da cui X = +7
3) Determinare il numero di ossidazione di Cr in Cr2O72In base alla regola numero 4 l’ossigeno ha numero di ossidazione -2
In base alla regola numero 7 la somma algebrica dei numeri di ossidazione di tutti gli atomi
nello ione poliatomico è uguale a -2
Indicando con X il numero di ossidazione di Cr si ha quindi:
2 · X + 7 · (-2) = -2 da cui X = +6
OSSIDI E ANIDRIDI
Nomenclatura di ossidi (ossidi basici)
Un ossido basico è un composto binario costituito da ossigeno (con numero di
ossidazione -2) e da un metallo.
La reazione di formazione di un ossido può essere pertanto così rappresentata:
Metallo + Ossigeno → Ossido
Applicando la "Regola dell'incrocio" risulta che la formula generale di un ossido è Me2On in
cui:
Me = simbolo chimico del metallo;
n = valenza del metallo.
La nomenclatura tradizionale prevede:
Se il metallo ha un solo numero di ossidazione il composto si chiamerà “Ossido di” seguito
dal nome del metallo.
Se il metallo presenta due numeri di ossidazione forma con l'ossigeno due ossidi diversi.
Nell'ossido a numero di ossidazione maggiore il metallo prende il suffisso -ico, in quello a
numero di ossidazione minore prende il suffisso -oso.
La nomenclatura IUPAC prevede:
la denominazione “ossido di” seguita dal nome del metallo, utilizzando anche opportuni
prefissi che precedono sia il termine “ossido” sia il nome del metallo. I prefissi dei nomi
IUPAC corrispondono ai numeri che compaiono nelle formule (2 = di; 3 = tri; 4 = tetra; 5 =
penta; 6 = esa; etc.).
Nomenclatura di anidridi (ossidi acidi)
Una ossido acido è un composto binario costituito da ossigeno (con numero di ossidazione
-2) e da un non-metallo.
Non metallo + O2 → ossido acido
Applicando la "Regola dell'incrocio" risulta che la formula generale di un ossido acido è
nMe2On in cui:
nMe = simbolo chimico del non-metallo;
n = valenza del non-metallo.
La nomenclatura tradizionale prevede:
Se il non metallo presenta un unico numero di ossidazione il composto si chiamerà
“Anidride” seguito dal nome del non metallo con desinenza -ica.
Se il non metallo presenta due numeri di ossidazione può formare con l'ossigeno due
anidridi diverse. Nel composto a numero di ossidazione maggiore il non metallo prende il
suffisso -ica, in quello a numero di ossidazione minore prende il suffisso -osa.
Se il non metallo presenta quattro numeri di ossidazione può formare con l'ossigeno
quattro anidridi diverse. Nel composto a valenza maggiore il non metallo prende il
prefisso per- e il suffisso –ica. Nel composto a valenza minore il non-metallo prende il
prefisso ipo- e il suffisso -osa. Nei composti a numero di valenza intermedi, per il non-
metallo si avranno il suffisso –ica (per il numero di ossidazione più elevato dei due) ed
-osa (per
il
numero
di
ossidazione
meno
elevato
dei
due).
l'unico non-metallo ad avere quattro numeri di ossidazione è il cloro: in caso di 3 numeri di
valenza non si considera la desinenza minore –osa (vedi caso dello Iodio)
La nomenclatura IUPAC prevede:
la denominazione “ossido di” seguita dal nome del non metallo, con l’utilizzo di opportuni
prefissi che precedono sia il termine “ossido” sia il nome del non metallo. I prefissi dei nomi
IUPAC corrispondono ai numeri che compaiono nelle formule (2 = di; 3 = tri; 4 = tetra; 5 =
penta; 6 = esa; etc.).
Come si ricava la formurla dal nome tradizionale?
Anidride clorica
1. Si legge il nome e di ricavano i suffissi: -ica
2. Si leggono nella tavola periodica le valenza dell’elemento interessato: 1, 3, 5 e 7
(l’ossigeno è sempre 2).
3. in base ai suffissi e prefissi si sceglie la valenza opportuna: 5
4. Si applica l’incrocio semplificando se necessario: Cl5 O2 → Cl2O5
IDRURI E IDRACIDI
Idruri sono i composti binari contenenti idrogeno a eccezione dei composti tra idrogeno e
gli elementi del VI o del VII gruppo, che prendono il nome di idracidi, perchè manifestano
carattere acido.
Nomenclatura di idruri
In questi composti, l'idrogeno può assumere numero di ossidazione -1 o +1 a seconda
dell'elemento a cui è legato. In paticolare quando è legato con elementi
aventielettronegatività maggiore, assume numero di ossidazione +1, mentre quando è
legato ad atomi meno elettronegativi, assume numero di ossidazione -1.
Applicando la "Regola dell'incrocio" risulta che la formula generale di un idruro è XHn in
cui:
X = simbolo chimico dell'elemento legato all'idrogeno;
n = valenza dell'elemento X.
La nomenclatura tradizionale prevede:
la denominazione "idruro di" seguito dal nome dell’elemento X.
La nomenclatura IUPAC prevede:
la denominazione “idruro di” seguita dal nome dell'elemento X, utilizzando anche opportuni
prefissi che precedono il termine “idruro”. I prefissi dei nomi IUPAC corrispondono ai
numeri che compaiono nelle formule (2 = di; 3 = tri; 4 = tetra; 5 = penta; 6 = esa; etc.).
Nomenclatura di idracidi
Gli idracidi sono i composti che l'idrogeno, sempre con numero di ossidazione +1, forma
con elementi del VI o el VII gruppo. L'idrogeno essendo il meno elettronegativo dei due
elementi nella formula va scritto per primo.
Applicando la "Regola dell'incrocio" risulta che la formula generale di un idracido è HnX in
cui:
X = simbolo chimico dell'elemento del VI o del VII gruppo;
n = valenza dell'elemento X.
La nomenclatura tradizionale prevede:
il termine "acido" seguito dal nome del non metallo terminante con il suffisso -idrico.
La nomenclatura IUPAC prevede:
l'utilizzo del suffisso –uro per l'elemento del VI o VII gruppo, seguito dalla termine “di
idrogeno” (eventualmente con gli opportuni prefissi moltiplicativi).
Altri idracidi sono:
IDROSSIDI
Gli idrossidi si formano sommando una o più molecole d'acqua ad un'ossido:
Ossido + nH2O → Idrossido
e hanno formula generale Me(OH)n in cui:
Me = simbolo chimico del metallo
n = valenza del metallo.
In altre parole per la formula chimica di qualsiasi idrossido si ottiene scrivendo il simbolo
del metallo Me e, di seguito, un numero di gruppi OH pari al numero di ossidazione del
metallo. Per esempio, dato l'alluminio Al avente numero di ossidazione 3+, la formula del
suo idrossido è: Al(OH)3.
Negli idrossidi è presente il gruppo OH-, che viene chiamato ossidrile e che si può pensare
originato da una molecola di acqua in seguito a perdita di uno ione H+.
Negli idrossidi la carica dello ione OH- viene annullata dalla carica del metallo.
La nomenclatura tradizionale degli idrossidi prevede:
Se il metallo ha un solo un numero di ossidazione il composto si chiamerà “idrossido di”
seguito dal nome del metallo.
Se il metallo presenta due numeri di ossidazione può formare due idrossidi diversi.
Nell'idrossido a numero di ossidazione maggiore il metallo prenderà il suffisso -ico, in
quello a numero di ossidazione minore prenderà il suffisso -oso.
La nomenclatura IUPAC prevede:
la denominazione “idrossido di” seguita dal nome del metallo, utilizzando anche opportuni
prefissi che precedono il termine “idrossido”.
I prefissi dei nomi IUPAC corrispondono ai numeri che compaiono nelle formule (2 = di; 3 =
tri; 4 = tetra; 5 = penta; 6 = esa; etc.).
ACIDI TERNARI
Gli ossiacidi sono composti ternari costituiti da idrogeno, ossigeno e non metallo.
Se X è il simbolo del non metallo, la formula generale di un ossiacido è:
HaXbOc
in cui gli indici a, b, c sono numeri interi primi tra loro, cioè che non hanno alcun divisore
comune. Gli ossiacidi si formano sommando una o più molecole d'acqua ad un'anidride:
Anidride + nH2O → Ossiacido
Per trovare la formula chimica di un ossiacido si scrivono i due reagenti (anidride + H2O) a
sinistra della freccia e a destra della freccia i simboli chimici senza alcun indice della
formula vista in precedenza: HaXbOc
Si contano gli atomi di ciascun elemento presenti nei reagenti, determinando in tal modo i
valori degli indici (a, b, c), che si attribuiscono ai rispettivi simboli chimici.
Per esempio, volendo scrivere la formula dell'ossiacido che si ottiene da anidride solforica
SO3 e acqua inizialmente scriveremo :
SO3 + H2O → HSO
Ora bisogna contare gli atomi di ciascun elemento presenti nei reagenti, determinando in
tal modo i valorori degli indici (a, b, c), che si attribuiscono ai rispettivi simboli chimici nella
formula HaXbOc:
in questo caso risulta:
a = 2 (a sinistra della freccia ci sono in totale 2 atomi di idrogeno)
b = 1 (a sinistra della freccia è infatti presente un solo atomo di zolfo)
c = 4 (a sinistra della freccia sono infatti presente quattro atomi di ossigeno: 3 in SO 3 e uno
in H2O)
quindi risulta che la formula chimica dell'acido corrispondente è H2SO4. La reazione
completa risulta essere:
SO3 + H2O → H2SO4
Volendo invece scrivere la formula chimica dell'acido che si ottiene da anidride nitrica
N2O5 e acqua, scriveremo:
N2O5 + H2O → H2N2O6
i valori degli indici non sono numeri primi tra loro, ma sono tutti divisibili per due; quindi si
ha che:
N2O5 + H2O → 2HNO3
da una molecola di anidride nitrica e una di acqua si ottengono due molecole di HNO 3.
La nomenclatura tradizionale degli acidi ternari prevede:
il nome degli acidi si ottiene da quello dell'anidride corrispondente, sostituendo il termine
"acido" al termine "anidride".
La nomenclatura IUPAC prevede:
per tutti gli acidi la desinenza –ico ed opportuni prefissi moltiplicativi per indicare il numero
di atomi di ossigeno (osso) e del non metallo. Bisogna inoltre far seguire al nome del non
metallo il suo stato di ossidazione in numero romano racchiuso tra parentesi tonde. Il
numero romano va letto come numero cardinale.
acido numero atomi di ossigeno + osso + numero atomi non-metallo + radice + -ico +
(numero di ossidazione del non-metallo)
Come si ricava la formurla dal nome tradizionale?
Acido perclorico
1. Da cosa deriva? Anidride perclorica
2. Si legge il nome e di ricavano i suffissi: per- e -ica
3. Si leggono nella tavola periodica le valenza dell’elemento interessato: 1, 3, 5 e 7
(l’ossigeno è sempre 2).
4. in base ai suffissi e prefissi si sceglie la valenza opportuna: 7
5. si scrive l’anidride applicando la regola dell’incrocio: Cl7 O2 → Cl2O7
6. Si aggiunge anidride all’acqua: Cl2O5 + H2O → H2Cl2O6 → HClO3
SALI BINARI
I sali binari sono composti costituiti da un metallo e da un non-metallo. In essi, il metallo,
avendo una elettronegatività minore, ha numero di ossidazione positivo e nella formula
chimica del composto, il suo simbolo precede quello del non-metallo.
Per i non metalli si deve prendere in considerazione SOLO il numero di ossidazione
negativo (perciò si considera solo un numero di valenza per ogni non metallo). Es: per il
cloro si considera solo il n.o. -1 cioè valenza 1
Applicando la "Regola dell'incrocio" risulta che la formula generale di un sale binario è
MexnMey in cui:
Me = simbolo chimico del metallo;
nMe = simbolo chimico del non-metallo;
x = valenza del non-metallo;
y = valenza del metallo.
Sono binari anche i sali dello ione ammonio NH4+ che è considerato come un metallo con
numero di ossidazione +1.
La nomenclatura tradizionale dei sali binari prevede:
Se il metallo presenta un unico numero di ossidazione il composto prenderà il nome dal
non-metallo terminante in uro seguito dal nome del metallo.
(radice del non metallo)-uro di (nome del metallo)
Se il metallo presenta due numeri di ossidazione si possono ottenere due sali binari
diversi.
Nel composto a numero di ossidazione maggiore il metallo prenderà il suffisso -ico, in
quello a numero di ossidazione minore prenderà il suffisso -oso.
(radice del non metallo)-uro (nome del metallo)-ico
(radice del non metallo)-uro (nome del metallo)-oso
La nomenclatura IUPAC dei sali binari prevede:
che il composto prenda il nome dal non-metallo terminante in uro seguito dal nome del
metallo, con l’utilizzo di opportuni prefissi che precedono entrambi i termini. I prefissi dei
nomi IUPAC corrispondono ai numeri che compaiono nelle formule (2 = di; 3 = tri; 4 = tetra;
5 = penta; 6 = esa; etc.).
Come si ricava la formurla dal nome tradizionale?
Solfuro ferroso
1. Si legge il nome e di ricavano i suffissi: -oso
2. Si leggono nella tavola periodica le valenza dell’elemento interessato: Fe (2 e 3) S
(2)
3. in base ai suffissi e prefissi si sceglie la valenza opportuna: 2 (oso indica il minore)
4. si scrive il sale applicando l’incrocio: Fe2 S2 → Fe2S2 → FeS
SALI TERNARI
Formazione di sali ternari
Quando un acido perde uno o più ioni H+ forma anioni definiti come "residui dell'acido".
L'acido nitrico HNO3 perdendo uno ione H+, si trasforma in un anione di formula NO3- che è
il residuo dell'acido nitrico HNO3.
HNO3 → H+ + NO3Per l'acido solforico H2SO4 si può avere la formazione di due anioni diversi:
H2SO4 → H+ + HSO4H2SO4 → 2H+ + SO42Per l'acido fosforico H3PO4 si può avere invece la formazione di tre anioni diversi:
H3PO4 → H+ + H2PO4H3PO4 → 2H+ + HPO42H3PO4 → 3H+ + PO43La nomenclatura tradizionale dei residui degli acidi ternari prevede:
i nomi dei residui degli acidi si formano da quelli degli acidi corrispondenti cambiando le
desinenze secondo lo schema seguente:
oso → ito
ico → ato
Inoltre se i residui derivano da acidi che contengono due atomi di idrogeno e soltanto uno
dei due viene perso, si usano gli stessi suffissi, mettendo però la parola acido dopo il nome
del residuo dell'acido.
Nel linguaggio comune non si usa la parola acido, ma si aggiunge il prefisso bi- al nome
del residuo.
Per esempio l'acido carbonico può formare due anioni diversi:
H2CO3 → H+ + HCO3H2CO3 → 2H+ + CO32HCO3- è lo ione bicarbonato (o ione carbonato acido)
CO32- è lo ione carbonato
Se invece i residui derivano da acidi che contengono tre o quattro atomi di idrogeno, si
usano gli stessi suffissi ma si aggiunge il termina monoacido se al residuo è rimasto un
solo atomo di idrogeno; biacido se al residuo sono rimasti due atomi di idrogeno
e triacido se ne sono rimasti tre.
Per esempio l'acido fosforoso H3PO3 può formare tre anioni diversi:
H3PO3 → H+ + H2PO3H3PO3 → 2H+ + HPO32H3PO3 → 3H+ + PO33H2PO3- è lo ione fosfito biacido
HPO32- è lo ione fosfito monoacido
PO33- è lo ione fosfito
La nomenclatura IUPAC dei residui degli acidi ternari prevede:
la desinenza –ato ed opportuni prefissi moltiplicativi per indicare il numero di atomi di
ossigeno (osso) e di eventuali altri gruppi. Bisogna inoltre far seguire al nome del residuo
lo stato di ossidazione in numero romano del non metallo racchiuso tra parentesi tonde. Il
numero romano va letto come numero cardinale.
* Nei residui acidi (cioè contenenti uno o più atomi di idrogeno), il numero degli atomi di
ossigeno viene sempre tralasciato.
Nomenclatura di sali ternari
I sali ternari si ottengono dall'unione tra un residuo di un acido e uno ione metallico. Nella
formula chimica del sale ternario, il simbolo chimico del metallo precede quello del residuo
dell'acido.
Applicando la "Regola dell'incrocio" risulta che la formula generale di un sale ternario è
MexRey in cui:
Me = simbolo chimico dello ione metallo;
y = valenza dello ione metallico;
Re = residuo dell'acido;
x= numero di ossidazione del residuo dell'acido.
In entrambe le nomenclature, tradizionale IUPAC, il nome del sale viene costruito
utilizzando il nome dell'anione (residuo dell'acido) e facendo riferimento al metallo.
(nome dell'anione) di (nome del metallo)
Come si ricava la formurla dal nome tradizionale?
Fosfato ferroso.
1. Si legge il metallo e si individua su ha più di una valenza: è un ferro –oso quindi ferra
con valenza minore 2
2. Si trova la radice del residuo acido: -ato
3. Da che acido deriva? Acido fosforico
4. Scrivere l’acido fosforico. H3PO4 (vedi esempi in acidi ternari)
5. Il nome del sale presenta il prefisso –bi o compare il termine monoacido o biacido?
NO quindi perder tutti e tre gli idrogeni H3PO3 → 3H+ + PO336. Scrivere il residuo acido: PO4-3
7. Trovare la valenza del residuo acido: n.o -3 quindi valenza 3
8. Scrivere il sale : Fe2 (PO4) 3 → Fe3(PO4)2
Come si ricava la formurla dal nome tradizionale?
Bicarbonato di sodio o Carbonato monoacido di sodio
1.
2.
3.
4.
5.
Si legge il metallo e si individua su ha più di una valenza: NO solo 1
Si trova la radice del residuo acido: -ato
Da che acido deriva? Acido carbinico
Scrivere l’acido fosforico. H2CO3 (vedi esempi in acidi ternari)
Il nome del sale presenta il prefisso –bi o compare il termine monoacido o biacido?
SI il monoacido indica che gli rimane un idrogeno al residuo H2CO3 → H+ + HCO36. Scrivere il residuo acido: HCO37. Trovare la valenza del residuo acido: n.o -1 quindi valenza 1
8. Scrivere il sale : Na1 (HCO3) 1 → Na(HCO3)
Data la formula come si ricava il nome?
1. Riconosce il tipo di composto
2. Trovare il numero di ossidazione del metallo e del non metallo ad esclusione
dell’idrogeno e dell’ossigeno.
3. Confrontare i numeri di ossidazione trovati con quelli della tavola periodica. Se sono
più di uno ricavare le desinenze appropriate.
H3PO4
1.
2.
3.
4.
5.
6.
7.
È un acido ternario
Il numero di ossidazione del Fosforo è: +5
Leggo i numeri di ossidazione: -3, 3 e 5
Le possibili valenze sono: 3 e 5
Confronto: il composto ha la valenza maggiore
Visto che è un acido ternario prenderà il suffisso –ico
Nome: Acido fosforico