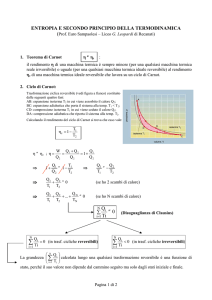
Derivazione della disuguaglianza di Clausius
Consideriamo una generica trasformazione chimico-fisica che porta un sistema chiuso dallo stato 1
allo stato 2:
La variazione di energia interna è ΔU=U2-U1
Poiché l’energia interna è una funzione di stato tale variazione è la stessa, sia che si raggiunga lo
stato 2 reversibilmente, sia che lo si raggiunga irreversibilmente. Pertanto, per il primo principio
applicato ai sistemi chiusi:
Di conseguenza:
∆ =
+
−
=
=
+
−
E’ noto che quantitativamente il lavoro fatto reversibilmente da un sistema è sempre maggiore di
quello fatto irreversibilmente. Tuttavia per convenzione il lavoro fatto dal sistema ha segno
negativo. Quindi vale la relazione:
Se si considera il lavoro fatto dall’ambiente sul sistema (di segno positivo) vale la stessa
disequazione, in quanto l’ambiente compie un lavoro maggiore sul sistema se la trasformazione
procede irreversibilmente (la forza applicata non cresce gradatamente adattandosi alla risposta
del sistema, ma assume da subito valore nettamente superiore alla forza reattiva del sistema).
Ne consegue che:
−
>0
,
−
E in generale:
≥
Infine:
∆ ≥
,
≥
>0
Tale disuguaglianza è nota come disuguaglianza di Clausius e mostra che la variazione di entropia è
sempre maggiore del calore scambiato a temperatura costante a meno che non si tratti di una
trasformazione reversibile. In tal caso vale l’uguaglianza.
Applicando la disuguaglianza ad un sistema isolato si ottiene:
∆ ≥0
Quindi l’entropia di un sistema isolato non può mai diminuire. Essa rimane costante in presenza di
trasformazioni reversibili e cresce ogni volta che ha luogo una trasformazione irreversibile.
Poiché le trasformazioni reversibili sono un’idealizzazione, si può affermare che nell’universo
(sistema isolato per definizione) l‘entropia è in continua crescita (II principio della termodinamica).