AMMINOACIDI
E
PROTEINE
1
AMMINOACIDI
Gli amminoacidi sono composti organici composti da atomi di
carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da
altri elementi come lo zolfo.
Gli
amminoacidi
sono
le
unità
strutturali
di
cui
sono
composte le proteine.
Nelle proteine sono stati identificati 20 amminoacidi che
rappresentano gli amminoacidi base.
2
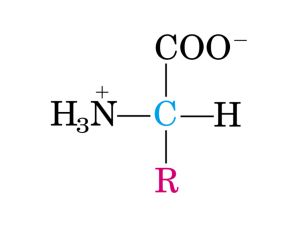
STRUTTURA degli amminoacidi
Gruppo carbossilico
Gruppo amminico
H2N
COOH
C
R
H
• Sono
caratterizzati
dalla
presenza di due gruppi funzionali
diversi, un gruppo amminico –NH2
e un gruppo carbossilico –COOH e
un radicale indicato con R che è
detto catena laterale e che li
differenzia.
Catena laterale
• Gli amminoacidi presenti nelle proteine sono α-amminoacidi poiché
il gruppo amminico è legato al carbonio subito adiacente al carbonio
carbossilico.
3
SERIE D ed L degli amminoacidi
• Tutti gli amminoacidi (eccetto al glicina in cui R = H) hanno almeno un
atomo di C chirale.
COOH
H2N
C
H
COOH
H
CH3
L-Alanina
C
NH2
CH3
D-Alanina
Esistono quindi due stereoisomeri nominati D e L
Il gruppo –NH2 è a destra
Il gruppo –NH2 è a sinistra
4
5
Tratto da: D.L. Nelson, M.M. Cox, I PRINCIPI DI BICHIMICA DI LEHNINGER 4E, Ed. Zanichellli
PROPRIETA’ ACIDO-BASE degli amminoacidi
• Gli amminoacidi sono composti anfoteri quindi la loro carica dipende dal pH
della soluzione in cui essi sono presenti.
• La carica complessiva dell’amminoacido può essere positiva, negativa o
neutra e dipende anche dalla natura della catena laterale.
• Per ciascun amminoacido esiste un valore di pH per cui la molecola è neutra,
tale valore è detto PUNTO ISOLELETTRICO.
pH crescente
H3N+
C
CH3
H
COO-
COO-
COOH
- H+
H3N+
C
CH3
- H+
H
H2N
C
H
CH3
pH = pI
6
STRUTTURA dei 20 amminoacidi
• I 20 amminoacidi naturali si distinguono
caratteristiche della catena laterale R:
•
•
•
•
•
gruppi
gruppi
gruppi
gruppi
gruppi
in
base
alle
alifatici (non polari)
aromatici
polari (non carichi)
basici
acidi
• Ogni amminoacido viene indicato con una lettera.
• Esistono amminoacidi diversi che derivano da modificazioni
chimiche di alcuni dei 20 amminoacidi.
7
STRUTTURA dei 20 amminoacidi
8
Tratto da: D.L. Nelson, M.M. Cox, I PRINCIPI DI BICHIMICA DI LEHNINGER 4E, Ed. Zanichellli
LEGAME PEPTIDICO
• Gli amminoacidi si legano tra loro con un legame tra il gruppo carbossilico
di un amminoacido e il gruppo amminico dell’altro amminoacido.
H
H2N
H
O
H2N
+
C
C
C
OH
O
C
OH
R1
R2
- H2O
H2N
legame peptidico
H
O
C
C
H
N
C
O
C
OH
R1
H
R2
9
LEGAME PEPTIDICO
Catena polipeptidica
10
Tratto da: D.L. Nelson, M.M. Cox, I PRINCIPI DI BICHIMICA DI LEHNINGER 4E, Ed. Zanichellli
CARATTERISTICHE del legame peptidico
• Ha caratteristiche rigide e
planari e quindi i gruppi non
possono ruotare intorno ad esso.
11
Tratto da: D.L. Nelson, M.M. Cox, I PRINCIPI DI BICHIMICA DI LEHNINGER 4E, Ed. Zanichellli
PROTEINE E PEPTIDI
• I peptidi e le proteine sono polimeri di
amminoacidi legati tra loro da legame peptidico.
Tratto da: D. Voet, J.G. Voet, C.W. Pratt, FONDAMENTI DI BIOCHIMICA 2E, Ed. Zanichellli
12
FUNZIONI delle proteine
• La parola proteina deriva dal greco proteios che significa “di primaria
importanza”. Le proteine sono i più importanti composti nell’organismo.
• La funzione delle proteine si svolge:
nella regolazione dei processi
metabolici
ormoni
nella catalisi di reazioni biochimiche
enzimi
nel trasporto di ossigeno
emoglobina
nella difesa dell’organismo contro le
infezioni
anticorpi
nella trasmissione di impulsi
nervi
nell’attività muscolare
contrazione
13
Tratto da: G.I. Sackheim, D.D. Lehman, Chimica per le scienze biomediche, EdiSES
STRUTTURA delle proteine
• STRUTTURA PRIMARIA ⇒ rappresenta il numero e la
sequenza di amminoacidi presenti nella proteina.
• STRUTTURA SECONDARIA ⇒ rappresenta il ripiegamento
regolare e ripetitivo che assumono tratti della catena
polipeptidica.
• STRUTTURA TERZIARIA ⇒ rappresenta la conformazione
tridimensionale complessiva assunta dalla catena polipeptidica.
• STRUTTURA QUATERNARIA ⇒ è presente solo in quelle
proteine che presentano più catene polipeptidiche (es.
Emoglobina) e rappresenta il modo in cui interagiscono le
diverse subunità.
14
STRUTTURA PRIMARIA delle proteine
E’ data dalla successione degli
amminoacidi che costituiscono la
proteina
• La struttura primaria di una proteina determina la sua struttura
terziaria e quindi anche la sua funzione biologica.
15
STRUTTURA SECONDARIA delle proteine
Ripiegamento che assumono tratti di catena polipeptidica
•Tale ripiegamento dipende dalle catene laterali degli amminoacidi e dalle
loro interazioni.
I due tipi principali di struttura secondaria sono:
• l’alfa (α)-elica
• struttura a foglietto beta (β)
16
STRUTTURA SECONDARIA delle proteine
α-elica
Ripiegamento
elicoidale
(spirale) dello scheletro
peptidico della proteina
che viene stabilizzato da
legami idrogeno tra il
gruppo –NH- di un legame
pepidico e il gruppo C=O
del
legame
peptidico
presente quattro residui
più avanti nella catena.
Struttura flessibile ed
elastica (es. proteine
della lana e dei capelli)
Tratto da: P. Champe, R. Harvey, D.R. Ferrier, LE BASI DELLA
BIOCHIMICA, Ed. Zanichellli
Tratto da: D.L. Nelson, M.M. Cox, I PRINCIPI DI
BICHIMICA DI LEHNINGER 4E, Ed. Zanichellli
17
STRUTTURA SECONDARIA delle proteine
foglietto β
Il foglietto beta è costituito da una serie di
filamenti beta adiacenti. In ogni filamento
beta i gruppi R degli amminoacidi sono
proiettati perpendicolarmente al piano del
legame
peptidico
con
direzione
alternativamente opposta. Più filamenti beta
originati dal ripiegamento di tratti diversa
della tessa catena della proteina o catene
diverse si associano uno accanto all’altro
Struttura flessibile ma non
elastica (es. proteine della seta)
Tratto da: D. Voet, J.G. Voet, C.W. Pratt, FONDAMENTI DI
BIOCHIMICA 2E, Ed. Zanichellli
18
STRUTTURA SECONDARIA delle proteine
foglietto β
19
Tratto da: P. Champe, R. Harvey, D.R. Ferrier, LE BASI DELLA BIOCHIMICA, Ed. Zanichellli
STRUTTURA TERZIARIA delle proteine
Arrangiamento spaziale complessivo degli amminoacidi di una singola
catena polipeptidica a formare la sua struttura tridimensionale.
20
Tratto da: D. Voet, J.G. Voet, C.W. Pratt, FONDAMENTI DI BIOCHIMICA 2E, Ed. Zanichellli
STRUTTURA TERZIARIA delle proteine
Le strutture terziare sono stabilizzate da molti tipi di legame
Tratto da: P. Champe, R. Harvey, D.R. Ferrier, LE BASI DELLA BIOCHIMICA, Ed. Zanichellli
21
STRUTTURA QUATERNARIA delle proteine
La struttura quaternaria si ha quando la proteina è composta da più catene
polipeptidiche ed è rappresentata delle interazioni non covalenti che
esistono tra le diverse subunità a formare il complesso della proteina.
22
Tratto da: D. Voet, J.G. Voet, C.W. Pratt, FONDAMENTI DI BIOCHIMICA 2E, Ed. Zanichellli
23
Tipi di proteine:
• proteine insolubili in ambiente acquoso ⇒ fibrose
(es. collagene)
• proteine solubili in ambiente acquoso ⇒ globulari
(es. emoglobina)
24