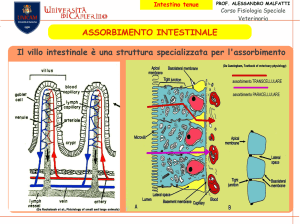
Eq. acido-base
PROF. ALESSANDRO MALFATTI
Corso di Fisiologia Speciale
Veterinaria
L'EQUILIBRIO ACIDO-BASE
➔ La concentrazione nell'organismo degli ioni H+ è finemente regolata
perché quasi tutte le attività enzimatiche sono influenzate
sostanzialmente dalle variazioni di pH. Quindi l'attività cellulare –
e di conseguenza dell'intero organismo – può subire modificazioni
➔ Questo anche se gli ioni H+ sono scarsi (circa 3,5 milioni di volte
meno degli ioni Na+: 40 nEq/L vs 142 mEq/L) e se la variabilità
della loro concentrazione è un milionesimo di quella del sodio
➔ Il pH normale del sangue (arterioso) è circa 7,4 (ossia 40 nEq/L di
H+),
✔ (quello venoso 7,35, quello cellulare tra 6,0 e 7,4)
➔ La normale variabilità del pH ematico arterioso è tra 7,3 e 7,5
(50-32 nEq/L di H+)
➔ I limiti del pH ematico (arterioso) per la sopravvivenza sono
indicativamente tra 6,8 e 8,0 (10 e 160 nEq/L)
Eq. acido-base
PROF. ALESSANDRO MALFATTI
Corso di Fisiologia Speciale
Veterinaria
L'EQUILIBRIO ACIDO-BASE
➔ ACIDO: molecola che in soluzione rilascia ioni idrogeno (H+)
✔ [HCl: H+ e Cl-] - [H2CO3: H+ e HCO3-]
➔ ALCALE: molecola che in soluzione rilascia ioni ossidrile (OH-)
✔ [NH3 (+H2O): NH4+ e OH-] - [NaOH: Na+ e OH-]
➔ BASE: una molecola (o uno ione) capace di accettare ioni H+
✔ [HCO3-] - [OH-]
➢perciò “base” è un concetto più largo di “alcale”
➔ ACIDOSI: eccesso apporto o scarsa eliminazione di idrogenioni
✔ L'organismo animale tende costantemente all'acidosi: il
metabolismo produce CO2 (quindi HCO3-), oltre ad acidi
organici vari (lattico)
➔ ALCALOSI: eccesso di eliminazione di idrogenioni
✔ L'alcalosi si verifica come risultato di processi patologici
Eq. acido-base
L'EQUILIBRIO ACIDO-BASE
PROF. ALESSANDRO MALFATTI
Corso di Fisiologia Speciale
Veterinaria
Eq. acido-base
PROF. ALESSANDRO MALFATTI
Corso di Fisiologia Speciale
Veterinaria
L'EQUAZIONE DI HENDERSON-HASSELBALCH
HA ↔ H+ + A➔ Esprime il rapporto esistente in un ambiente acquoso (biologico)
tra una sostanza e le sue componenti dissociate, che si risolve
in una costante (k) di dissociazione
✔ Se si aggiunge un acido più forte di HA da esso si liberano
ioni H+ che spingono l'equilibrio a sinistra (si forma più HA)
✔ Se si aggiunge una base gli OH- reagiscono con gli ioni H+ e
l'equilibrio si sposta verso destra (si dissociano più HA)
➔ In relazione al pH il valore della k (pK) esprime il valore a cui
nella soluzione le concentrazioni dei due prodotti dissociati
costituiscono ognuna il 50% del dissociato
➔ Quanto più il pK di una sostanza è vicino al pH che deve
essere regolato tanto più questa è efficiente come tampone
Eq. acido-base
PROF. ALESSANDRO MALFATTI
Corso di Fisiologia Speciale
Veterinaria
I SISTEMI TAMPONE NELL'ORGANISMO
➔ BICARBONATO-ACIDO CARBONICO - pK = 6,1
✔ HCO3- + H+ ↔ H2CO3 ↔ CO2 + H2O
➔ FOSFATI - pK = 6,8
✔ H2PO4- ↔ HPO4-- + H+
➔ EMOGLOBINA
✔ HHb ↔ Hb- + H+ - la parte reattiva dell'Hb sono i gruppi
imidazolici dei residui di istidina, che sono ben 38 per ogni
molecola di Hb
➔ PROTEINE alle due estremità:
✔ R-COOH ↔ R-COO- + H+
✔ R-NH3+ ↔ R-NH2- + H+
Eq. acido-base
PROF. ALESSANDRO MALFATTI
Corso di Fisiologia Speciale
Veterinaria
DOVE AGISCONO I SISTEMI TAMPONE
Eq. acido-base
IL SISTEMA DEL BICARBONATO
PROF. ALESSANDRO MALFATTI
Corso di Fisiologia Speciale
Veterinaria
BICARBONATO-ACIDO CARBONICO - pK = 6,1
HCO3- + H+ ↔ H2CO3 ↔ CO2 + H2O
➔ Benché il pK di questo sistema sia 6,1 (lontano dal pH ematico
di 7,4) è il sistema tampone più efficiente per il sangue e per
tutti i compartimenti extracellulari perché:
✔ La pCO2 è rapidamente controllata dall'attività respiratoria
✔ La [HCO3-] è controllata (più lentamente) dall'attività
renale
✔ La reazione H2CO3 ↔ CO2 + H2O può essere catalizzata
dall'anidrasi carbonica che è presente:
➢Negli eritrociti → tamponamento ematico diretto
➢Nei tubuli renali → tamponamento metabolco
➢Nella mucosa gastrica → tamponamento HCl
Eq. acido-base
IL SISTEMA DEL BICARBONATO
PROF. ALESSANDRO MALFATTI
Corso di Fisiologia Speciale
Veterinaria
Eq. acido-base
PROF. ALESSANDRO MALFATTI
Corso di Fisiologia Speciale
Veterinaria
IL SISTEMA DEL BICARBONATO
BICARBONATO-ACIDO CARBONICO - pK = 6,1
HCO3- + H+ ↔ H2CO3 ↔ CO2 + H2O
➔ Se si aggiungono ioni H+ al sangue (es. ac. Lattico, più forte
dell'ac. Carbonico)
➔ Il RENE inizia a espellere ioni H+ scambiandoli con Na+ riportando
l'andamento della reazione verso sinistra e mantenendo il rapporto
HCO3- / H2CO3
Eq. acido-base
IL SISTEMA DEL BICARBONATO
PROF. ALESSANDRO MALFATTI
Corso di Fisiologia Speciale
Veterinaria
BICARBONATO-ACIDO CARBONICO - pK = 6,1
HCO3- + H+ ↔ H2CO3 ↔ CO2 + H2O
➔ Nel sangue il rapporto HCO3- / H2CO3 è di circa 20
✔ 24 mmoli/L di HCO3- per 1,2 mmoli/L di H2CO3
✔ Se si considera il logaritmo di questo rapporto:
➢pH= pK (6,1) + log (24/1.2) = 6,1 + 1,3 = 7,4
➔ L'attività respiratoria elimina CO2 e mantiene il rapporto ematico
HCO3- / H2CO3
➔ Inoltre il RENE inizia a espellere ioni H+ scambiandoli con Na+
riportando l'andamento della reazione verso sinistra:
✔ Riassorbimento dei bicarbonati (passivo)
✔ Sintesi di bicarbonati (a partire dallo scambio con H+ escreti)
Eq. acido-base
IL SISTEMA DEL BICARBONATO
PROF. ALESSANDRO MALFATTI
Corso di Fisiologia Speciale
Veterinaria
RIASSORBIMENTO DEI BICARBONATI
➔ Avviene per l'80-90% nel TCP, completato nel DC
✔ Sono attive due anidrasi carboniche
➢Sull'orletto a spazzola
➢Nella cellula tubulare
Eq. acido-base
PROF. ALESSANDRO MALFATTI
Corso di Fisiologia Speciale
Veterinaria
IL SISTEMA DEL BICARBONATO
AUMENTO DEI BICARBONATI
➔ Nel TCD
➔ Completato il “riassorbimento” di HCO3- il rene recupera altre
molecole di acido carbonico dalla CO2 e H2O scambiando sempre ioni
Na+ con H+ (escrezione di acido) e aggiungendo questi ultimi ad altri
sistemi tampone:
✔ FOSFATO – è il principale, favorito dal fatto che il pK dei
fosfati è 6,8 (vicino al pH urinario) ma è limitato dal fatto che
il suo utilizzo determina acidificazione dell'urina, che a sua volta
porta a aumento dell'escrezione urinaria di Ca ++
✔ AMMONIACA – viene utilizzata l'ammoniaca da deaminazione di
GLUTAMINA, lisina, alanina. La glutamina viene appositamente
sintetizzata a livello epatico per questo uso. Il sistema legato
agli AA permette la secrezione di H+ senza perdita di basi
Eq. acido-base
PROF. ALESSANDRO MALFATTI
Corso di Fisiologia Speciale
Veterinaria
IL SISTEMA DEL BICARBONATO
AUMENTO DEI BICARBONATI
➔ Sistema dei FOSFATI
pH 7,4
pH 6,0
Eq. acido-base
IL SISTEMA DEL BICARBONATO
AUMENTO DEI BICARBONATI
➔ Sistema dell'AMMONIACA
PROF. ALESSANDRO MALFATTI
Corso di Fisiologia Speciale
Veterinaria
Eq. acido-base
PROF. ALESSANDRO MALFATTI
Corso di Fisiologia Speciale
Veterinaria
ACIDOSI RESPIRATORIA E METABOLICA
➔ ACIDOSI METABOLICA
✔ Formazione o ingestione in eccesso di acidi organici o inorganici
➢Ruminanti: poca fibra, eccesso di concentrati, improvvisi
cambiamenti della dieta (ac. Lattico)
➢Cavallo da corsa, cane da caccia (... ma tutti): sforzo
muscolare intenso, prolungato, in non allenati (ac. Lattico)
➢Cane, gatto: ingestione di glicole etilenico (ac. Ossalico, ac.
Glicolico) che ha gusto gradevole
➢Selvatici o bradi: miopatia da cattura (ac. Lattico e altro)
➢Tutti: diabete mellito o chetosi (ac. Acetico, ac.
β idrossibutirrico)
✔ Perdita di basi – diarrea grave, soprattutto nei giovani
✔ Ritenzione di acidi - nelle nefriti croniche
Eq. acido-base
PROF. ALESSANDRO MALFATTI
Corso di Fisiologia Speciale
Veterinaria
ACIDOSI RESPIRATORIA E METABOLICA
➔ ACIDOSI METABOLICA
✔
Eq. acido-base
PROF. ALESSANDRO MALFATTI
Corso di Fisiologia Speciale
Veterinaria
ACIDOSI RESPIRATORIA E METABOLICA
➔ ALCALOSI METABOLICA
✔ Aumento di basi o perdita di acidi forti
➢Vomito persistente – per perdita di HCl
➢Carenza o deplezione di K+ - per secrezione di H+
✔
➔ Il RENE
diminuisce
l'escrezione degli
H+ e aumenta
quella dei
bicarbonati sino a
compensazione
Eq. acido-base
PROF. ALESSANDRO MALFATTI
Corso di Fisiologia Speciale
Veterinaria
ACIDOSI RESPIRATORIA E METABOLICA
➔ ACIDOSI RESPIRATORIA
✔ L'eliminazione polmonare di CO2 diviene inferiore alla produzione
di CO2 nell'organismo
➢Difetti della cassa toracica o della muscolatura respiratoria
➢Depressione dei centri respiratori
➢Ostacoli all'afflusso respiratorio o allo scambio gassoso
(infiammazioni, ostruzioni, problemi circolatori)
✔ Per il tamponamento degli H+ viene utilizzata l'Hb al posto della
CO2:
➢H2CO3 + Hb- ↔ HHb + HCO3✔ Il RENE aumenta la secrezione di H+ e il recupero di HCO3- che
può durare anche vari giorni, ma avrà effetto solo se la funzione
polmonare viene ristabilita
Eq. acido-base
PROF. ALESSANDRO MALFATTI
Corso di Fisiologia Speciale
Veterinaria
ACIDOSI RESPIRATORIA E METABOLICA
➔ ALCALOSI RESPIRATORIA
✔ L'eliminazione polmonare di CO2 supera la sua produzione
metabolica (iperventilazione alveolare)
➢Sovrastimolazione dei centri respiratori
✗ Diretta: avvelenamento da ammoniaca
✗ Indiretta: ipossiemia
➢HHb + HCO3- ↔ H2CO3 + Hb- → CO2 + H2O
✔ Il RENE dopo poche ore reagisce deprimendo la secrezione di
H+ e incrementando il tasso di eliminazione di HCO3-.
Questa reazione raggiunge la capacità massimale dopo alcuni
giorni, ma il recupero è condizionato dalla rimozione della
causa dell'iperventilazione
Eq. acido-base
PROF. ALESSANDRO MALFATTI
Corso di Fisiologia Speciale
Veterinaria
ACIDOSI RESPIRATORIA E METABOLICA
ACIDOSI RESPIRATORIA
ALCALOSI REPIRATORIA