Università Telematica Guglielmo Marconi
GGGGG
CF
Chimica
1
Elettrochimica e chimica sistematica
2
Argomenti
Gli argomenti trattati nella seguente unità didattica sono:
•
L’elettrochimica e i suoi principi e le sue applicazioni
•
Il funzionamento delle pile e degli elettrodi
•
La forza elettromotrice e i potenziali standard
•
L’equazione di Nerst
•
L’elettrolisi di sali fusi e in soluzione acquosa
- Le leggi di Faraday
- La cella elettrolitica
•
La chimica sistematica e la tavola periodica
- Le proprietà dei metalli, dei non metalli e dei metalloidi
- I principali gruppi degli elementi chimici
3
Obiettivi
Dopo aver studiato questa unità didattica lo studente dovrà :
•
Saper descrivere il funzionamento degli accumulatori quali pile nichel-cadmio e
zinco carbone nonché il funzionamento di un elettrodo
•
Saper descrivere la forza elettromotrice il suo significato in elettrochimica
•
Poter riconoscere le reazioni redox e identificare l’elemento ossidante e quello
riducente
•
Poter ricavare il E° per le reazioni redox
•
Saper applicare l’equazione di Nerst
•
Essere in grado di descrivere le Leggi di Faraday
•
Saper spiegare il processo di elettrolisi e il funzionamento di una cella elettrolitica
•
Sapersi orientare sulla tavola periodica
•
Essere in grado di descrivere le proprietà degli elementi e
•
saper relazionare proprietà dell’elemento e posizione nella tavola
4
Introduzione
La presente unità didattica propone allo studente lo studio dell’elettrochimica
partendo da spunti di ordine pratico.
È infatti sempre importante saper riportare gli elementi didattici che si imparano in
un contesto pratico così come è altrettanto importante saper far emergere i concetti
generali che sottostanno agli esempi pratici.
Lo studio dell’elettrochimica riporta entrambi questi aspetti poiché si passa
continuamente dalla descrizione del funzionamento di oggetti di uso comune, come
ad esempio le pile, all’enunciazione di leggi fisiche (come quella di Faraday) e alla
loro espressione matematica (come l’equazione di Nerst).
Infine, lo studio dei principali caratteri degli elementi chimici, ci avvicina ad un’altra
tipologia di chimica, la chimica descrittiva, che, sebbene attualmente assuma un
ruolo minore rispetto a quella sperimentale, non deve essere trascurata.
5
Elettrochimica
•
L'elettrochimica studia quelle reazioni in cui viene prodotta o consumata energia
elettrica.
•
Le reazioni interessate sono quelle in cui c'è scambio di elettroni vale a dire reazioni
di ossido-riduzione.
•
Ogni reazione di ossidoriduzione spontanea può consentire, in linea di principio, di
produrre energia elettrica, grazie al flusso di elettroni che vengono trasferiti dal
riducente (che si ossida) all’ossidante (che si riduce),
•
Sebbene questi fenomeni avvengano in modo caotico sviluppando calore, è possibile
realizzare un circuito in cui la soluzione dell’ossidante e quella del riducente sono
separate tra loro e gli elettroni passano dall’una all’altra attraverso un conduttore
metallico esterno, generando così una corrente elettrica.
•
Questo circuito, costituisce una pila elettrica e consente di trasformare energia
chimica in energia elettrica per mezzo di una reazione che avviene spontaneamente
(forza elettromotrice positiva).
•
Operando la trasformazione opposta, si realizza invece un processo chiamato
elettrolisi, caratterizzato da una reazione che procede nel verso opposto rispetto a
quella spontanea, e che richiede un apporto di energia dall’esterno per avvenire
(forza elettromotrice negativa).
6
La pila
•
Immergendo una sbarretta di Zn in acqua notiamo che alcuni ioni del metallo
passano in soluzione e si ha la reazione:
Zn (s) → Zn2+ + 2e-
•
Gli elettroni non passano nella fase acquosa ma restano nello zinco che si carica
negativamente mentre la fase acquosa positivamente stabilendo una differenza
di potenziale tra metallo (negativo) e soluzione (positiva).
•
La differenza di potenziale tra soluzione ed elettrodo (zn metallico) non può
essere misurata direttamente, ma solo valutata rispetto ad un elettrodo di
riferimento cui viene attribuito potenziale zero.
7
La pila
•
Consideriamo la pila formata da una
lamina di zinco immersa in una
soluzione di un sale di zinco (ZnSO4) e
da una lamina di rame immersa in una
soluzione di un sale di rame (CuSO4).
•
Le due soluzioni sono separate ma un
ponte salino consente il passaggio
degli ioni. Ciascuno dei due sistemi
elettrodo/soluzione rappresenta una
semicella (o semielemento).
•
Lo zinco a parità di condizioni manda
in soluzione ioni Zn2+ in quantità
maggiore rispetto agli ioni Cu2+ del
rame per cui nella pila l’elettrodo di
zinco sarà negativo e quello di rame
positivo. In una pila abbiamo sempre
– anodo: elettrodo negativo e in cui
si ha ossidazione
– catodo: elettrodo positivo e in cui
si ha riduzione
Schema di una pila
8
La pila
•
La reazione di ossidoriduzione alla base del funzionamento della pila avviene
solo se i due semielementi presentano due collegamenti:
– Collegamento elettrico affinché avvenga il flusso di elettroni
– Collegamento ionico costituito da un ponte salino e necessario perché
con il procedere del processo, la soluzione anodica si carica positivamente
(formazione di ioni Zn2+ ), quella catodica negativamente (scomparsa di ioni
Cu2+) e ciò bloccherebbe il funzionamento della pila. Il ponte salino (es.
KCl), che lascia passare ioni SO4 2- dalla soluzione catodica a quella anodica
ristabilisce la neutralità elettrica.
•
In una cella gli elettroni si spostano dall’anodo al catodo (es: Pila di Daniel)
Zn(s) → Zn2+(aq) + 2e-
ossidazione anodo
Cu2+(aq) + 2e- → Cu(s)
riduzione catodo
Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
•
reazione della cella
Notate che la somma delle due semireazioni è la reazione redox netta detta
reazione della cella.
9
Elettrodi
La pila
Consideriamo due tipi di elettrodi
•
Elettrodo inerte: costituito da una
barra di metallo inerte (di solito platino,
Pt o oro, Au) immerso in una soluzione
contenente due ioni legati da una
semireazione redox :
Fe3+(aq) + e- → Fe2+(aq)
•
Elettrodo a gas: costituito da una barra
di metallo inerte (Pt o Au) immersa in
una soluzione contenente uno ione in
equilibrio con il suo gas. L’esempio più
comune è elettrodo ad idrogeno:
H2(g) → 2H+(aq) + 2e-
•
Notate che il platino non partecipa in
nessuno dei due casi alla reazione di cella
ma serve solo per trasferire gli elettroni
dalla semicella al circuito.
Schema di un elettrodo ad idrogeno
10
La pila
Diagramma di Cella
•
Il diagramma di cella viene utilizzato per schematizzare graficamente la
disposizione degli elettrodi della pila.
•
Ad esempio nella pila di Daniel
(-) Zn (s) l Zn++ (aq) l l Cu++ (aq) l Cu (s) (+)
Dove
– la stanghetta singola l indica l’interfaccia fra elettrodo e soluzione
– la doppia stanghetta l l indica il ponte salino
– Per convenzione a sinistra si scrive il compartimento anodico e a destra
quello catodico
•
Per gli elettrodi a gas, il gas è separato dallo ione in soluzione da una barretta
verticale (separazione di fase gas-liquido)
•
Per gli elettrodi inerti i due ioni in soluzione sono separati da una virgola
11
La forza elettromotrice e i potenziali standard
Forza Elettromotrice
La forza elettromotrice (f.e.m. o E) è definita come la differenza di potenziale
che si stabilisce tra le due semicelle in assenza di passaggio di corrente e fornisce
un’indicazione quantitativa della probabilità che nella cella avvenga una certa
reazione di ossidoriduzione.
Quindi un valore positivo della f.e.m indica che la reazione redox corrispondente è
spontanea. In condizioni standard, E°cella = E°riduzione - E°ossidazione
Il potenziale standard di riduzione (E°) è il potenziale della semicella considerata
misurato in condizioni standard rispetto alla semicella standard ad idrogeno, per esempio,
e fornisce un’indicazione sulla tendenza delle varie specie a dare ossidazione o riduzione.
Esiste anche il potenziale di ossidazione di una data specie nella sua forma ridotta ed
è legato a quello di riduzione
Eossid (semireazione) = -Eriduz (semireazione opposta)
Per convenzione ci si riferisce solo ai potenziali di riduzione
12
La forza elettromotrice e i potenziali standard
Potenziale Standard
•
Quanto più positivo è il valore di E°, tanto più facilmente la coppia redox tenderà a
ridursi quindi in una cella si avrà riduzione nella semicella con un valore di E° più
positivo (catodo) ed ossidazione nell’altra (anodo).
•
Consideriamo le reazioni di:
Cu2+ + 2e- → Cu E° = 0,34 V
2H+ + 2e- → H2 (g) E° = 0,00 V
Zn2+ + 2e- → Zn E° = - 0,76 V
•
Dal confronto dei valori di potenziale, si può prevedere che in condizioni standard:
– in una pila ottenuta collegando rame/idrogeno il rame funge da catodo e dà
riduzione(E° = 0,34 V), l’idrogeno funge da anodo e dà ossidazione (E° = 0,00
V)
– in una pila ottenuta collegando idrogeno/zinco l’idrogeno funge da catodo e dà
riduzione (E° = 0,00 V), lo zinco funge da anodo e dà ossidazione (E° = - 0,76
V)
– in una pila ottenuta collegando rame/zinco il rame funge da catodo e dà
riduzione (E° = 0,34 V), lo zinco funge da anodo e dà ossidazione
(E° = - 0,76 V)
13
Equazione di Nerst
•
L’equazione di Nerst permette, noto il potenziale standard di una reazione di
ossidoriduzione ad una certa temperatura, di ricavare il potenziale della stessa
reazione quando le concentrazioni delle specie coinvolte sono diverse da 1.
•
Per una generica reazione di riduzione
Oss + ne- → Rid
E = E° −
a 25° C possiamo scrivere
[Rid]
0,0591
log
[Oss ]
n
Dove
E = potenziale in condizioni diverse da quelle standard
E° = potenziale standard di riduzione
n = elettroni acquistati
[Rid] e [Oss] = concentrazioni della forma ridotta e ossidata
14
Equazione di Nerst
Applicando l’equazione di Nernst ad una generica reazione di ossidoriduzione:
aA + bB → cC + dD (g) (A, B, C in soluzione, D gas)
si ottiene:
C] P
[
RT
E = E° −
log
a
b
nF
A
B
[ ][ ]
c
d
D
[
C ] PDd
0,0591
log a b
E = E° −
n
[A ] [B ]
c
Se le concentrazioni e le pressioni di tutte le specie che partecipano alla reazione
sono unitarie, cioè siamo in condizioni standard, il termine logaritmico si annulla ed
E coincide con E°.Notate inoltre che, per convenzione, la concentrazione dei solidi
viene considerata unitaria, mentre per le specie gassose si indica la loro pressione
parziale.
15
Relazione fra f.e.m. e costante di equilibrio
•
Si può dimostrare che la variazione di energia libera di una reazione è
strettamente correlata al lavoro utile massimo della reazione a T e P costanti:
∆G = Wmax
•
In una cella voltaica il lavoro è prevalentemente quello elettrico, -nFEcella, e
riferendosi alle condizioni standard avremo che
ΔG 0 = −nFE 0
cella
•
Inoltre dalla fem standard di una cella si può ottenere la costante di equilibrio
della reazione di cella:
ΔG 0 = −RT ln K
•
Quindi sostituendo
− nFE 0cella = −RT ln K
E 0cella =
•
RT
2,303RT
ln K =
log K
nF
nF
A 25°C abbiamo dei valori di T e sostituendo anche F
0
cella
E
0, 0592
=
log K
n
K = 10
nE 0cella
0 , 0592
16
Pile Zinco-Carbonio (Pile Leclanché)
•
La reazione anodica è l’ossidazione dello
zinco Zn(s) → Zn2+(aq) + 2 e-
•
La reazione catodica è complessa e una
delle reazioni principali è
MnO2(s) + 2 NH4+(aq) + 2 e- → Mn2O3(s)
+ 2 NH3(aq) + H2O(l)
•
L’ammoniaca che si forma al catodo
reagisce con parte degli ioni zinco prodotti
all’anodo creando il seguente ione
Zn(NH3)42+
•
Vantaggi:
– basso prezzo
– non fuoriuscita di materiale
•
Svantaggi:
– scarica rapida con forti consumi di
corrente
Sezione di una pila a zinco-carbonio
17
Pile Alcaline (a voltaggio costante)
•
•
•
•
•
Ha come reagenti lo zinco e MnO2 in condizioni basiche
Reazione anodica Zn(s) + 2 OH-(aq) → Zn(OH)2(s) + 2 eReazione catodica MnO2(s) + H2O(l) + 2 e- → Mn2O3(s) + 2OH-(aq)
Il voltaggio è di circa 1,54V
Caratteristiche:
– vita abbastanza lunga
– fornisce correnti relativamente altreper tempi maggiori rispetto a una pila
zinco-carbonio
Sezione di una pila alcalina
18
Pila a combustibile idrogeno-ossigeno
Anodo: H2(g) + 2 OH-(aq) → 2 H2O(l) + 2 eCatodo: O2(g) + 2 H2O(l) + 4 e- → 4 OH-(aq)
Vantaggi:
– non si deve sostituire il materiale degli
elettrodi
– il combustibile può essere fornito in
continuazione
Svantaggi:
– alti costi
– dimensioni grandi
Sezione di una pila a combustibile idrogeno-ossigeno
19
L’elettrolisi di sali fusi e in soluzione acquosa
Elettrolisi
•
Si chiama elettrolisi l’insieme dei fenomeni che avvengono in una soluzione
elettrolitica in seguito a passaggio di corrente elettrica e che trasformano
l’energia elettrica in energia chimica.
•
Contrariamente al caso delle pile si deve fornire energia per far avvenire una
reazione redox.
•
Applicando una differenza di potenziale ad un conduttore a conduzione ionica si
osserva l’esistenza di una soglia di potenziale, al di sotto della quale non si ha
passaggio di corrente.
•
Tale soglia è in relazione con la forza elettromotrice della pila, che procede nel
verso opposto rispetto alla reazione che si vuole realizzare ed è detta per questo
forza contro elettromotrice. Essa rappresenta il valore minimo da applicare
perché si abbia elettrolisi.
20
L’elettrolisi di sali fusi e in soluzione acquosa
Leggi di Faraday
Faraday condusse uno studio sistematico dell'elettrolisi ed enunciò le sue due leggi
dell'elettrolisi:
1. la quantità di sostanza prodotta o decomposta durante un processo di elettrolisi
è direttamente proporzionale alla quantità di carica elettrica che ha attraversato
la cella elettrolitica;
2. a parità di quantità di carica elettrica, la quantità di massa prodotta o
decomposta durante un processo di elettrolisi è proporzionale ai pesi atomici
degli elementi stessi, eventualmente divisi per fattori interi (massa equivalente).
L'osservazione di questi due fenomeni permise di ipotizzare la natura discontinua
dell'elettricità.
21
L’elettrolisi di sali fusi e in soluzione acquosa
Regole dell’Elettrolisi
Per effettuare correttamente l'elettrolisi bisogna conoscere le seguenti regole:
1. gli ioni H+ scavalcano gli ioni dei metalli che precedono l'idrogeno nella scala
redox, si riducono al catodo passando allo stato atomico e sviluppando idrogeno
molecolare;
2. gli ioni dei metalli che precedono l'idrogeno nella scala redox sono scavalcati al
catodo dagli ioni di idrogeno;
3. gli ioni dei metalli che seguono l'idrogeno nella scala redox lo scavalcano, si
riducono al catodo diventando atomi neutri e depositandosi su di esso;
4. il residuo alogenico Cl-, in soluzioni concentrate, scavalca gli ioni ossidrilici,
raggiunge l’anodo dove si ossida e si scarica sviluppando cloro gassoso;
5. i residui alogenici degli ossiacidi, all'anodo vengono scavalcati dagli ioni ossidrilici
che si scaricano e reagiscono a due a due formando acqua e ossigeno;
6. gli ioni ossidrilici scavalcano i residui alogenici e gli ioni fluoro e si ossidano
formando acqua e ossigeno.
22
L’elettrolisi di sali fusi e in soluzione acquosa
Cella Elettrolitica
•
Per cella elettrolitica si intende una cella in cui una corrente applicata fa avvenire
una reazione chimica non spontanea vale a dire una cella in cui avviene una
elettrolisi
•
L’elettrolisi è utile per preparare di alcuni elementi molto riducenti e difficilmente
ottenibili per via chimica, quali
Na+ + e- → Na(s)
E0 Na+ /Na=-2,71V
Mg2+ + 2e- → Mg(s)
Al3+ + 3e- → Al(s)
•
E0 Mg2+ /Mg=-2,36V
E0 Al3+ /Al=-1,68V
In una cella elettrolitica:
– non è necessario far avvenire separatamente le due semireazioni
– la polarità degli elettrodi è imposta dalla sorgente esterna di corrente elettrica
•
Esistono due tipi di elettrolisi:
– elettrolisi di sali fusi
– elettrolisi di soluzioni acquose di sali
•
Infine ricordate che in una cella elettrolitica le polarità sono invertite rispetto ad una
23
cella voltaica.
L’elettrolisi di sali fusi e in soluzione acquosa
Elettrolisi di sali fusi
Nell’elettrolisi di sali fusi le possibili
semireazioni sono quelle che interessano gli
ioni che formano il sale.
Ad esempio la cella elettrolitica per
l’elettrolisi di NaCl fuso è schematizzata a
lato.I due elettrodi sono inerti ( platino o
grafite) e vengono immersi in una soluzione
di NaCl fuso.
Gli elettrodi sono connessi ad un generatore
di corrente elettrica o batteria.
Reazione anodica:
E0Cl2/Cl-=1.36V
Cl-(l) → ½Cl2(g) + eReazione catodica:
Na+(l) + e- → Na(s)
- E0Na+/Na=2.71V
Reazione totale:
Na+(l) + Cl-(l) → Na(s) + ½ Cl2(s)
E0cella=4.07V
Notate che questi valori numerici si
riferiscono a condizioni standard e quindi
sono solo un’approssimazione
Cella elettrolitica per l’elettrolisi di NaCl fuso
24
L’elettrolisi di sali fusi e in soluzione acquosa
In questo caso bisogna considerare anche le
possibili reazioni che coinvolgono l’acqua.
L’acqua può dare sia una semireazione di riduzione
2H2O(l) + 2e- → H2(g) + 2OH-(aq)
E0H2O/H2=-0,83V
che una di ossidazione
2H2O(l) → O2(g) + 4H+(aq) + 4e-E0O2/H2O=-1,23V
Nel caso di una soluzione acquosa di NaCl avremo
anche
Rid: Na+(aq) + e- → Na(s) E0Na+/Na=-2,71V
-E0Cl2/Cl-=-1,36V
ox: Cl-(aq) → ½Cl2(s) + eSi riducono e si ossidano solo le specie con
potenziale di ossidazione maggiore quindi al
catodo si ridurrà l’H2O mentre all’anodo si ossiderà
il Cloro perché la piccola differenza di potenziale
tra i due viene annullata
Cella elettrolitica per NaCl in soluzione acquosa
25
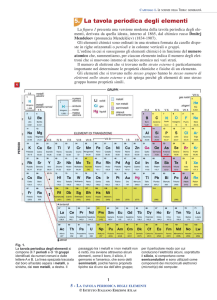
La chimica sistematica e la tavola periodica
Gli elementi chimici nella tavola periodica
Una prima divisione sistematica degli
elementi della tavola periodica si
basa sul loro carattere metallico o
non metallico
I metalli sono caratterizzati da:
- basse energie di ionizzazione
- affinità elettroniche positive e
piccole
- bassa elettronegatività
Essi hanno la tendenza a perdere gli
elettroni di valenza formando
cationi:
Na+ Ca2+
Al3+
Andamento delle proprietà degli elementi
nella tavola periodica
26
La chimica sistematica e la tavola periodica
Gli elementi chimici nella tavola periodica
I non-metalli sono caratterizzati da:
- elevate energie di ionizzazione
- affinità elettroniche negative e
grandi
- elevata elettronegatività
Essi hanno la tendenza ad acquistare
elettroni formando anioni
monoatomici ed ossanioni:
Cl- Br-
S2-
NO3- SO42ClO4Andamento delle proprietà degli elementi
nella tavola periodica
27
La chimica sistematica e la tavola periodica
Carattere degli elementi chimici e posizione nella tavola periodica
Gli elementi con caratteristiche esclusivamente metalliche si trovano all’estrema sinistra
della tavola periodica( gruppi IA e IIA),
Gli elementi con caratteristiche esclusivamente/non-metalliche si trovano all’estrema
destra della tavola periodica (gruppi VII e VIII).
Dal gruppo IIIA al gruppo VIIA nei gruppi sono presenti alcuni elementi che hanno
caratteristiche intermedie tra i metalli e i nono metalli, questi elementi sono detti
metalloidi.
Tutti questi gruppi sono contrassegnati dalla lettera A e sono detti elementi significativi.
Gli elementi compresi nei gruppi B, posti al centro della tavola sono detti elementi di
transizione, hanno caratteristiche prevalentemente metalliche.
Gli elementi compresi nelle due lunghe righe a parte sono detti elementi di transizione
interni (lantanidi e attinidi)
28
La chimica sistematica e la tavola periodica
Gli elementi azzurri hanno caratteristiche prevalentemente metalliche
Gli elementi rossi hanno caratteristiche non metalliche
Gli elementi viola hanno caratteristiche intermedie (metalloidi)
29
La chimica sistematica e la tavola periodica
Stati di ossidazione dei metalli
Lo stato di ossidazione degli elementi metallici corrisponde al numero del gruppo e ossia al
numero degli elettroni di valenza che perdono quando formano ioni.
Stati di ossidazione dei metalli
30
La chimica sistematica e la tavola periodica
Stati di ossidazione dei metalli
I metalli più pesanti (periodo 5 o 6) possono mantenere i due elettroni s di valenza e dare
stati di ossidazione pari al numero del gruppo meno due.
Stati di ossidazione dei metalli pesanti
31
La chimica sistematica e la tavola periodica
Stati di ossidazione dei non metalli
I non-metalli (eccetto gli elementi più elettronegativi,
come F e O) sono caratterizzati da molti numeri di
ossidazione, compresi tra:
- il numero del gruppo
(n° d’ossidazione più alto)
- numero del gruppo -8
-tutti gli elettroni di
valenza persi
-acquisto di elettroni fino al
gas nobile successivo
VII A
da +7 a -1
VI A
da +6 a -2
VA
da +5 a -3
Stati di ossidazione dei non-metalli
e relativi ioni
32
La chimica sistematica e la tavola periodica
Elementi del gruppo IA
Gli elementi del Gruppo IA della tavola periodica sono chiamati metalli alcalini.
Hanno spiccate proprietà metalliche quali:lucentezza, forte reattività, basso punto di
fusione, scarsa durezza.
Hanno conformazione ns1 nel loro orbitale di valenza, tendono pertanto a formare
monocationi solubili in acqua (Li+, Na+, K+, Rb+ e Cs+) in presenza di H2O forniscono
idrossidi e liberano idrogeno molecolare
Es:2 Li(s) + 2H2O(l) → 2 LiOH(aq) + H2(g)
La reazione è caratterizzata da un ΔH molto elevato, tanto che può capitare che l’H2 si
incendi. La reattività aumenta scendendo lungo il gruppo perché con la diminuzione
l’energia di ionizzazione e l’elettrone esterno viene perso più facilmente.
33
La chimica sistematica e la tavola periodica
Elementi del gruppo IA
Sono chiamati alcalini perchè formano ossidi basici di formula (M2O) che reagiscono con
acqua danno idrossidi (cioè basi forti)
2 Li(s) + ½O2(g) → Li2O(s)
Li2O(s) + H2O(l) →2 LiOH(s) → 2 Li+ + 2 OHA causa della loro elevata reattività non si trovano mai come metalli liberi in natura ma
come cationi in Sali
Grazie al loro basso potenziale di riduzione sono utilizzati in chimica sperimentale nelle
reazioni di elettrolisi dei loro sali fusi
NaCl(l) → Na(s) + ½Cl2(g)
elettrolisi
34
La chimica sistematica e la tavola
periodica
Tavola riassuntiva del gruppo IA
35
La chimica sistematica e la tavola periodica
Elementi del gruppo IIA
Gli elementi del gruppo IIA sono chiamati metalli alcalino terrosi.
Sono caratterizzati da una minor reattività rispetto ai metalli alcalini, da una
maggior durezza e da un punto di fusione più alto.
Hanno conformazione elettronica ns2 pertanto tendono a formare bicationi
solubili in H2O (Mg2+, Ca2+, Sr2+, Ba2+.)
In presenza di acqua formano idrossidi e liberando idrogeno molecolare ma in
maniera meno violenta dei metalli alcalini:
Ca(s) + 2H2O(l) → 2 CaOH2(aq) + H2(g)
36
La chimica sistematica e la tavola periodica
Elementi del gruppo IIA
Anch’essi hanno caratteristiche alcaline
perché formano ossidi basici, cioè basi forti
Ca(s) + ½O2(g) → CaO(s)
CaO(s) + H2O(l) → CaOH2(s) → Ca2+ + 2
OHCosì come i metalli alcalini, gli alcalino
terrosi non esistono liberi in natura e
possono essere preparati per elettrolisi dei
cloruri o per riduzione dell’ossido con un
metallo che formi ossidi più stabili.
Elettrolisi del cloruro di magnesio
37
La chimica sistematica e la tavola periodica
Tavola riassuntiva del gruppo IIA
38
La chimica sistematica e la tavola periodica
Elementi del gruppo IIIA
Gli elementi del gruppo IIIA hanno caratteristiche piuttosto differenti tra di loro, in
particolare si osserva una chiara tendenza all’aumento del carattere metallico
scendendo lungo il gruppo dal boro al tallio.
Hanno configurazione elettronica ns2 np1
Il boro forma legami covalenti con stato di ossidazione +3.
Gli altri elementi hanno la tendenza a perdere i tre elettroni di valenza dando tricationi
(Al3+, Ga3+, In3+, Tl3+) .
L’alluminio può anche formare legami covalenti polari.
Gli elementi più pesanti, dal gallio in poi, possono perdere solo l’elettrone p dando
monocationi (Ga+, In+, Tl+) la cui stabilità aumenta scendendo lungo il gruppo: lo stato
di ossidazione +1 è il più stabile per il tallio.
.
39
La chimica sistematica e la tavola periodica
Elementi del gruppo IIIA
Sono metalli che danno ossidi ( M2O3,) con carattere anfotero per i primi due
elementi, Al e Ga, e basico per i due successivi, In e Tl.
Fa eccezione il Boro che è un metalloide e che si comporta come un non-metallo,
anch’esso forma un ossido, B2O3.
Il suo idrossido, B(OH)3, è un acido, l’acido borico, la cui formula spesso si indica
come H3BO3 e che ha proprietà antisettiche.
L’alluminio reagisce con gli alogeni per dare alogenuri di alluminio, che sono acidi di
Lewis molto reattivi utilizzati in chimica organica come catalizzatori.
40
La chimica sistematica e la tavola periodica
Tavola riassuntiva del gruppo IIIA
41
La chimica sistematica e la tavola periodica
Elementi del gruppo IVA
Così come i precedenti,anche gli elementi del gruppo IV mostrano
una tendenza ad un maggior carattere metallico scendendo lungo il
gruppo dal Carbonio al Piombo.
Il Carbonio, è un non-metallo, i successivi due Silicio e Germanio
sono metalloidi, mentre gli ultimi due, stagno e piombo, sono
metalli.Hanno una configurazione elettronica di valenza ns2 np2
IL Carbonio forma legami covalenti forti con altri atomi di carbonio
per formare una gran varietà di catene ed anelli caratteristici dei
composti organici.
Carbonio, Silicio e Germanio formano quattro legami covalenti, più
raramente talvolta due.Stagno e Piombo tendono a perdere tutti e
quattro gli elettroni di valenza oppure soltanto i due elettroni np2 e a
formare composti con stato di ossidazione +4 e +2.
Elementi del gruppo IV
42
La chimica sistematica e la tavola periodica
Elementi del gruppo IVA
Il carbonio e il silicio formano molti composti
covalenti a geometria tetraedrica impiegando
orbitali ibridi sp3.
Tutti gli elementi del gruppo formano ossidi di
formula generale EO2
Come il biossido di carbonio (CO2) e la
silice (SiO2)
Struttura della silice
43
La chimica sistematica e la tavola periodica
Tavola riassuntiva del gruppo IVA
44
La chimica sistematica e la tavola periodica
Elementi del gruppo VA
Anche gli elementi del gruppo VA
acquisiscono gradualmente caratteristiche
metalli che scendendo lungo il gruppo.
Essi passano da non metalli (azoto,
fosforo)
a
semimetalli
(arsenico,
antimonio) e infine a metalli (bismuto).
Gli stati di ossidazione più comuni sono
–3, +3 e +5
Formano ossidi con formule minime E2O3
ed E2O5 con stati di ossidazione +3 e +5.
VIIA
IIB
VIIIA
He
IIIA
IVA
VA
VA
VIA
VIIA
B
C
N
O
F
Ne
Al
Si
P
S
Cl
Ar
Ga
Ge
As
Se
Br
Kr
In
Sn
Sb
Te
I
Xe
Tl
Pb
Bi
Po
At
Rn
Elementi del gruppo V
45
La chimica sistematica e la tavola periodica
Elementi del gruppo VA
L’azoto esiste come molecola biatomica gassosa N2, che costituisce circa il 78%
dell’atmosfera. A causa del suo triplo legame tale molecola è molto poco reattiva.
Il fosforo è presente in natura in tre diverse forme allotropiche: fosforo bianco, fosforo
rosso e fosforo nero
L’arsenico e l’antimonio sono solidi friabili, e il bismuto è un metallo.
Struttura atomica del fosforo bianco e rosso
46
La chimica sistematica e la tavola periodica
Anche gli elementi del gruppo VIA
acquisiscono gradualmente caratteristiche
metalli che scendendo lungo il gruppo.
Essi passano da non metalli Ossigeno, Zolfo,
Selenio, a semimetalli Tellurio e infine a
metalli Polonio
Gli stati di ossidazione più comuni sono –2,
+4 e +6.
Tutti gli elementi formano idruri di formule
H2O, H2S, H2Se, H2Te e stato di ossidazione
–2.
Elementi del gruppo VIA
L’elemento di gran lunga più importante è
l’Ossigeno che è molto reattivo e forma
composti binari con quasi tutti gli elementi,
in genere ossidi
Lo Zolfo è un solido friabile giallo costituito
nella forma allotropica più stabile da
molecole S8 e analogo comportamento ha il
Selenio.
VIIA
IIB
VIIIA
He
IIIA
IVA
VA
VA
VIA
VIIA
B
C
N
O
F
Ne
Al
Si
P
S
Cl
Ar
Ga
Ge
As
Se
Br
Kr
In
Sn
Sb
Te
I
Xe
Tl
Pb
Bi
Po
At
Rn
Elementi del gruppo VI
47
La chimica sistematica e la tavola periodica
Elementi del gruppo VIA
L’Ossigeno, rispetta la regola
dell’ottetto nella formazione di legami
covalenti poichè può impiegare solo
gli orbitali s e p.
In natura si trova sotto forma di
composto gassoso biatomico O2 ma
possiede anche un allotropo, noto
come ozono O3
Gli elementi successivi possono
invece impiegare anche orbitali d e a
sei coppie di elettroni raggiungendo
gli stati di ossidazione +4 e +6.
Rappresentazione tridimensionale
della molecola di ozono
48
La chimica sistematica e la tavola periodica
Gli elementi di questo gruppo sono detti
alogeni, presentano proprietà molto
simili tra di loro poiché sono tutti non
metalli (fatta eccezione per l’Astato che
però è raro e radioattivo).
X2: F2 e Cl2 sono presenti in natura sotto
forma di molecole biatomiche gassose
molto reattive, Br2 è un liquido e I2 è un
solido.
Gli stato di ossidazione più comune è –1,
pertanto questi elementi tendono ad
acquistare un elettrone per passare dalla
configurazione ns2np5 a quella ns2np6 del
tipo gas nobile.
Formano tutti idruri HX di spiccate
caratteristiche acide, sono detti anche
acidi alogenidrici sempre con stato di
ossidazione –1.
Elementi del gruppo VIIA
VIIA
IIB
VIIIA
He
IIIA
IVA
VA
VA
VIA
VIIA
B
C
N
O
F
Ne
Al
Si
P
S
Cl
Ar
Ga
Ge
As
Se
Br
Kr
In
Sn
Sb
Te
I
Xe
Tl
Pb
Bi
Po
At
Rn
Elementi del gruppo VII
49
La chimica sistematica e la tavola periodica
Elementi del gruppo VIIA
Ad eccezione del Fluoro, che è l’elemento più elettronegativo e che ha un solo numero di
ossidazione -1, gli altri elementi possono avere più numeri di ossidazione e formare
composti impiegando anche gli orbitali d.
I composti più comuni sono ossiacidi, in cui compare l’elemento ossigeno, che in acqua
forniscono gli anioni corrispondenti.
HClO acido ipocloroso
ClO- ione ipoclorito n.o. +1
HClO2 acido cloroso
ClO3- ione clorito
n.o. +3
HClO3 acido clorico
ClO3- ione clorato
n.o. +5
HClO4 acido perclorico
ClO3- ione perclorato n.o. +7
Stessi composti (con analoga nomenclatura) sono formati dal Bromo e, in parte, dallo
Iodio.
50
La chimica sistematica e la tavola periodica
Gli elementi del gruppo VIII sono noti anche
come gas nobili.
Si presentano in natura come gas monoatomici
e esistono in piccole quantità nell’atmosfera.
Hanno configurazione elettronica ns2 np6
particolarmente stabile,
un’elevata energia di ionizzazione ed un’affinità
elettronica positiva tutte caratteristiche che
concorrono a renderli pressochè non-reattivi.
In realtà è stato possibile preparare
sperimentalmente composti dello Xeno con i
due elementi più reattivi, fluoro ed ossigeno,
quali XeF4 e XeO3, ed in seguito anche per
Kripton e Radon.
Questi però sono composti altamente instabili e
si decompongono rapidamente negli elementi
costituenti.
Elementi del gruppo VIIIA
VIIA
IIB
VIIIA
He
IIIA
IVA
VA
VA
VIA
VIIA
B
C
N
O
F
Ne
Al
Si
P
S
Cl
Ar
Ga
Ge
As
Se
Br
Kr
In
Sn
Sb
Te
I
Xe
Tl
Pb
Bi
Po
At
Rn
Elementi del gruppo VIII
51
Copyright
AVVISO - Ai sensi dell'art. 1, comma 1 del decreto-legge 22 marzo 2004, n. 72, come modificato
dalla legge di conversione 21 maggio 2004 n. 128, le opere presenti su questo sito hanno assolto
gli obblighi derivanti dalla normativa sul diritto d'autore e sui diritti connessi. Tutti i
contenuti sono proprietà letteraria riservata e protetti dal diritto di autore della Università
Telematica Guglielmo Marconi.
Si ricorda che il materiale didattico fornito è per uso personale degli studenti, al solo scopo
didattico. Per ogni diverso utilizzo saranno applicate le sanzioni previste dalla legge 22 aprile
1941, n. 633.
Copyright©UNIMARCONI
52