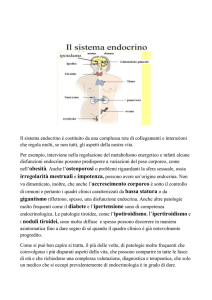
Impact of the multi-gene ThyroSeq next-generation sequencing assay
on cancer diagnosis in thyroid nodules with atypia of
undeterminedsignificance/follicular lesion of undetermined significance
cytology.
Nikiforov YE, Carty SE, Chiosea SI, Coyne C, Duvvuri U, Ferris RL, Gooding WE, LeBeau SO,
Ohori NP, Seethala RR, Tublin ME, Yip L, Nikiforova MN.
RIASSUNTO
Background: Fine-needle aspiration (FNA) cytology is a common approach to evaluate thyroid
nodules. It offers definitive diagnosis of a benign or malignant nodule in the majority of cases.
However, 10–25% of nodules yield one of three indeterminate cytologic diagnoses, leading to
suboptimal management of these patients. Atypia of undetermined significance/follicular lesion of
undermined significance (AUS/FLUS) is a common indeterminate diagnosis, with the cancer risk
ranging from 6% to 48%. This study assessed whether a multi-gene next-generation sequencing
(NGS) assay can offer significant improvement in diagnosis in AUS/FLUS nodules.
Methods: From May 2014 to March 2015, 465 consecutive FNA samples with the cytologic
diagnosis of AUS/FLUS underwent prospective molecular testing using the ThyroSeq v2.1 panel.
The panel included 14 genes analyzed for point mutations and 42 types of gene fusions occurring in
thyroid cancer. In addition, eight genes were assessed for expression in order to evaluate the cell
composition of FNA samples. Ninety-eight (21%) of these nodules had definitive surgical (n = 96)
or nonsurgical (n = 2) follow-up and were used to determine the assay performance.
Results: Among 465 AUS/FLUS nodules, three were found to be composed of parathyroid cells
and 462 of thyroid follicular cells. Of the latter, 31 (6.7%) were positive for mutations. The most
frequently mutated genes were NRAS and HRAS, and overall point mutations in seven different
genes and five types of gene fusions were identified in these nodules. Among 98 nodules with
known outcome, histologic analysis revealed 22 (22.5%) cancers. ThyroSeq v2.1 was able to
classify 20/22 cancers correctly, showing a sensitivity of 90.9% [confidence interval (CI) 78.8–
100], specificity of 92.1% [CI 86.0–98.2], positive predictive value of 76.9% [CI 60.7–93.1], and
negative predictive value of 97.2% [CI 78.8–100], with an overall accuracy of 91.8% [CI 86.4–
97.3].
Conclusions: The results of the study demonstrate that the ThyroSeq v2.1 multi-gene NGS panel of
molecular markers provides both high sensitivity and high specificity for cancer detection in thyroid
nodules with AUS/FLUS cytology, which should allow improved management for these patients.
COMMENTO
I noduli tiroidei classificati come atypia of undetermined significance/follicular lesion of
undetermined significance (AUS/FLUS), secondo il sistema Bethesda, o TIR 3A, secondo la
SIAPEC-AIT2013, costituiscono circa il 10% delle diagnosi citologiche. Il rischio di malignità in
questa categoria è circa il 15 % ma varia dal 6 % al 48 % nelle diverse casistiche. Il presente studio
analizza la performance di un pannello multigenico, denominato ThyroSeq v2, nel determinare se
un nodulo classificato come AUS/FLUS è benigno o maligno. Questo metodo ricerca le mutazioni
puntiformi in 14 geni (AKT1, BRAF, NRAS, HRAS, KRAS, PTEN, TP53, TSHR, GNAS,
CTNNB1, RET, PIK3CA, TERT, EIF1AX) e 42 tipi di fusioni geniche. Quattrocentoquarantuno
pazienti, con un totale di 465 noduli classificati come AUS/FLUS, sono stati arruolati in questo
studio prospettico presso il Medical Center della University of Pittsburgh. Quattocentotrentuno/465
noduli (93%) sono risultati negativi per la presenza di mutazioni e 31/465 (7%) positivi;
successivamente 70 noduli negativi per mutazioni e 26 positivi sono stati trattati chirugicamente.
L’analisi molecolare ha identificato correttamente 88 noduli come benigni (=68) o maligni (=20)
con 6 casi falsi positivi e 2 falsi negativi. Il valore predittivo negativo (VPN) risultava, pertanto,
pari a 97.2% e il valore predittivo positivo (VPP) pari a 76.9%. Tre/6 noduli falsi positivi erano
mutati per il gene RAS (2 HRAS e 1 NRAS), 2 noduli presentavano una mutazione nel gene
EIF1AX o PTEN ed infine uno una fusione genica di THADA. All’esame microscopico i noduli
con mutazione di RAS mostravano caratteristiche nucleari sospette per carcinoma papillare (PTC) e
aree focali di espressione di un marcatore caratteristico del PTC, suggerendo una iniziale
trasformazione delle lesioni. Questi aspetti insieme alle evidenze sperimentali che RAS sia un
oncogene coinvolto nella progressione dei tumori da benigni a maligni suggeriscono di considerare
questi noduli come lesioni precancerose, aumentando in tal modo il VPP di questo metodo che
approssimandosi al 100% elimina virtualmente l’occorrenza di chirurgia a scopo diagnostico in
questa categoria citologica. Per quanto riguarda i noduli negativi per mutazioni, il rischio residuo di
cancro e’ risultato pari al 3%. E’ stato suggerito che se il rischio di cancro in un nodulo è ≤5 %,
cioe’ simile a quello di una lesione con citologia benigna, puo’ essere consigliato il monitoraggio
della lesione anziche’ la terapia chirurgica. Pertanto i pazienti con noduli a citologia AUS/FLUS e
negativi al test ThyroSeq possono essere gestiti con il follow-up. La performance di questo metodo
e’ simile al pannello a 7 geni (BRAF, NRAS, HRAS, KRAS, RET/PTC e PPARγ/PAX8) e presenta
un VPN sovrapponibile a quello del gene expression classifier Afirma, tuttavia quest’ultimo
presenta un limite importante rappresentato dall’elevato numero di falsi positivi quando il risultato
e’ sospetto obbligando dunque ad aumentare le lobectomie diagnostiche. In conclusione, il pannello
multigenico ThyroSeq v2.1 ha dimostrato un’elevata performance sia come metodo ‘‘rule in’’
sia‘‘rule out’’ nei noduli con citologia AUS/FLUS.
Tania Pilli
U.O.C. Endocrinologia
Azienda Ospedaliera Universitaria Senese
Viale Bracci 1, Siena, 53100
E-mail: [email protected]