NOMENCLATURA E SCRITTURA DELLE FORMULE NEI
COMPOSTI
Con il termine nomenclatura si intende l’assegnazione di un
nome corretto, univoco e non ambiguo ad ogni composto
chimico
COMPOSTI BINARI
Sono composti formati da 2 soli elementi chimici
Convenzionalmente si scrivono ponendo prima l’elemento
meno elettronegativo seguito da quello più elettronegativo
Ogni simbolo chimico è seguito da un indice che indica il
numero di atomi presenti nel composto
Gli indici sono tali per cui la molecola è neutra
PERIODICITA’ DELLE PROPRIETA’ CHIMICHE DEGLI ELEMENTI:
GLI IDRURI (O IDRACIDI)
Sono composti dell’idrogeno con metalli più elettropositivi
L’idrogeno ha numero di ossidazione = -1
L’IDRURO è l'anione dell'idrogeno, H−
Il termine viene anche utilizzato come termine più generico
per descrivere alcuni composti dell'idrogeno con altri
elementi, particolarmente quelli dei gruppi 1–16,
nell'eventualità (oppure no) che in realtà contengano ioni
idruro
Si originano quindi composti binari detti IDRURI o IDRACIDI
Sono basi fortissime ed altrettanto forti agenti riducenti
Virtualmente ogni elemento della tavola periodica (eccetto i
gas nobili) formano uno o più tipi di idruri
Gli idruri possono essere classificati in tre categorie principali
in base alla natura predominante del loro legame:
- Idruri ionici, noti anche come idruri salini;
- Idruri covalenti;
- Idruri metallici
Acido
HF
HCl
HBr
HI
H2S
HCN
Nomenclatura
convenzionale
Fluoruro di idrogeno
Cloruro di idrogeno
Bromuro di idrogeno
Ioduro di idrogeno
Solfuro di idrogeno
Cianuro di idrogeno
Nomenclatura tradizionale
Acido fluorodrico
Acido cloridrico
Acido bromidrico
Acido iodidrico
Acido solfidrico
Acido cianidrico
GRUPPO I A e II A: a causa dell’elevata differenza di
elettronegatività tra questi metalli e l’idrogeno, formano
IDRURI IONICI. Vengono definiti IDRURI seguito dal nome
dell’elemento (idruro di calcio, idruro di potassio, ecc.)
Negli idruri ionici l'idrogeno si comporta come un alogeno e
strappa un elettrone a un metallo formando uno ione idruro
(H−), e ottenendo così la configurazione elettronica stabile
dell'elio o riempiendo l'orbitale s
L'altro elemento è un metallo più elettropositivo
dell'idrogeno, normalmente appartenente ai metalli alcalini o
ai metalli alcalino terrosiLe formule chimiche degli idruri
ionici binari possono essere del tipo MH (come per il LiH) o
MH2 (come per il MgH2). Anche gli idruri di gallio, indio, tallio
e dei lantanidi sono ionici.
Sono ottenuti facendo reagire l'elemento con idrogeno
gassoso e sotto pressione, se necessario
ALTRI GRUPPI: formano legami covalenti (IDRURI COVALENTI)
più o meno polarizzati. Vengono definiti aggiungendo il
suffisso –uro all’elemento seguito dalla parola idrogeno
(cloruro di idrogeno, solfuro di idrogeno, ecc.)
Alcuni elementi che hanno caratteristiche intermedie tra
ioniche e covalenti
Come suggerisce il nome, l'idrogeno è legato covalentemente
agli elementi con orbitale p più elettropositivo (boro,
alluminio e il gruppo 4-7) e con il berillio
Composti comuni come gli idrocarburi, l'ammoniaca e
l'idrazina possono essere considerati idruri del carbonio e
dell'azoto ma il termine è usato solamente per classificare
collettivamente tutti i composti dell'idrogeno di un elemento
L'ammoniaca, in effetti, non è mai chiamata triidruro di azoto
IDRURI IONICI
GRUPPO IIA: Formula generale: XH2 in cui lo ione idruro si lega nel
rapporto di 1:2 con il metallo alcalino-terroso
IDRURO DI BERILLIO= BeH2 con caratteristiche intermedie
IDRURO DI MAGNESIO=MgH2 con caratteristiche intermedie
IDRURO DI CALCIO= CaH2………….
IDRURI COVALENTI
GRUPPO IIIA: Formula generale: XH3 in cui lo ione idruro si lega nel
rapporto di 1:3 con l’elemento (eccezione BORO)
IDRURO DI BORO= B2H6
IDRURO DI ALLUMINIO=AlH3con caratteristiche intermedie
IDRURO DI GALLIO= GaH3con caratteristiche intermedie…….
GRUPPO IVA: Formula generale: XH4 in cui lo ione idruro si lega nel
rapporto di 1:4 con l’elemento
METANO= CH4
SILANO=SiH4………….
IDRURI COVALENTI
GRUPPO VA: Formula generale: XH3 in cui l’elemento mantiene una
coppia di elettroni non condivisa
AMMONICA = NH3
FOSFINA = PH3……..
GRUPPO VI A: Formula generale: H2X legano due atomi di idrogeno e
mantengono due coppie di elettroni non condivise
ACQUA= H2O
SOLFURO DI IDROGENO=H2S……….
GRUPPO VII A (ALOGENI): Formula generale: HX legano un atomo di
idrogeno e mantengono tre coppie di elettroni non condivise
FLORURO DI IDROGENO (ACIDO FLUORIDRICO)= HF
CLORURO DI IDROGENO (ACIDO CLORIDRICO)=HCl
BROMURO DI IDROGENO (AXIDO BROMIDRICO)=HBr
IODURO DI IDROGENO (ACIDO IODIDRICO)=HI……….
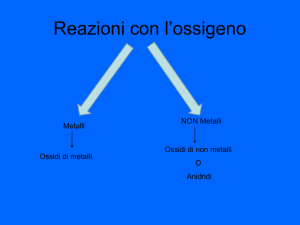
COMPOSTI BINARI CON L’OSSIGENO: GLI OSSIDI
L’ossigeno è un elemento che reagisce con tutti gli elementi,
eccettuati i gas nobili più leggeri
Gli ossidi propriamente detti sono i composti binari
dell’ossigeno con i metalli e si tratta di composti basici
Si chiamano invece anidridi (che significa “ossidi acidi”) i
composti binari dell’ossigeno con i non-metalli
Le proprietà di un ossido dipendono in larga misura dalla
elettronegatività dell’elemento che si lega con l’ossigeno, in
quanto quest’ultimo, dopo il fluoro, presenta il valore
massimo di elettronegatività
METALLO + OSSIGENO definiti OSSIDI BASICI o solo OSSIDI
NON-METALLO + OSSIGENO definiti OSSIDI ACIDI o ANIDRIDI
Gli OSSIDI sono i composti di
combinazione degli elementi
con l’ossigeno
COMPOSTI BINARI CON L’OSSIGENO: GLI OSSIDI
Gli elementi dei gruppi IA, IIA e IIIA formano OSSIDI IONICI
mentre quelli degli altri gruppi OSSIDI COVALENTI
OSSIDI IONICI
GRUPPO IA: Formula generale: X2O
OSSIDO DI LITIO = Li2O
GRUPPO IIA: Formula generale: XO
OSSIDO DI BERILLIO= BeO
GRUPPO IIIA: Formula generale: X2O3
OSSIDO DI BORO= B2O3 caratteristiche intermedie
OSSIDO DI ALLUMINIO ionico
Gli ossidi degli elementi del 1° e del 2° gruppo sono ionici
Na+
O2-
Ca2+
O2-
Na+
Na2O (ossido di disodio)
CaO (ossido di calcio)
Gli elementi del 3° gruppo legano l’ossigeno in
rapporto 2:3
Gruppo Formula
III
IV
Al2O3
B2O3
CO2
CO
SiO2
Nomenclatura IUPAC
Triossido di dialluminio
Triossido di diboro
Diossido di carbonio
Ossido di carbonio
Diossido di silicio
Nomenclatura
tradizionale
Ossido di alluminio
Anidride borica
Anidride carbonica
Ossido di carbonio
Anidride silicica
Gli elementi del 4° gruppo si legano all’ossigeno in
rapporto stechiometrico 1:2
(non nel monossido di carbonio)
Gruppo Formula
Nomenclatura IUPAC
N2O
Ossido di diazoto
NO
Ossido di azoto
N2O3
Triossido di diazoto
NO2
Diossido di azoto
V
N2O5
Pentossido di diazoto
P2O3
Triossido di difosforo
P2O5
Pentossido di difosforo
SO2
Diossido di zolfo
VI
SO3
Triossido di zolfo
GRUPPO VA: l’azoto forma ben 5 ossidi
il fosforo forma 2 ossidi
GRUPPO VIA: Lo zolfo forma 2 ossidi
Nomenclatura
tradizionale
Protossido di azoto
Ossido di azoto
Anidride nitrosa
Ipoazotide
Anidride nitrica
Anidride fosforosa
Anidride fosforica
Anidride solforosa
Anidride solforica
·
·N··
··O
·
·N· ·
O
Ossido di diazoto
o
protossido di azoto
(gas esilarante)
·
·
·N·· ·O
Ossido di azoto
·N··
·
··
N
··O
O
Triossido di diazoto
o
anidride nitrosa
O
·
·
·N·· ·O
biossido di azoto
ipoazotide
O
O
O
·N··
··O
N·
··
O
Pentossido di diazoto
o
anidride nitrica
O
·P··
·
··
P
O
··O
O
O
O
·P··
··O
P·
··
O
Triossido di difosforo
Pentossido di difosforo
o
anidride fosforosa
o
anidride fosforica
O
S O
biossido di zolfo (anidride solforosa)
O
O
S
O
triossido di zolfo (anidride solforica)
Gruppo Formula
VII
Cl2O
Cl2O3
Cl2O5
Cl2O7
Br2O
Br2O5
Br2O7
I2O
I2O5
I2O7
Nomenclatura IUPAC
Ossido di dicloro
Triossido di dicloro
Pentossido di dicloro
Eptossido di dicloro
Ossido di dibromo
Pentossido di dibromo
Eptossido di dibromo
Ossido di diiodio
Pentossido di diiodio
Eptossido di diiodio
Nomenclatura
tradizionale
Anidride ipoclorosa
Anidride clorosa
Anidride clorica
Anidride perclorica
Anidride ipobromosa
Anidride bromica
Anidride perbromica
Anidride ipoiodosa
Anidride iodica
Anidride periodica
1° 2°
3° 4° 5° 6° 7°
1
H
1s
3
Li
4
Be
5
B
2s
2s2
2s2p
11
Na
12
Mg
13
Al
3s
3s2
3s2p
19
K
20
Ca
21
Sc
4s
4s2
3d,4s2
37
Rb
38
Sr
39
Y
5s
5s2
4d,5s2
22
Ti
23
V
3d2,4s2 3d3,4s2
40
Zr
41
Nb
4d2,5s2 4d3,5s2
24
Cr
3d5,4s
42
Mo
4d5,5s
25
Mn
26
Fe
27
Co
28
Ni
29
Cu
30
Zn
3d5,4s2 3d6,4s2 3d7,4s2 3d8,4s2 3d10,4s 3d10,4s2
43
Tc
44
Ru
45
Rh
46
Pd
47
Ag
48
Cd
4d5,5s2 4d6,5s2 4d7,5s2 4d8,5s2 4d10,5s 4d10,5s2
31
Ga
4s2p
49
In
5s2p
6
C
7
N
8
O
9
F
2s2p2 2s2p3 2s2p4 2s2p5
14
Si
15
P
16
S
17
Cl
3s2p2 3s2p3 3s2p4 3s2p5
32
Ge
33
As
34
Se
35
Br
4s2p2 4s2p3 4s2p4 4s2p5
50
Sn
51
Sb
52
Te
53
I
5s2p2 5s2p3 5s2p4 5s2p5
s
d
p
1
2
3
4
2 e-
s
1
2
3
4
p
3 e-
d
s
1
2
3
4
p
d
1° 2°
3° 4° 5° 6° 7°
1
H
1s
3
Li
4
Be
5
B
2s
2s2
2s2p
11
Na
12
Mg
13
Al
3s
3s2
3s2p
19
K
20
Ca
21
Sc
4s
4s2
3d,4s2
37
Rb
38
Sr
39
Y
5s
5s2
4d,5s2
22
Ti
23
V
3d2,4s2 3d3,4s2
40
Zr
41
Nb
4d2,5s2 4d3,5s2
24
Cr
3d5,4s
42
Mo
4d5,5s
25
Mn
26
Fe
27
Co
28
Ni
29
Cu
30
Zn
3d5,4s2 3d6,4s2 3d7,4s2 3d8,4s2 3d10,4s 3d10,4s2
43
Tc
44
Ru
45
Rh
46
Pd
47
Ag
48
Cd
4d5,5s2 4d6,5s2 4d7,5s2 4d8,5s2 4d10,5s 4d10,5s2
31
Ga
4s2p
49
In
5s2p
6
C
7
N
8
O
9
F
2s2p2 2s2p3 2s2p4 2s2p5
14
Si
15
P
16
S
17
Cl
3s2p2 3s2p3 3s2p4 3s2p5
32
Ge
33
As
34
Se
35
Br
4s2p2 4s2p3 4s2p4 4s2p5
50
Sn
51
Sb
52
Te
53
I
5s2p2 5s2p3 5s2p4 5s2p5
s
d
p
1
2
3
4
e-
s
p
2 e-
s
d
1
1
2
2
3
3
4
4
p
d
I metalli di transizione si combinano con l’ossigeno in proporzioni
diverse e questo determina la formazione di diversi ossidi che
vengono denominati con il suffisso
- ico (numero di ossidazione maggiore)
- oso (numero di ossidazione minore)
Gruppo
Elementi
di
transizione
Formula
Nomenclatura IUPAC
FeO
Fe2O3
Cu2O
CuO
ZnO
Ossido di ferro
Triossido di diferro
Ossido di dirame
Ossido di rame
Ossido di zinco
Nomenclatura
tradizionale
Ossido ferroso
Ossido ferrico
Ossido rameoso
Ossido rameico
Ossido di zinco
PEROSSIDI
I PEROSSIDI sono ossidi in cui l’ossigeno ha carica 1 e presenta
il gruppo molecolare –O-OCaso esemplare il PEROSSIDO DI IDROGENO (ACUQA
OSSIGENATA
SUPEROSSIDI = composti che
derivano dalla combinazione
dello ione metallico con lo ione
superossido
COMPOSTI TERNARI: GLI IDROSSIDI
Gli IDROSSIDI derivano dalla reazione chimica tra un OSSIDO
BASICO ed ACQUA
Na2O + H2O 2NaOH
Si definiscono anche BASI e per questo motivo gli ossidi da cui
derivano si dicono OSSIDI BASICI
Gli IDROSSIDI si riconoscono per la formula bruta che
presenta sempre il gruppo molecolare –OH con carica -1 e
definito OSSIDRILE
Na2O + H2O 2 NaOH
CaO + H2O Ca(OH)2
FeO + H2O Fe(OH)2
Fe2O3 + 3 H2O 2 Fe(OH)3
Al2O3 + 3 H2O 2 Al(OH)3
Idrossido di sodio
Idrossido di calcio
Idrossido di ferro (II)
Idrossido di ferro (III)
Idrossido di alluminio (III)
Si formano per reazione con acqua di un
ossido metallico
Na2O + H2O 2 NaOH
CaO + H2O Ca(OH)2
FeO + H2O Fe(OH)2
Fe2O3 + 3 H2O 2 Fe(OH)3
Al2O3 + 3 H2O 2 Al(OH)3
Idrossido di sodio
Idrossido di calcio
Idrossido di ferro (II)
Idrossido di ferro (III)
Idrossido di alluminio (III)
Poichè in una reazione non si verifica MAI variazione di
massa, il numero di atomi di ciascun tipo dovrà essere lo
stesso in entrambi i membri dell’equazione
STATO (O NUMERO) DI OSSIDAZIONE
Il fatto che alcuni elementi possono formare più composti con
l’ossigeno significa che questi possono metter in gioco un numero
variabile di elettroni di valenza
STATO DI OSSIDAZIONE: è dato dal numero di ossidazione cioè la
carica che ogni atomo di una molecola o di uno ione poliatomico
assumerebbe se attraverso un processo immaginario, rompessimo
tutti i legami covalenti attribuendone gli elettroni all’atomo più
elettronegativo
ESEMPIO: SO2 e SO3 se attribuiamo gli elettroni agli atomi più
elettronegativi ….quindi nel primo composto il numero di ossidazione
dello zolfo è +4 e nel secondo è +6
ALCUNE REGOLE:
- La somma del n.o. in una molecola deve essere uguale a 0
- Nei suoi composti il FLUORO ha sempre n.o. = -1
- L’ossigeno ha sempre n.o. = -2 ad eccezione dei perossidi (n.o. = -1)
e nei composti con il fluoro dove ha n.o. = +2
- L’idrogeno ha sempre n.o. = +1 eccetto quando si combina con
elemento meno elettronegativi (IDRURI)
- Metalli alcalini e alcalino-terrosi sempre n.o. = +1 e +2,
rispettivamente
- Lo stato di ossidazione degli atomi negli elementi è = 0
- Gli stati di ossidazione degli altri elementi si calcolano per
differenza
Nell’eptossido di dicloro l’atomo di cloro
ha numero di ossidazione +7
O
O
+2
+1
+2
O
+2
+1
Cl O Cl
+2
+2
O
O
+2
O
O-H
+1
O
+2
S
+2
+1
O
O-H
Nell’acido solforico lo zolfo ha numero di ossidazione +6
Formazione degli ossiacidi per
reazione degli ossidi con acqua
N2O3 + H2O → 2 HNO2
N2O5 + H2O → 2 HNO3
SO2 + H2O → H2SO3
SO3 + H2O → H2SO4
Cl2O + H2O → 2 HClO
Cl2O3 + H2O → 2 HClO2
Cl2O5 + H2O → 2 HClO3
Cl2O7 + H2O → 2 HClO4
CO2 + H2O → H2CO3
P2O3 + 3 H2O → 2 H3PO3
P2O5 + 3 H2O → 2 H3PO4
Nomenclatura degli acidi
secondo la convenzione IUPAC
Nitrato (III) di idrogeno
Nitrato (V) di idrogeno
Solfato (IV) di diidrogeno
Solfato (VI) di diidrogeno
Clorato (I) di idrogeno
Clorato (III) di idrogeno
Clorato (V) di idrogeno
Clorato (VII) di idrogeno
Carbonato (IV) di diidrogeno
Fosfato (III) di triidrogeno
Fosfato (V) di triidrogeno
Nomenclatura
tradizionale degli acidi
Acido nitroso
Acido nitrico
Acido solforoso
Acido solforico
Acido ipocloroso
Acido cloroso
Acido clorico
Acido perclorico
Acido carbonico
Acido fosforoso
Acido fosforico
DERIVANO DALLA REAZIONE TRA OSSIDI COVALENTI
(ANIDRIDI) ED ACQUA
PARTICOLARE IMPORTANZA DA UN PUNTO DI VISTA
BIOLOGICO ASSUMONO GLI OSSIACIDI DEL FOSFORO:
P2O5 + 3 H2O → 2 H3PO4 acido ortofosforico
P2O5 + 2 H2O → H4P2O7 acido pirofosforico
P2O5 + H2O → 2 HPO3
acido metafosforico
ESEMPI:
H2SO4
O = -2X4 = -8
H =+1X2 = +2
TOTALE = -6 per cui lo S avrà n.o. =-6
PO43O = -2X4 = -8
P =+5X1 = +5
TOTALE = -3
N2O5
O = -2X5 = -10
N =+5X2 = +10
2 HNO3 + Ca(OH)2 → Ca(NO3)2 + 2 H2O
O
OHCa++
OH-
H-O-N
O
O
H-O-N
O
I SALI SONO COMPOSTI IN CUI I CATIONI DEI METALLI FORMANO
LEGAMI IONICI CON GLI ANIONI DEGLI ACIDI
SALI
In sostanza i Sali derivano da reazioni in cui i composti dei METALLI
(ossidi, idrossidi) reagiscono con composti dei NON-METALLI
(anidridi, acidi)
H3PO4 + 2 NaOH → Na2HPO4 + 2 H2O
H3PO4 + NaOH → NaH2PO4 + H2O
OH
O
P
OH
H-O Na
OH
H-O Na
H-O Na
SALI
OSSIDO + ANIDRIDE = Ossido di calcio + Diossido di carbonio =
CARBONATO DI CALCIO
CaO + CO2 → CaCO3
Il nome del sale deriva dagli ioni coinvolti nella sua composizione:
Ca2+ e CO32OSSIDO + ACIDO= Triossido di dialluminio + Acido solforico =
TRISSOLFATO (IV) DI DIALLUMINIO = SOLFATO DI ALLUMINIO
Al2O3 + 3 H2SO4 → Al2(SO4)3 + 3H2O
SALI
IDROSSIDO + ANIDRIDE = Idrossido di magnesio + Triossido di
difosforo = BISFOSFATO DI TRIMAGNESIO FOSFATO DI MAGNESIO
3 Mg(OH)2 + P2O5 → Mg3(PO4)2 + 3H2O
IDROSSIDO + ACIDO=
Triossido di ferro + Acido nitrico =
TRISNITRATO (V) DI FERRO = NITRATO DI CALCIO
Fe(OH)3 + 3 HNO3 → Fe(NO3)3 + 3H2O
Sale
Na2SO4
Na2SO3
Al(NO2)3
Ca(NO3)2
Ca3(PO4)2
CaHPO4
Ca(H2PO4)2
Na2S
NaHS
NaCl
AlCl3
Nomenclatura convenzionale
Solfato (VI) di disodio
Solfato (IV) di sodio
Trisnitrato (III) di alluminio
Bisnitrato (V) di calcio
Bisfosfato(V) di tricalcio
Idrogenofosfato (V) di calcio
Nomenclatura tradizionale
Solfato di sodio
Solfito di sodio
Nitrito di alluminio
Nitrato di calcio
Fosfato di calcio
Monoidrogenofosfato di
calcio
Bisdiidrogenofosfato(V) di calcio Diidrogenofosfato di calcio
Solfuro di disodio
Solfuro di sodio
Idrogenosolfuro di sodio
Idrogenosolfuro di sodio
Cloruro di sodio
Cloruro di sodio
Tricloruro di alluminio
Cloruro di alluminio
OSSIDO-RIDUZIONI
Le ossido-riduzioni sono semplicemente reazioni
in cui si ha perdita o acquisto di elettroni da parte
di una specie chimica
Supponendo per il legame covalente polare che,
invece di trasferimenti di frazioni di carica
dell’elettrone, si realizzino trasferimenti totali di
elettroni dall’elemento meno elettronegativo a
quello più elettronegativo, si vengono a
determinare cariche nette per gli atomi chiamate
NUMERI DI OSSIDAZIONE
In pratica il NUMERO DI OSSIDAZIONE di un
atomo in un legame covalente polare è la carica
che quell’atomo possiederebbe se il legame
chimico fosse ionico
Sebbene si possono usare le formule di Lewis e le
tabelle di elettronegatività vi sono delle regole
che possono facilitare notevolmente nelle
reazioni ossido-riduttive
1) Il numero ossidazione di un elemento nella sua
forma elementare è uguale a 0
2) Il numero di ossidazione di uno ione
monoatomico è pari alla sua carica
3) Nei composti binari, all’elemento di maggiore
elettronegatività si assegna un numero di
ossidazione negativo pari alla sua carica in
composti ionici semplici dell’elemento
4) La somma dei numeri di ossidazione deve
essere zero per tutti i composti neutrali e pari alla
carica globale per le specie ioniche
5) l’idrogeno ha numero di ossidazione +1
quando è legato con un elemento più
elettronegativo (la maggior parte dei non metalli)
e numero di ossidazione pari a -1 quando è legato
ad elementi meno elettronegativi ( la maggior
parte dei metalli)
6) l’ossigeno ha quasi sempre numero di
ossidazione pari a -2 ad eccezione che in
composti chiamati perossidi molecolari e nello
ione perossido dove ha numero di ossidazione
uguale a -1
Gruppo Elementi
n.o.
------------------------------------------------------------------1
Li, Na, K
+1
2
Be, Mg, Ca, Sr, Ba
+2
3
B, Al
+3
4
C, Si
+4
5
N, P, As, Sb
-3, +3, +5
Bi
+3
6
O
-2, -1
S
-2, +4,+6
Gruppo Elementi
n.o.
------------------------------------------------------------------7
F
-1
Cl
-1, +1, +3,+5,+7
Br
-1,+1,+5
I
-1,+1,+5,+7
Elementi Cr
+2,+3,+6
di
Mn
+2,+3,+4,+6,+7
Transizione Fe, Co, Ni
+2, +3
Pt
+2,+4
Cu, Hg
+1,+2
Ag
+1
Au
+1,+3
Zn, Cd
+2