Chimica Generale e Inorganica
Regole nomenclatura chimica
Dr. Simonetta Tuti
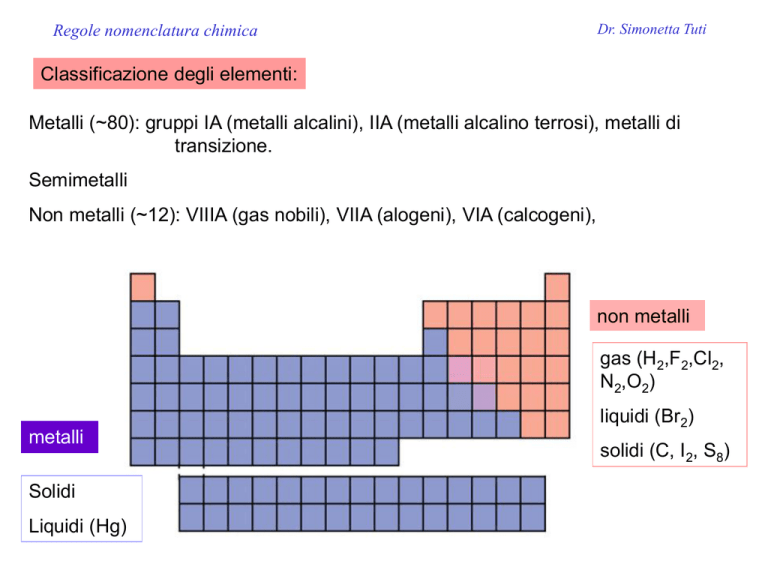
Classificazione degli elementi:
Metalli (~80): gruppi IA (metalli alcalini), IIA (metalli alcalino terrosi), metalli di
transizione.
Semimetalli
Non metalli (~12): VIIIA (gas nobili), VIIA (alogeni), VIA (calcogeni),
non metalli
gas (H2,F2,Cl2,
N2,O2)
metalli
Solidi
Liquidi (Hg)
liquidi (Br2)
solidi (C, I2, S8)
Chimica Generale e Inorganica
Dr. Simonetta Tuti
Regole nomenclatura chimica
Regole generali per la formulazione corretta dei composti:
1. Se il composto è formato da un metallo e un non-metallo, il simbolo del
metallo precede quello del non-metallo.
2. Se entrambi gli elementi sono non-metalli, quello meno elettronegativo
precede quello più elettronegativo (con qualche eccezione: NH3)
3. I composti sono elettricamente neutri
4. Il numero di atomi necessari si scrive come pedice al simbolo
5. Deve essere usato il numero di atomi più piccolo
Combinazioni possibili per
un composto binario:
Metallo – (Non-Metallo)
(Non-Metallo) – (Non-Metallo)
Metallo – Metallo
KCl
H2S
NaH
NO
MgO
CO
Fe2O3
OF2
Chimica Generale e Inorganica
Dr. Simonetta Tuti
Regole nomenclatura chimica
Numero di ossidazione degli elementi nei loro composti:
• è un numero positivo o negativo che indica il n° di elettroni acquistati o ceduti
da un atomo
• in un composto ionico corrisponde ad un reale acquisto o cessione di elettroni
• in un composto covalente, gli elettroni di legame vengono considerati come
acquisiti dall’atomo più elettronegativo.
• In un composto elemento più elettronegativo ha n° di ossidazione negativo, il
meno elettronegativo ha n° di ossidazione positivo.
La somma algebrica dei n° di
ossidazione di tutti gli atomi di un
composto è:
zero se il composto è neutro
uguale alla carica elettrica del composto se
questo è uno ione.
Chimica Generale e Inorganica
Regole nomenclatura chimica
Dr. Simonetta Tuti
Regole per determinare il n° di ossidazione
Na, Xe, H2, O2, Cl2,
S8…
= 0 per tutti gli elementi i cui atomi non sono combinati o
sono combinati con atomi uguali
IG: Li, Na, K, Rb, Cs
sempre +1
IIG: (Be, Mg, Ca, Sr,
Ba, Ra) + Cd, Zn
sempre +2
B, Al
sempre +3
F
sempre -1, (F2 = 0)
H
+1 in tutti i composti tranne gli idruri metallici
-1 negli idruri metallici (MeH)
O
-2 in tutti gli ossidi e derivati
-1 nei perossidi (O2)2- GRUPPO: (-O-O-)2-0.5 nei superossidi: ossidi MeO2 con ione (O2)-,
+2 in OF2
Tutti gli altri elementi presentano n° di ossidazione variabili tra un valore massimo
positivo uguale al numero N del gruppo e un valore minimo negativo uguale a N-8.
Es: Cl (A VII) (n.o. -1, +1, +3, +4, +5, +7)
Chimica Generale e Inorganica
Regole nomenclatura chimica
Dr. Simonetta Tuti
Elemento
Metallo
Simbolo (una o due lettere) eventualmente seguito dallo stato
di aggregazione: Li (s), Hg (l)
Semimetallo
Non metallo
IUPAC: nome
preceduto da un
prefisso che indica il
n° di atomi:
mono, di, tri, tetra,
penta, esa, epta, otta,
deca…
Può presentarsi sotto forma di molecola poliatomica: un
pedice alla destra del simbolo indica il n° di atomi costituenti
la molecola: H2, O2, S8.
Chimica Generale e Inorganica
Regole nomenclatura chimica
Dr. Simonetta Tuti
1) Nomenclatura tradizionale
2) Nomenclatura IUPAC (International Union of Pure and Applied Chemistry)
Classi di composti:
Ossidi
Idruri
Acidi (idracidi, ossiacidi)
Idrossidi
Sali
Chimica Generale e Inorganica
Dr. Simonetta Tuti
Regole nomenclatura chimica
Regola generale per la nomenclatura di un composto:
nome dell’anione + di + nome del catione
Catione monoatomico
Anione monoatomico
nome dell’elemento
Suffisso -URO
catione
anione
Catione poliatomico
Anione poliatomico
Suffisso -ONIO
Suffisso - ATO, ITO (tradiz)
- ATO (IUPAC)
Chimica Generale e Inorganica
Regole nomenclatura chimica
Dr. Simonetta Tuti
Cationi monoatomici
Se sono possibili due stati di ossidazione:
IUPAC: nome di Stock
Tradizionale: suffisso-oso/ico
Gli elementi dei gruppi I, II, presentano un solo stato di ossidazione positivo
Tutti gli altri elementi possono presentare più di uno stato di ossidazione
positivo.
Chimica Generale e Inorganica
Regole nomenclatura chimica
Dr. Simonetta Tuti
Cationi poliatomici:
(idruro di non metallo) + H+
NH3 + H+
PH3 +
H+
Ione + nome elemento + onio
NH4+ ione ammonio
PH4+ ione fosfonio
H2O + H+
H3O+ ione idrossonio
H2S + H+
H3S+ ione solfonio
Chimica Generale e Inorganica
Dr. Simonetta Tuti
Regole nomenclatura chimica
Anioni monoatomici: suffisso URO
Solo pochi elementi (non metalli) presentano numeri di ossidazione negativi!
Lo stato di ossidazione negativo è uno solo!
I
II
III
IV
X4+
V
X3-
VI
X2-
VII
X-
C4-
N3-
O2-
F-
carburo
nitruro
ossido
fluoruro
Si4-
P3-
S2-
Cl-
siliciuro
fosfuro
solfuro
cloruro
As3-
Se2-
Br-
arsen(i)uro
selen(i)uro(*)
bromuro
Sb3-
Te2-
I-
antimoniuro
tellur(i)uro
ioduro
(*) si trovano entrambe le forme: selenuro e seleniuro
Chimica Generale e Inorganica
Dr. Simonetta Tuti
Regole nomenclatura chimica
Sali binari
AxBy
Tradizionale: se sono possibili due stati di ossidazione suffissi -oso/ico
IUPAC: si esplicita il n° di atomi come prefissi
Nome tradizionale
Nome IUPAC
NaCl
cloruro di sodio
cloruro di sodio
GaCl3
cloruro di gallio
tricloruro di gallio
PbI2
ioduro di piombo
diioduro di piombo
FeCl3
cloruro ferrico
tricloruro di ferro
FeCl2
cloruro ferroso
dicloruro di ferro
Hg2Cl2
cloruro mercuroso
dicloruro di dimercurio
HgCl2
Cloruro mercurico
dicloruro di mercurio
Chimica Generale e Inorganica
Dr. Simonetta Tuti
Regole nomenclatura chimica
Idracidi
n° ossidazione idrogeno = + 1
IUPAC: anione–uro di catione
Nome tradizionale: acido + elemento + idrico
Chimica Generale e Inorganica
Dr. Simonetta Tuti
Regole nomenclatura chimica
i composti con l’idrogeno: IDRURI e idracidi
n.o. -1, +1, dipende dalla
n.o.(H) -1 idruri
elettronegatività
n.o.(H) +1 idracidi
I
II
III
IV
V
VI
VII
LiH
BeH2
B2H6(-1)
CH4 (+1)
NH3 (+1)
H2O
HF
NaH
MgH2
AlH3(-1)
SiH4(-1)
PH3 (+1)
H2S
HCl
KH
CaH2
AsH3(+1)
H2Se
HBr
SrH2
SbH3(-1)
HI
BaH2
elettronegatività
attenzione: alcuni composti del IV, V G sono scritti tradizionalmente nell’ordine
inverso rispetto all’elettronegatività
Chimica Generale e Inorganica
Dr. Simonetta Tuti
Regole nomenclatura chimica
AxOy
Ossidi
IUPAC: ossido + di (nome del catione) si esplicita il n° di atomi come prefissi
Al2O3 tri-ossido di di-alluminio
Nomenclatura di Stock :
Nome tradizionale:
CuO ossido di rame(II), Cu2O ossido di rame(I)
O2- ione ossido
ossido di…
O22- ione perossido
perossido di..
O2- ione superossido
superossido di…
“anidride” per gli ossidi dei non metalli e dei metalli con n° di ossidazione >4
per 2 stati di ossidazione del catione: suffissi oso/ ico.
Chimica Generale e Inorganica
Regole nomenclatura chimica
Dr. Simonetta Tuti
Ossidi dei metalli (ossidi basici e ossidi anfoteri)
Chimica Generale e Inorganica
Regole nomenclatura chimica
Ossidi dei non-metalli (ossidi acidi)
Nome da
abbandonare!
VIIG: 4 numeri di
ossidazione
(+1, +3, +5, +7):
ipo------oso
-------oso
-------ico
per------ico
Dr. Simonetta Tuti
Regole nomenclatura chimica
I (+1)
II (+2)
Chimica Generale e Inorganica
Tavola degli Ossidi
III (+3)
IV (+2, 4)
Dr. Simonetta Tuti
V (+3, 5)
VI (+4, 6)
VII(+1,3,5,7)
SO2
SO3
Cl2O
Cl2O3
Cl2O5
Cl2O7
(+1,+2,+4)
Li2O
Na2O
BeO
B 2O 3
CO
CO2
(Na2O2)
(NaO2)
MgO
K2O
CaO
Rb2O
SrO
SnO2
(SnO)
Cs2O
BaO
PbO2
(PbO)
(KO2)
Al2O3
SiO2
N2O
NO
N2O3
NO2
N2O5
P2O3
P2O5
As2O3
As2O5
ossidi basici (rosso), anfoteri (verde), acidi (blu)
Br2O7
I2O5
I2O7
Chimica Generale e Inorganica
Dr. Simonetta Tuti
Regole nomenclatura chimica
OSSIDO di metallo + H2O IDROSSIDO (base)
Na2O + H2O 2 NaOH
CuO + H2O Cu(OH)2
OSSIDO di non metallo
idrossido di sodio
idrossido rameico
+ H 2O
o
OSSIACIDO
CO2 + H2O H2CO3
acido carbonico
N2O5 + H2O 2 HNO3
acido nitrico
OSSIDO ANFOTERO comportamento al
variare delle condizioni di reazione
+3
Al2O3 + H2O
idrossido di rame(II)
H3AlO3
acido alluminico
Al(OH)3
idrossido di Al
ATTENZIONE: non è
questo il metodo per
scrivere gli ossiacidi !!!!
In molti casi occorre
aggiungere più di una
molecola d’acqua!!!
Gli ossiacidi vanno
imparati gruppo per
gruppo !!!!!!
III
IV
Regole nomenclatura(+4)
chimica
(+3)
H3BO3
Ac. borico
H2CO3
Ac. carbonico
V
(+5,+3,+1)
HNO3
Ac. nitrico
HNO2
Ac. nitroso
H3PO4
H4SiO4
Ac. silicico
Ac. fosforico
HClO4
H2SO4
Ac. perlorico
HClO3
H3PO3
Ac. solforico
Ac. clorico
H3PO2
Ac. solforoso
Ac. cloroso
Ac. fosforoso
Ac. ipofosforoso
Ossiacidi:
occorre
memorizzare gli
ossiacidi gruppo
x gruppo!!!
VI
VII
Chimica
Generale e Inorganica
Dr. Simonetta
Tuti
(+6,+4)
(+7,+5,+3,+1)
H2SO3
HClO2
HClO
Ac. ipocloroso
H3AsO4
HBrO4
HBrO3
HBrO2
HBrO
Ac. arsenico
H3AsO3
Ac. arsenioso
H3AsO2
Ac. ipoarsenioso
Ac. periodico
Ac. iodico
Ac. iodoso
Ac. ipoiodoso
HIO4
HIO3
HIO2
HIO
Chimica Generale e Inorganica
Regole nomenclatura chimica
Idrossidi
Dr. Simonetta Tuti
Chimica Generale e Inorganica
Dr. Simonetta Tuti
Regole nomenclatura chimica
Anioni poliatomici: derivano dall’ossiacido corrispondente
Nomenclatura
tradizionale
(molto usata)
Ione + nome elemento + suffisso ato/ito
Acido -ico
ione -ato
Acido -oso
ione -ito
acido solforico H2SO4 2 H+ + SO42- ione solfato
acido carbonico H2CO3 2 H+ + CO32- ione carbonato
acido periodico HIO4 H+ + IO4- ione periodato
acido solforoso H2SO3 2 H+ + SO32- ione solfito
acido ipocloroso HClO H+ + ClO- ione ipoclorito
SO42- ione tetraossisolfato
IUPAC: esplicita il n° di atomi + suffisso -ato
CO32- ione triossicarbonato
NO3- ione triossinitrato
ClO2- ione diossiclorato
Chimica Generale e Inorganica
Regole nomenclatura chimica
Dr. Simonetta Tuti
Chimica Generale e Inorganica
Dr. Simonetta Tuti
Regole nomenclatura chimica
OSSIANIONI di alcuni metalli di transizione
Cromato
Dicromato
CrO42
Cr2O72
(n.o. = +6)
(+6)
Manganato
Permanganato
MnO42MnO4
(+6)
(+7)
Metavanadato
Ortovanadato
VO3VO43-
(+5)
(+5)
Molibdato
MoO42-
(+6)
Chimica Generale e Inorganica
Dr. Simonetta Tuti
Regole nomenclatura chimica
Prefissi Orto e Meta: – Per eliminazione di una molecola di acqua dall’acidoorto si ottiene l’acido –meta. (Acidi dello stesso elemento con stesso n.o. ma
diverso contenuto di molecole di acqua):
+3
+3
acido orto-borico H3BO3 – H2O acido meta-borico HBO2
acido orto-fosforoso H3PO3 – H2O acido meta-fosforoso HPO2
acido orto-fosforico H3PO4 - H2O acido meta-fosforico HPO3
Prefissi Di o Piro-: due molecole di un Orto-acido si uniscono con
eliminazione
di una molecola d’acqua
+5
2 H3PO4 H2O + H4P2O7 acido piro-fosforico o di-fosforico
2 H2SO4 H2O + H2S2O7 acido piro-solforico o di-solforico
Perossiacidi: un atomo O è sostituito dal gruppo (-O-O-)
H2SO5 acido perosso-solforico
H2S2O8 acido perossi-disolforico
Tioacidi: un atomo O è sostituito da un atomo di S:
H2S2O3 acido tio-solforico
H2PO3S
acido tio-fosforico
Chimica Generale e Inorganica
Dr. Simonetta Tuti
Regole nomenclatura chimica
ANIONI degli Acidi POLIPROTICI
Alcuni acidi possono liberare più di uno ione H+ e quindi dare ossianioni
con diverso numero di H residui: nomenclatura comunemente usata
Ac. Solfidrico H2S
H+
+
HS-
ione idrogenosolfuro o bisolfuro
HS-
H+
+
S2-
ione solfuro
Ac. Solforico H2SO4
HSO4Ac. Fosforico
H+
H+
H3PO4 H+
H2PO4
H+
HPO42 H+
+
+
HSO4-
SO42-
ione idrogenosolfato o bisolfato
ione solfato
Ione diidrogeno fosfato
+
H2PO4
+
HPO42 Ione monoidrogeno fosfato
+
PO43
Ione fosfato
Chimica Generale e Inorganica
Dr. Simonetta Tuti
Regole nomenclatura chimica
Sali acidi: per parziale sostituzione degli H di un acido poliprotico
Altra nomenclatura tradizionale
Sali basici: per parziale sostituzione dei gruppi OH di un idrossido
Chimica Generale e Inorganica
Regole nomenclatura chimica
Sali ternari e quaternari
Dr. Simonetta Tuti
Chimica Generale e Inorganica
Regole nomenclatura chimica
Dr. Simonetta Tuti
Sali multipli: sali formati da più di un anione o più di un catione
Se contengono più di un catione si usa: doppio, triplo, ecc..
Se contengono più di un anione si usano i prefissi: di, tri, ecc..
Sali idrati: la molecola di sale è accompagnata da un certo numero di molecole
d’acqua.