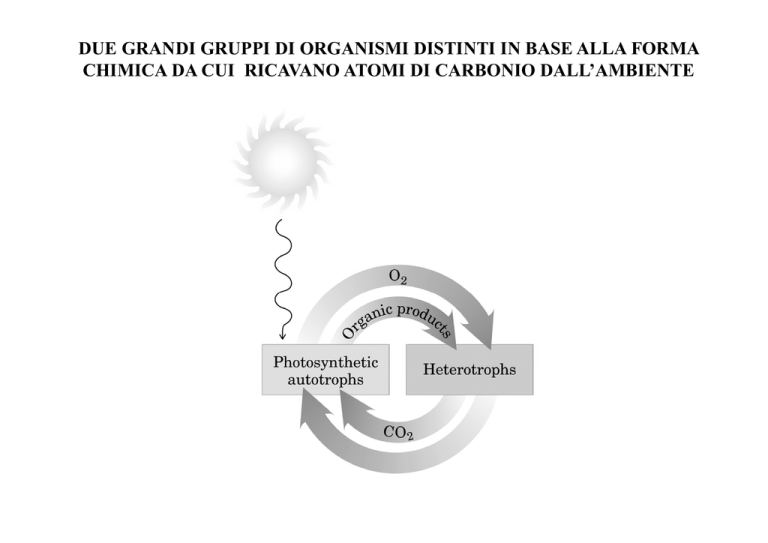
DUE GRANDI GRUPPI DI ORGANISMI DISTINTI IN BASE ALLA FORMA
CHIMICA DA CUI RICAVANO ATOMI DI CARBONIO DALL’AMBIENTE
TRE STADI DI COMPLESSITÀ DELLE VIE METABOLICHE
Il
metabolismo
intermedio
si
riferisce innanzitutto alla biosintesi,
all’utilizzo e alla degradazione dei
composti
a
a
basso
peso
molecolare.
Il
metabolismo
energetico è invece quella parte del
metabolismo
intermedio
che
consiste nell’insieme di quelle vie
che immagazzinano e generano
energia metabolica.
VIE METABOLICHE PRINCIPALI E INTERMEDI CHIAVE
VIE METABOLICHE CENTRALI: LA GLICOLISI
IL METABOLISMO OSSIDATIVO.
Negli organismi aerobici
tutte le vie metaboliche
convergono nel ciclo
dell’acido citrico.
IL METABOLISMO DEI LIPIDI E DEGLI STEROIDI
IL METABOLISMO DEGLI AMMINOACIDI
L’ANABOLISMO DEI CARBOIDRATI: LA GLUCONEOGENESI E
LA SINTESI DEI POLISACCARIDI
Le
1)
2)
vie degradative e quelle
biosintetiche sono distinte
per due motivi:
una
via
può
essere
esoergonica in una sola
direzione;
Le
vie
devono
essere
regolate separatamente per
evitare cicli futili.
LA FOTOSINTESI
IL COENZIMA A
Coenzima A
(CoA)
Vitamina B3
NICOTINAMIDE ADENIN DINUCLEOTIDE (NAD+)
IONE IDRURO
:H
-
Anello
nicotinamidico
deriva dalla
vitamina
niacina
FLAVIN ADENIN DINUCLEOTIDE (FAD)
FLAVIN MONONUCLEOTIDE (FMN)
RIBOFLAVINA
Vitamina B2
I NUCLEOTIDI DELLA NICOTINAMIDE NEL CATABOLISMO E NELLE
BIOSINTESI
Gli enzimi che ossidano i substrati (le deidrogenasi) di norma impiegano il
NAD+, mentre quelli che riducono i substrati (le riduttasi) di solito utilizzano il
NADPH. Un’eccezione è rappresentata da due deidrogenasi della via dei
pentosi fosfati che convertono il NADP+ in NADPH e costituiscono la via
principale per la sintesi di nucleotidi ridotti.
almeno una tappa catalizzata da enzimi diversi
soggetti a regolazione
[S]
REGOLAZIONE
ALLOSTERICA
fattori di crescita ormoni che
agiscono all’esterno della cellula
CONCENTRAZIONE
ENZIMATICA
Almeno una
reazione
termodinamicamente favorita
REGOLAZIONE
COVALENTE
Controllo della regolazione a livello del substrato
Più alta è la concentrazione di substrato e più rapidamente avviene al
reazione enzimatica (fino alla saturazione dell’enzima), al contrario, alte
concentrazioni di prodotto tendono a inibire la trasformazione del
substrato, in questo caso il prodotto può agire da inibitore competitivo.
Esochinasi
Glucosio + ATP
glucosio-6-P + ADP
Tuttavia il controllo a livello del substrato non è sufficiente per la
regolazione di molte vie metaboliche, in altre situazioni è indispensabile
che l’enzima sia regolato da alcune sostanze completamente diverse dal
substrato o dal proprio prodotto.
Gli Enzimi Regolatori
In ogni via metabolica, in cui vi sia una sequenza di reazioni catalizzate da
diversi enzimi (il prodotto del primo enzima diventa il substrato della
seconda), vi è almeno un enzima che influenza in modo determinante la
velocità complessiva in quanto catalizza la reazione più lenta.
A
Enzima 1
regolazione
Enzima 2
B
Enzima 3
C
Enzima 4
D
E
Inoltre, in generale, il primo enzima della sequenza metabolica è un
enzima regolatore, in questo modo si evita di sottrarre metaboliti e
energia ad altre sequenze di reazioni importanti.
In realtà tutti gli enzimi di una via metabolica contribuiscono alla
regolazione del flusso della via stessa, ogni enzima presenta un
coefficiente di regolazione del flusso che può variare da zero a uno.
Regolazione a feedback
La cellula può controllare la formazione del prodotto finale tramite
attivazione o inibizione di un passaggio della via metabolica. Il sistema
più efficiente è quello di agire sul primo passaggio.
Enzima 1
A
Enzima 2
B
Enzima 3
C
Enzima 4
D
E
La trasformazioni di A in B viene quindi controllata da E: questo processo
è chiamato feedback o, più precisamente feedback negativo in quanto un
aumento della concentrazione di E ha come conseguenza una diminuzione
della sua velocità di formazione.
MODIFICAZIONI COVALENTI CHE CONTROLLANO L’ATTIVITÀ DEGLI
ENZIMI
LA VIA DI TRASDUZIONE DEL SEGNALE CHE COINVOLGE
L’ADENILATO CICLASI
LOCALIZZAZIONE INTRACELLULARE DELLE PRINCIPALI
VIE METABOLICHE
citomatrice
L’USO DELLE MUTAZIONI COME SONDE BIOCHIMICHE
Grazie alla loro capacità di inattivare singoli enzimi, le mutazioni e gli inibitori
enzimatici aiutano ad identificare il ruolo metabolico degli enzimi stessi.
BIOENERGETICA
Analisi quantitativa delle modalità con cui gli organismi ottengono
ed utilizzano energia : ramo particolare della TERMODINAMICA
SISTEMA. Parte dell’Universo che vogliamo studiare, deve avere
dei confini ben definiti.
ISOLATO : non scambia né energia né materia con l’ambiente
CHIUSO: può scambiare solo
energia ma non materia.
APERTO : può scambiare sia
energia che materia.
Ogni SISTEMA contiene una certa quantità di ENERGIA INTERNA (E)
“ENERGIA IN TRANSITO” tra SISTEMA e AMBIENTE
CALORE = q
LAVORO = w
CALORE (q)
POSITIVO Il sistema assorbe calore dall’ambiente
NEGATIVO Il calore fluisce dal sistema all’ambiente
LAVORO (w)
POSITIVO Il sistema compie lavoro sull’ambiente
NEGATIVO L’ambiente compie lavoro sul sistema
Poiché l’ENERGIA INTERNA può variare solo per scambi di
calore o di lavoro sarà:
E = q - w
PRIMO PRINCIPIO DELLA TERMODINAMICA
PRINCIPIO DI CONSERVAZIONE DELL’ENERGIA
SCAMBIO DI CALORE E LAVORO NELLE REAZIONI A
VOLUME E PRESSIONI COSTANTI
CH3(CH2)14COOH (sol) + 23O2(gas)
16CO2(gas) + 16H2O(liq)
La reazione avviene in un contenitore sigillato, o “bomba” calorimetrica. Il calore
q viene trasferito all’acqua circostante.
Non viene compiuto lavoro perché il sistema è a volume costante
Fig. a
E = q
E = -9941,4 kJ/mol
la reazione rilascia ENERGIA conservata nei legami che viene
trasferita dal SISTEMA sotto forma di calore all’AMBIENTE
Fig. b Il Volume si decontrae di una quantità proporzionale
al decremento di moli di gas. Un certo LAVORO è stato
compiuto dall’AMBIENTE al SISTEMA
w = PV
PV = n RT
V = n (RT/ P)
w = n RT
n = variazione del numero di moli
di gas per mole di acido palmitico
R = costante dei gas 8.314 J/(mol K)
w = -17.3 kJ/mol palmitato
Il calore sviluppato in questa combustione a pressione costante sarà:
q = E + w
q = E + n RT = -9941,4 - 17,3 = -9958 kJ/mol
IN CONDIZIONI DI PRESSIONE COSTANTE L’AMBIENTE COMPIE
LAVORO (PV) SUL SISTEMA, QUESTO LAVORO COMPORTA CHE LA
QUANTITA’ DI CALORE RILASCIATA DAL SISTEMA ALL’AMBIENTE SIA
LEGGERMENTE MAGGIORE RISPETTO ALLA CONDIZIONE DI VOLUME
COSTANTE
I cambiamenti dell’ENERGIA INTERNA, come per tutte le
FUNZIONI DI STATO, dipendono solo dallo stato finale ed
iniziale del SISTEMA e sono indipendenti dal cammino fatto
Attenzione 1 cal = 4.184 J
ENTALPIA
La maggior parte delle reazioni che avvengono in laboratorio e
praticamente tutti i processi biochimici hanno luogo in condizioni più
vicine a quelle di pressione costante che di volume costante.
Per esprimere il calore di una reazione a P costante ci occorre
un’altra FUNZIONE DI STATO : ENTALPIA (H)
H = E + PV
H = E + P V
H può essere considerata la misura diretta della variazione
di ENERGIA di un processo
SECONDO PRINCIPIO DELLA TERMODINAMICA
In tutti i processi naturali l’entropia tende ad aumentare
A+B
C+D
Qual è la direzione favorita in un processo?
I processi sono favoriti (cioè spontanei) , e IRREVERSIBILI,
quando si trovano lontani dall’equilibrio e si spostano
successivamente verso uno stato di equilibrio.
Il secondo principio della termodinamica ci dice quali processi
siano termodinamicamente favoriti
I processi tendono sempre ad un più basso stato di energia
I SISTEMI DI MOLECOLE TENDONO
NATURALMEMNTE AL DISORDINE
ENTROPIA
ENTROPIA
Un dato stato termodinamico può avere molti sottostati di
UGUALE ENERGIA. “esistono diversi modi in cui le molecole
possono essere distribuite all’interno di un sistema”
ENTROPIA (S)
misura del grado di disordine
S = k ln W
W = sottostati di uguale energia
k costante di Boltzman = R/N° numero di Avogadro
Uno stato ordinato ha meno modi di disporre le molecole di uno
stato disordinato.
S stato ordinato < S stato disordinato
S = 0 CRISTALLO PERFETTO allo zero assoluto (0 °K = –273°C)
Secondo principio della termodinamica: l’entropia di un sistema
isolato tende ad aumentare fino ad un valore massimo.
Sebbene l’energia del sistema rimanga invariata l’entropia
può aumentare, sono entrambe forze che determinano la
direzione del processo termodinamico.
ENERGIA LIBERA
Tutti i sistemi biologici sono sistemi aperti, occorre a questo punto
una funzione di stato che comprenda sia l’energia che l’entropia:
Sistemi a
PeT
costante
G = H - TS
ENERGIA LIBERA DI GIBBS
G = H - TS
TRASFORMAZIONE FAVORITA
Trasformazione esoergonica
G negativo
TRASFORMAZIONE SFAVORITA
G positivo
Trasformazione endoergonica
G = 0
H = T S
SISTEMA ALL’EQUILIBRIO
Né il H né il S da soli ci possono dire quello che succederà, ma
la loro combinazione H -T S, prevede esattamente quale fase sia
stabile ad ogni temperatura
INTERAZIONI TRA
ENTALPIA ED ENTROPIA
IN OGNI TRASFORMAZIONE
FISICA E CHIMICA E’ LA
COMPETIZIONE
TRA
IL
TERMINE
ENTALPICO
E
QUELLO
ENTROPICO
CHE
DETERMINA LA DIREZIONE
FAVORITA
UNA REAZIONE FAVORITA NON VUOL DIRE PIU’ VELOCE
Cdiamante
Cgrafite
G = -288 kJ/mol
ENTROPIA DI UN SISTEMA APERTO PUO’ DIMINUIRE
La diminuzione di entropia avviene in ogni momento in un organismo
vivente. Occorre spendere energia per pagare il prezzo dell’organizzazione.
LA VARIAZIONE COMPLESSIVA DI ENERGIA LIBERA IN UN
ORGANISMO DEVE ESSERE NEGATIVA
La vita è un processo irreversibile un organismo che arriva all’equilibrio
con il suo ambiente è morto
GLI ORGANISMI NON SONO MAI IN EQUILIBRIO CON IL LORO
AMBIENTE
sistema aperto
UN ORGANISMO CHE ARRIVA ALL’EQUILIBRIO
CON IL SUO AMBIENTE è MORTO.
Solo attraverso un continuo dispendio energetico gli organismi possono
mantenere la diversa costituzione e concentrazione rispetto all’ambiente
LA COMPOSIZIONE MOLECOLARE RIFLETTE UNO
STATO STAZIONARIO DINAMICO
LA COSTANZA DELLA CONCENTRAZIONE NON RIFLETTE UN’INERZIA
DEI COMPONENTI DEL SISTEMA, MA PIUTTOSTO E’ IL RISULTATO DI
UNO STATO STAZIONARIO DINAMICO
Tutti gli organismi viventi creano
e conservano le loro strutture
utilizzando l’energia estratta dai
combustibili chimici o dalla luce
In ogni modificazione chimica
o fisica, la quantità totale di
energia
dell’UNIVERSO
rimane costante, anche se la
forma
di
energia
può
cambiare
I° principio
della termodinamica
Le cellule sono motori chimici
che operano a temperatura e
pressione costante
ENERGIA LIBERA E LAVORO UTILE
G = H - TS
L’energia libera rappresenta la porzione di energia (H) che risulta
disponibile, o libera, per svolgere lavoro utile. Una parte del H è sempre
dissipato sottoforma di calore, come è espresso dal termine TS. La
quantità effettiva utilizzata per svolgere lavoro dipenderà dalla VIA
SEGUITA DAL PROCESSO.
La variazione di energia libera è una misura del lavoro utile
massimo ottenibile dalle reazioni.
ENERGIA LIBERA E CONCENTRAZIONE
In che modo l’energia libera dipende dalle quantità dei vari componenti
aA +bB +cC……….
G = aGA + bGB + cGC……….. Energie libere molari parziali o
POTENZIALI CHIMICI
GA = GoA + RT ln [A]
Contributo per moli di sostanza
ENERGIA CHIMICA ED EQUILIBRIO CHIMICO
aA +bB
cC +dD
G = G (prodotti) – G (reagenti)
G = Go + RT ln
All’equilibrio
[C]c [D]d
[A]a[B]b
[C]c [D]d
=K
a
b
[A] [B]
G = 0
0 = Go + RT ln K
Che può essere scritta
Go
K = e RT
RELAZIONE TRA IL Go E LA COSTANTE DI EQUILIBRIO
Quando il sistema non è all’equilibrio, la tendenza a spostarsi verso l’equilibrio diventa
una forza trainante la cui ampiezza è espressa dalla variazione di G.
La variazione di ENERGIA
LIBERA STANDARD di una
reazione chimica è
semplicemente un modo
matematico alternativo di
esprimere la sua costante di
equilibrio.
Relazione tra le costanti di equilibrio
delle reazioni chimiche e la loro
variazione di energia libera standard
Le singole reazioni di una via
metabolica spesso hanno valori di
Go positivi, quindi sfavorevoli.
Com’è possibile che il processo
complessivo si svolga
efficacemente?
Una risposta è che le concentrazioni
dei reagenti vengono mantenute
lontane da quelle di equilibrio.
IN ALTERNATIVA, REAZIONI ENERGICAMENTE SFAVORITE POSSONO ESSERE “SPINTE” se
accoppiate a reazioni che hanno valori di G fortemente negativi.
L’ACCOPPIAMENTO DI REAZIONI ENDOERGONICHE A REAZIONI
ESOERGONICHE è uno dei principi più importanti della Biochimica
I composti del fosfato hanno un’energia libera altamente negativa
L’ATP è forse il più importante di questi composti ed è
quello che incontreremo più spesso nel METABOLISMO
CELLULARE
L’idrolisi dell’ATP è altamente esoergonica
Go =-31 kJ/ mol
-7,3 kcal/mol
Questo valore corrisponde ad una Keq = 105M
L’equilibrio è talmente spostato verso destra
che l’idrolisi dell’ATP può essere considerata
essenzialmente irreversibile
La spiegazione dell’elevata energia libera di idrolisi di
queste sostanze risiede nelle particolari proprietà dei
reagenti e dei prodotti della reazione. I più importanti
sono:
1) Stabilizzazione per risonanza del fosfato
prodotto;
Lo ione ortofosfato possiede un ampia varietà di
forme di risonanza che contribuiscono ad
aumentare l’ENTROPIA di questa struttura.
2) Ulteriore idratazione dei prodotti di idrolisi;
3) Repulsione elettronica tra prodotti carichi;
4) Aumento della stabilizzazione per tautomeria dei
prodotti.
G reale di idrolisi dell’ATP nelle
cellule vive è molto più negativo (50 -65 kJ/mole) di Go’. Le
concentrazioni di ATP, ADP e Pi
nelle cellule sono diverse da quelle
standard e soprattutto perché i
veri reagenti e prodotti di
reazione sono:
Basi chimiche della grande variazione di
energia libera associata all’idrolisi dell’ATP.
In tutte le reazioni che trasferiscono il fosfato, le diverse forme di risonanza
contribuiscono ulteriormente a generare un Go’ negativo
TIO-ESTERI
Idrolisi dell’acetil-Co(enzima) A
Processo a due tappe
Alcune eccezioni: elicasi, topoisomerasi, proteni RecA, ecc. sono
Dipendenti direttamente dall’idrolisi dell’ATP o del GTP.
POTENZIALE DI TRASFERIMENTO DEL FOSFATO
Ciascuno degli elementi considerati
nella tabella, considerando i diversi
valori di energia libera, è capace di
“spingere” la fosforilazione dei
composti che si trovano più in
basso nella scala, purchè sia
disponibile un meccanismo adatto
di accoppiamento.
Le variazioni
di
energia
nelle
libera
reazioni
sequenziali si
possono
sommare
Il trasferimento di gruppi fosforici è un sistema di attivazione
spesso adottato nel catabolismo per incrementare l’energia libera
di un composto che deve subire trasformazioni. Il composto
fosforilato possiede una quantità di energia libera maggiore da
liberare durante la sua trasformazione catabolica.
L’ATP trovandosi a metà della scala di trasferimento del fosfato funziona bene da
MONETA DI SCAMBIO DELL’ENERGIA LIBERA
COSTRUZIONE DI MACROMOLECOLE
INFORMAZIONALI RICHIEDE ATP
ATP FORNISCE ENERGIA PER IL
TRASPORTO ATTIVO ATTRAVERSO
LE MEMBRANE
L’ATP FORNISCE ENERGIA PER LA
CONTRAZIONE MUSCOLARE
CARICA ENERGETICA DEGLI ADENILATI
La capacità di una cellula di effettuare reazioni sostenute
dall’idrolisi dell’ATP dipende dalle concentrazioni relative dell’ATP
e dei suoi derivati.
La maggior parte delle cellule sane funziona con un valore di
carica energetica di circa 0,9
IN TUTTE LE CELLULE AVVENGONO TRANSFOSFORILAZIONI TRA
NUCLEOTIDI
L’ATP è il principale composto fosforilato ad alta energia prodotto dal catabolismo
cellulare
ATP + NDP (o dNDP)
Mg2+
ADP + NTP (o dNTP)
Go , 0
Nucleoside difosfato chinasi
Quando l’ADP si accumula nella cellula per sottrazione di gruppi
fosforici dall’ATP, è l’ADENILATO CHINASI che rimuove l’ADP in
eccesso
Mg2+
2 ADP
ATP + AMP
G’o 0
La fosfocreatina rappresenta una riserva disponibile di GRUPPI FOSFORICI
ADP + PCr
Mg2+
ATP +Cr
G’o = -12,5 kJ/mole
CREATINA CHINASI
Muscolo cardiaco
M. scheletrico, cervello, reni
30 mM
5-10 mM
REAZIONI DI OSSIDO RIDUZIONE
Fe2+ + Cu2+
COPPIE REDOX
Fe3+ + Cu+
Due semireazioni
Fe2+
Fe3+ + e-
Cu2+ + e-
Cu+
Le ossidazioni biologiche comportano spesso deidrogenazioni
Per ogni sostanza che si
OSSIDA (cede elettroni) esiste
una sostanza che si RIDUCE
(acquista elettroni)
Più ridotta
Numero di ossidazione:
È la carica che un atomo in un composto
avrebbe se le coppie elettroniche di legame
venissero considerate interamente come
appartenenti all’atomo più elettronegativo
In organica si guarda lo stato di ossidazione
del carbonio
CO2
CH4
O=C=O
n.o. = +4
Alcani
n.o. = -4
Le ossidazioni biologiche comportano spesso deidrogenazioni
La forma più ossidata lega più
ossigeno
La forma più ridotta lega più
atomi di idrogeno
DIVERSI STATI DI OSSIDAZIONE
PER IL CARBONIO
Più ossidata
Il flusso degli e- nelle reazioni di ossido-riduzione è responsabile,
direttamente o indirettamente, di tutto il lavoro prodotto dagli
organismi viventi.
Le cellule contengono una grande varietà di molecole che si
comportano da TRASDUTTORI ENERGETICI
Sostanza meno affine
eForza elettromotrice
fem
Sostanza più affine
OSSIDAZIONI BIOLOGICHE
POTENZIALE REDOX
PRODUZIONE DI ENERGIA
VARIAZIONE DI
ENERGIA LIBERA
Come si calcola il G ottenibile da una reazione REDOX
RIDUCENTE: il donatore di e- che si OSSIDA
OSSIDANTE: l’accettore di e- che si RIDUCE
POTENZIALE STANDARD DI OSSIDORIDUZIONE
E0
Misura della tendenza di un riducente a perdere elettroni
STANDARD DI RIFERIMENTO
SEMI CELLA
SEMI REAZIONE
Fe 2+
Fe 3+
1M
H2
H+
1M
ELETTRODO
STANDARD AD
IDROGENO
Dato che H2 cede più
facilmente elettroni di Fe 3+
Gli elettroni passano dalla
semicella di riferimento a
quella campione
forza proporzionale alla differenza
tra le due affinità
H2
In condizioni standard ( 25°C, 1M)
E0 dell’elettrodo ad idrogeno è = 0
Fem positiva
H+ si ossida
Fem negativa
H2
H+ si riduce
Qualsiasi coppia redox che tenda a cedere elettroni
all’elettrodo ad idrogeno
E0 negativo
coppia redox riducente
BIOCHIMICA lo standard comprende anche il pH 7
Potenziale standard di ossido-riduzione E0’
2H+/H2
E0’= - 0,414 Volt
NADH + H+ / NAD+
E0’ = - 0,32 Volt
Cederà elettroni all’idrogeno a pH 0
E0
Accetterà elettroni dall’idrogeno a pH 7
E0’
In una reazione spontanea gli elettroni scorrono dalla
semicella a più basso potenziale a quella a più alto potenziale
O2/H2O
E0’ = +0,82 Volt
presenta una forte tendenza
ad ossidare le altre sostanze
G0’ = -n F E0’ = -n F [E0’(accettore) – E0’(donatore)]
n = numero di elettroni trasferiti
F = costante di Faraday ( 96,5 KJ.V-1.mole-1)
E0’ = differenza di potenziale standard di ossido
riduzione della coppia redox
E0’ negativo
G0’ positivo reazione non favorita
NADH + H+ + ½ O2
NAD+ +H2O
Reazione altamente ESOERGONICA
G0’ = -n F E0’ = - 2 (96,5) [ 0,82- ( - 0,32) ] = - 220 kJ/ mole
L’ossidazione del glucosio a CO2 e H2O non avviene nelle cellule
in una singola reazione
C6H12O6 + 6O2
6CO2 + 6H2O G0’= -2840 kJ/mole
Gli elettroni rimossi nelle diverse reazioni di ossidazione vengono
trasferiti a molecole specializzate (coenzimi) per il trasporto degli
elettroni.
NAD+ + 2e- + 2H+
NADP+ + 2e- + 2H+
FMN + 2H++ 2eFAD + 2H+ + 2e-
NADH + H+
NADPH + H+
FMNH2
FADH2
CHINONI (solubili nei lipidi), proteine ferro-zolfo
Anello
nicotinamidico
deriva dalla
vitamina
niacina
Accetta uno
ione idruro: :H(un protone e
due elettroni)
NICOTINAMIDE
ADENIN
DINUCLEOTIDE
Spettri di assorbimento della luce UV
del NAD+ e del NADH
Vitamina
RIBOFLAVINA
FLAVIN ADENIN DINUCLEOTIDE (FAD)
FLAVIN MONONUCLEOTIDE (FMN)
OSSIDOREDUTTASI
Più comunemente chiamate
DEIDROGENASI












