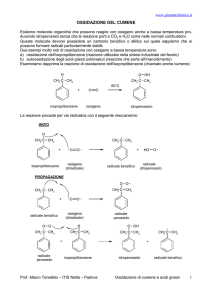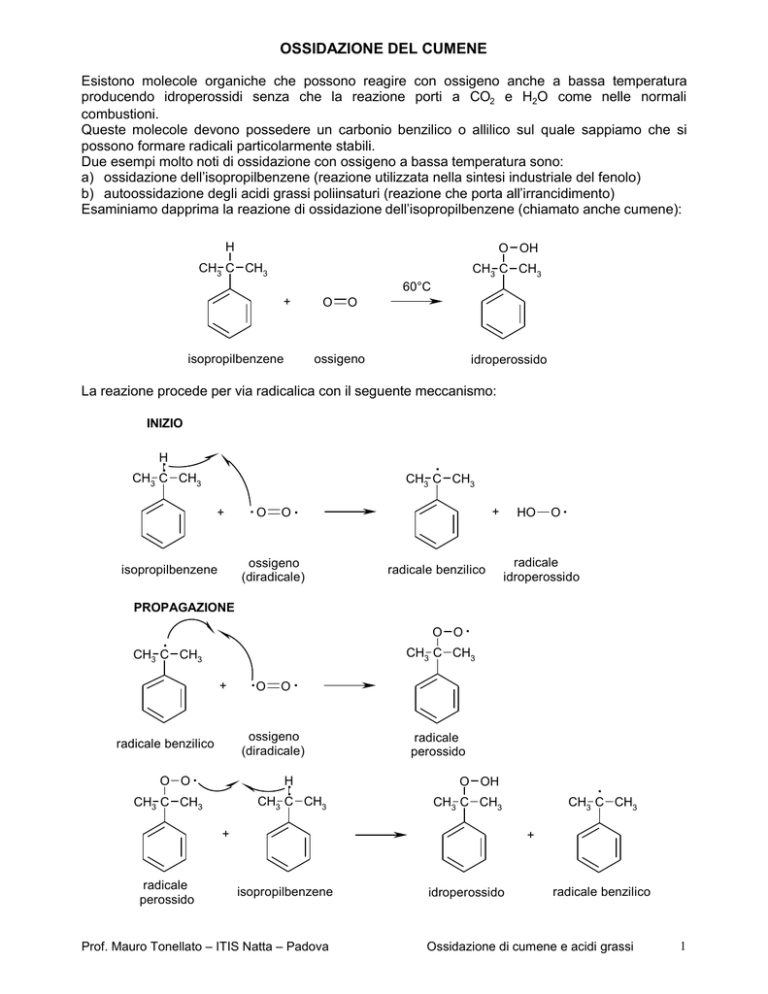
OSSIDAZIONE DEL CUMENE
Esistono molecole organiche che possono reagire con ossigeno anche a bassa temperatura
producendo idroperossidi senza che la reazione porti a CO2 e H2O come nelle normali
combustioni.
Queste molecole devono possedere un carbonio benzilico o allilico sul quale sappiamo che si
possono formare radicali particolarmente stabili.
Due esempi molto noti di ossidazione con ossigeno a bassa temperatura sono:
a) ossidazione dell’isopropilbenzene (reazione utilizzata nella sintesi industriale del fenolo)
b) autoossidazione degli acidi grassi poliinsaturi (reazione che porta all’irrancidimento)
Esaminiamo dapprima la reazione di ossidazione dell’isopropilbenzene (chiamato anche cumene):
H
O OH
CH3 C CH3
CH3 C CH3
60°C
+
isopropilbenzene
O
O
ossigeno
idroperossido
La reazione procede per via radicalica con il seguente meccanismo:
INIZIO
H.
.
CH3 C CH3
CH3 C CH3
.
+
.O
O.
ossigeno
(diradicale)
isopropilbenzene
+
radicale benzilico
HO
O.
radicale
idroperossido
PROPAGAZIONE
O O.
.
CH3 C CH3
CH3 C CH3
+
.O
O.
ossigeno
(diradicale)
radicale benzilico
O O.
H.
.
CH3 C CH3
CH3 C CH3
radicale
perossido
O OH
+
radicale
perossido
.
CH3 C CH3
CH3 C CH3
+
isopropilbenzene
Prof. Mauro Tonellato – ITIS Natta – Padova
idroperossido
radicale benzilico
Ossidazione di cumene e acidi grassi
1
Nella produzione industriale del fenolo, l’idroperossido cosìottenuto viene fatto reagire in ambiente
acquoso acido formando fenolo e acetone in una reazione che avviene in condizioni blande e
senza sottoprodotti.
O OH
CH3 C CH3
OH
+
H2O / H
O
+
idroperossido
CH3 C CH3
acetone
fenolo
Il meccanismo di questa reazione è fondato sulla instabilità del legame ossigeno-ossigeno che in
ambiente acido si rompe in modo eterolitico provocando una trasposizione dell’idroperossido che
forma un semiacetale che, scindendosi, libera il chetone e l’alcol.
CH3
CH3
..
CH3 C O OH
CH3
.. +
+
H
CH3 C O OH2
CH3 C
O+
..
OH
H2O
CH3 C
trasposizione
CH3
idroperossido
OH
CH3 C
..
O
O
semiacetale
..OH
+
H
CH3 C
OH
O
H
+
O
CH3 C CH3
+
CH3
CH3
semiacetale
acetone
fenolo
AUTOOSSIDAZIONE DEGLI ACIDI GRASSI
La reazione di autoossidazione degli acidi grassi in presenza di O2 avviene lentamente a
temperatura ambiente e provoca l’irrancidimento degli oli alimentari.
La stessa reazione può avvenire anche nelle nostre cellule dove l’ossigeno può ossidare gli acidi
grassi che costituiscono i fosfolipidi della membrana cellulare. Poichè questa reazione è a catena,
porterebbe alla ossidazione di un numero molto alto
O
di acidi grassi con conseguenze disastrose per la
H2
H2
H2
H
cellula. Per questo le nostre cellule dispongono di
C
C
C
C
C
un potente agente antiossidante, la vitamina E, in
C
OH
C
C
C
HC
H2
H2
H2
H2
grado di bloccare sul nascere le reazioni radicaliche.
CH2
La vitamina E è presente anche nell’olio d’oliva e
HC
negli oli di semi.
Un tipico acido grasso poliinsaturo è l’acido linoleico
==
(C18 ):
HC
C
H2
H2
C
C
H2
H2
C
CH3
acido linoleico
Prof. Mauro Tonellato – ITIS Natta – Padova
Ossidazione di cumene e acidi grassi
2
Qui vedremo la reazione su una molecola più piccola che è costituita solo dalla porzione dienica
dell’acido linoleico, l’1,4-pentadiene.
H2
C
H2C
C
H
C
H
CH2
O
+
1,4-pentadiene
C
C H
H
H2C
O
OH
OH
O
O
CH2
C
H
+
CH2
C
H
C
H
idroperossido
idroperossido
ossigeno
H
C
H2C
Il meccanismo di reazione è identico a quello visto prima per l’isopropilbenzene, l’unica cosa da
notare è che si ottengono due diversi idroperossidi perché i due doppi legami possono
isomerizzare, da isolati a coniugati, grazie alla risonanza nell’intermedio radicalico.
INIZIO
H.
.
H2C
C
H
C
H
C
H
CH2
+
.O
O.
H.
C
H2C
C
H
C
H
ossigeno
1,4-pentadiene
CH2
.
H
C
H2C
CH2
C
H
C
H
radicale allilico stabilizzato per risonanza
PROPAGAZIONE
O.
O
H
C.
H2C
C
H
C
H
CH2
+
O.
.O
H2C
radicale allilico
O
H2C
C
H
C
H
CH2
radicale idroperossido
O.
C
H
C
H C
H
C
H
O
H.
CH2 + H2C
radicale idroperossido
.
C
C H
H
C
H
H2C
CH2
C
H
C
H
CH2
CH2 + H2C
H
C.
O.
OH
O
+
.O
O.
H
C
H2C
radicale allilico
C
H
C
H
CH2
C
H
C
H
radicale allilico
idroperossido
1,4-pentadiene
.
H
C
C
H C
H
C
H
2^ PROPAGAZIONE
H2C
OH
O
CH2
H
C
H2C
radicale idroperossido
C
H
C
H
CH2
idroperossido
La ricerca dei perossidi negli oli alimentari è un’analisi che può rivelare un iniziale irrancidimento. Il
perossido è una molecola reattiva, si degrada spezzando la catena di atomi di carbonio e
formando due frammenti, due aldeidi, responsabili dell’odore pungente dell’olio rancido.
O
H2C
C
H
OH
C
H C
H
idroperossido
O
CH2
H2C
O
C
C
H
H
+ HO
aldeide α−β insatura
Prof. Mauro Tonellato – ITIS Natta – Padova
C
H
CH2
enolo
H2C
C
C
H
H
aldeide acrilica
+ O
CH3
C
H
acetaldeide
Ossidazione di cumene e acidi grassi
3