biochimica
organizzazione nei viventi
D. Organo:
muscolo delle ali
Le strutture biologiche hanno
un’organizzazione gerarchica
C. Cellule e tessuti:
Cellule muscolari all’interno del
tessuto muscolare
B. Organulo:
miofibrilla (solo nelle cellule
muscolari)
Actina
Miosina
A. Molecola: actina
Atomo
• La vita richiede
circa 25 elementi
che si possono
combinare tra loro
per formare i
composti.
• Carbonio,
idrogeno, ossigeno
e azoto sono i
quattro elementi
fondamentali per
costruire la
maggior parte della
materia vivente.
atomi
• La configurazione elettronica di un atomo ne
determina le proprietà chimiche
• Gli elettroni in un atomo si dispongono in gusci
elettronici che possono contenere numeri diversi di
elettroni.
Guscio elettronico più esterno (può contenere fino a 8 elettroni)
Guscio elettronico più interno (può contenere fino a 2 elettroni)
Elettrone
Idrogeno (H)
Numero atomico = 1
Figura 2.5
Carbonio (C)
Numero atomico = 6
Azoto (N)
Numero atomico = 7
Ossigeno (O)
Numero atomico = 8
legami chimici
– Quando due atomi con un guscio elettronico
incompleto reagiscono, ciascuno di essi mette
in comune elettroni, in modo da occuparlo
completamente.
– Queste interazioni solitamente fanno sì che gli
atomi vengano tenuti insieme da forze di
attrazione chiamate legami chimici.
molecole
• Mediante i legami
covalenti gli atomi
condividono elettroni
formando molecole
• Nei legami covalenti due
atomi mettono in comune
una o più coppie di elettroni
poste sui loro livelli
energetici più esterni,
formando molecole.
• Le molecole possono essere
rappresentate in molti modi.
ioni e legami ionici
• I legami ionici sono interazioni che si
stabiliscono tra ioni di carica opposta
• Quando gli atomi cedono o ricevono elettroni si
creano atomi carichi chiamati ioni.
–
Trasferimento di
elettroni
–
+
Na
Cl
Na
Atomo di sodio
Cl
Atomo di cloro
Na
Na+
Ione sodio
–
Cl
Cl–
Ione cloro
Cloruro di sodio (NaCl)
– Due ioni aventi cariche opposte si attraggono.
– Se l’attrazione è abbastanza forte, si forma un
legame detto legame ionico.
– Per esempio, gli ioni sodio e gli ioni cloro si legano
per formare il cloruro di sodio, il comune sale da
cucina.
Na+
Cl–
reazioni chimiche
• Le reazioni chimiche consentono alle sostanze
di ricombinarsi
• In una reazione chimica i reagenti (materiali di
partenza) interagiscono, cambiano
l’organizzazione degli atomi e formano il
prodotto finale.
2 H2
O2
2 H2O
metabolismo biochimico
– Nelle cellule viventi avvengono migliaia di
reazioni chimiche che trasformano la materia.
– Per esempio, il beta-carotene viene convertito in
vitamina A.
CH3
CH3
CH3
H2C
C
CH2
H2C
CH
C
CH
C
CH3
CH
CH
CH
C
C
CH
CH CH
C
CH3 CH3
CH
CH
C
CH3
Beta-carotene
CH
CH
CH
C
CH3
CH
C
CH3
CH2
H2C
CH2
C
CH3
CH2
CH3
CH3
O2
4H
2 CH2
H2C
CH
C
C
CH
CH3
H
C
C
CH
C
CH
CH
CH
C
CH3 CH3
Vitamina A
(2 molecole)
H
OH
H 2O
Le proprietà dell’acqua
La molecola dell’acqua è polare
– Una molecola è non polare quando i suoi atomi
legati da legame covalente condividono gli elettroni
equamente.
– In un legame covalente polare la condivisione
degli elettroni tra gli atomi è asimmetrica e crea una
molecola polare (dotata cioè di poli con cariche
parziali opposte).
(–)
(–)
O
H
(+)
H
(+)
La polarità della molecola dell’acqua consente
la formazione del legame idrogeno
• Le estremità cariche delle
molecole d’acqua vengono
attratte dalle estremità
dotate di carica opposta
delle molecole vicine.
idrogeno
(+)
H
(+)
• Questa attrazione forma
legami deboli chiamati
legami idrogeno.
(–)
Legame
O
(–)
H
(–)
(+)
(–)
(+)
L’acqua è un solvente versatile
• I soluti polari o carichi si sciolgono quando le
molecole d’acqua li circondano, formando
soluzioni acquose.
Na+
–
+
–
Cl–
+
–
+
–
Ioni in
soluzione
Na+
Cl–
+
–
+
–
–
+
+
–
–
Cristallo
di sale
–
carbonio
La diversità molecolare della vita è basata sulle
proprietà del carbonio
– Un atomo di carbonio può formare quattro legami
covalenti.
– Questi legami gli permettono di formare composti
organici (grandi molecole, molto diverse tra loro).
Formula
di struttura
Modello a sferette
e bastoncini
H
H
H
C
Modello
a spazio pieno
H
C
H
H
Metano
H
H
I quattro legami semplici del carbonio
determinano i vertici di un tetraedro
idrocarburi
Gli idrocarburi sono
composti organici formati
soltanto da carbonio e
idrogeno.
isomeri
– Alcuni composti del carbonio sono isomeri,
molecole con la stessa formula grezza ma
differente struttura.
– Ogni isomero ha proprietà peculiari.
gruppi funzionali
• I gruppi funzionali determinano le caratteristiche
chimiche dei composti organici.
– Si tratta di gruppi particolari di atomi che,
legayi a catene idrocarburiche, conferiscono
proprietà particolari alle molecole organiche
ed alle biomolecole.
• Alcuni esempi di gruppi funzionali dei
composti organici:
Gruppo funzionale ossidrile
Caratterizza gli Alcoli:
metanolo
Etanolo o Alcol Etilico
Gruppo funzionale: carbonile
Caratterizza le Aldeidi:
acetaldeide
e i Chetoni:
acetone
Gruppo funzionale: carbossile
Caratterizza gli acidi organici
Acido acetico
Gruppo funzionale: amminico
Gruppo funzionale: fosfato
macromolecole biologiche:
– Le quattro classi principali di molecole biologiche
sono: carboidrati, lipidi, proteine e acidi
nucleici.
– Molte di queste molecole hanno dimensioni
enormi (dal punto di vista molecolare) e, per
questo, sono definite macromolecole.
– Le macromolecole più grandi si formano
unendo molecole organiche più piccole in
catene chiamate polimeri mediante un
processo chimico detto condensazione.
H
OH
OH
H
Monomero isolato
Breve polimero
H2O
Condensazione
H
OH
Polimero più lungo
– I polimeri sono spezzati in monomeri attraverso
la reazione di idrolisi.
– L’idrolisi è il processo opposto alla
condensazione.
H2O
H
OH
Idrolisi
H
OH
OH
H
carboidrati
I monosaccaridi sono i carboidrati più
semplici (monomeri), sono formati da una
sola molecola di zucchero.
.
In genere i monosaccaridi presentano formule
grezze che sono multipli di CH2O. Sono
Polialcoli aldeici o chetonici di brevi catene
idrocarburiche (da 3 a 7 atomi di C), ovvero
posseggono:
•
•
glucosio
un certo numero di gruppi ossidrilici (-OH) che
conferiscono allo zucchero caratteristiche
alcoliche;
un gruppo carbonilico (>C=O) che, a seconda
di dove è posizionato nella molecola, conferisce
caratteristiche aldeidiche o chetoniche.
aldosi
chetoesosi
– I monosaccaridi glucosio e fruttosio sono zuccheri a
6 atomi di carbonio,
– Queste molecole contengono lo stesso numero e tipo
di atomi ma in disposizioni differenti: sono isomeri.
aldeide
C6H12O6
H
O
H
C
Glucosio
C
OH
C
O
C
H
H
C
OH
H
chetone
H
C
OH
HO
C
H
H
C
OH
H
C
OH
H
C
OH
H
C
OH
H
C
OH
H
HO
Fruttosio
H
Il ribosio è un esempio di zucchero a 5
atomi di carbonio:
I monosaccaridi possono anche presentarsi
sotto forma di strutture ad anello:
6 CH2OH
H
5C
CH2OH
O
H
H
H
C 1
4C
OH
OH
3C
H
OH
O
H
OH
O
H
OH
HO
C2
H
H
H
OH
OH
Formula di
struttura
Formula
semplificata
Struttura
semplificata
monosaccaridi modificati
disaccaridi
• Dal legame tra due singole unità di zuccheri si forma un
disaccaride.
• Due monosaccaridi possono unirsi per formare i
disaccaridi come il saccarosio (lo zucchero da
tavola), il maltosio e il lattosio.
maltosio
CH2OH
H
HO
CH2OH
O
H
OH
H
O
H
H
H
OH
HO
OH
H
H
H
OH
Glucosio
OH
H
OH
Glucosio
H2O
CH2OH
H
HO
CH2OH
O
H
OH
H
H
H
H
O
OH
O
H
OH
H
Maltosio
H
OH
H
OH
saccarosio
Il Saccarosio (zucchero da tavola) è un disaccaride formato dalla condensazione di
molecole di Glucosio e Fruttosio.
lattosio
Disaccaride cha nasce dalla condensazione
del glucosio e del galattosio
Quanto è dolce il sapore dolce?
Oltre agli zuccheri, molti tipi di molecole
hanno un sapore dolce perché si legano ai
recettori del «dolce» presenti sulla lingua.
I polisaccaridi sono lunghe catene di
monosaccaridi
– I polisaccaridi sono polimeri formati da
centinaia o migliaia di molecole di
monosaccaridi.
– anche molecole di monosaccaride sono unite
tra loro per condensazione.
– L’amido e il glicogeno sono polisaccaridi
che immagazzinano zuccheri di riserva.
– La cellulosa è un polisaccaride che si trova
nelle pareti delle cellule vegetali.
Granuli di amido in
cellule di tubero di
patata
O
O
O O
O
O
O
O
Glicogeno
O
O
O O
Fibre di cellulosa nella parete
di una cellula vegetale
Molecole
di cellulosa
O
O
O
Granuli di glicogeno
nel tessuto
muscolare
Monomeri
di glucosio
Amido
O
O
O
O
O
O
O
O
O
Cellulosa
OO
OO
O OH
OO
O OH
OO
O
OO
OO
OO
O O
O
O O
O
amido
glicogeno
cellulosa
chitina
• E’ un polisaccaride formato da monomeri
di n-acetilglucosammina, è uno dei
principali componenti dell'esoscheletro
degli insetti e degli altri artropodi, e della
parete cellulare di funghi. Dopo la
cellulosa, la chitina è il più abbondante
biopolimero presente in natura.
Lipidi
I lipidi sono un gruppo di molecole eterogenee
per la maggior parte apolari.
I lipidi sono raggruppati insieme perché sono
idrofobi (non si «mescolano» con l’acqua che
è una molecola polare).
I lipidi comprendono diversi composti formati
essenzialmente da atomi di carbonio e di
idrogeno.
Sono lipidi i:
Trigliceridi (che includono i grassi
animali e gli oli vegetali, che sono le
tra le principali molecole energetiche
metaboliche)
Fosfolipidi (formano le membrane
biologiche)
Steroidi (colesterolo e alcuni ormoni)
Cere
trigliceridi
I trigliceridi, sono lipidi la cui funzione
principale è quella di immagazzinare energia.
trigliceridi
– I trigliceridi sono formati dalla condensazione di tre
acidi grassi con i tre gruppi ossidrilici di un
polialcole a tre atomi di C, il glicerolo.
H
H
H C
C
OH OH
H
C H
OH
HO Glicerolo
C O
H2O
CH2
CH2
CH2
CH2
CH2
Acido grasso
CH2
CH2
CH2
CH2
CH2
CH2
CH2
CH2
CH2
CH3
H
H
H
H
C
C
C
O
O
O
C
O C
O C
H
O
CH2
CH2
CH2
CH2
CH2
CH2
CH2
CH2
CH2
CH2
CH2
CH2
CH2
CH2
CH2
CH2
CH2
CH2
CH2
CH2
CH
CH2
CH2
CH2
CH2
CH2
CH2
CH2
CH2
CH2
CH2
CH2
CH2
CH2
CH2
CH3
CH3
CH
CH2
CH2
CH2
CH2
CH2
CH2
CH3
I fosfolipidi sono costituenti principali
delle membrane cellulari. Queste molecole
hanno una «testa» idrofilica e due
«code» idrofobiche.
+ CH3
CH2 N CH3
CH3
CH
Testa idrofilica
2
O
O P O–
O
CH2
CH CH2
O
O
C O
C
CH2
CH2
O
CH2
CH2
CH2
CH2
CH2
CH2
CH2
CH2
CH2
CH2
CH2
CH
CH2
CH2
CH2
CH2
CH2
CH2
CH2
CH2
Gruppo
fosfato
Schema di un
fosfolipide
CH
CH2
CH2
CH2
CH2
CH2
CH2
CH2
CH3
CH3
Code
idrofobiche
I fosfolipidi formano una struttura stabile a due
strati chiamata doppio strato fosfolipidico in cui
le teste idrofiliche sono a contatto con l’acqua,
mentre le code idrofobiche si orientano verso
l’interno, allontanandosi dall’acqua.
Teste
idrofiliche
Acqua
Code
idrofobiche
Acqua
H3C
CH3
CH3
CH3
CH3
colesterolo
HO
Colesterolo e alcuni ormoni steroidei.
proteine
Le proteine
Le proteine sono essenziali per la struttura e
le funzioni degli organismi viventi
– Una proteina è un polimero biologico formato
da monomeri di amminoacidi.
– Le proteine sono coinvolte in quasi tutte le
attività di una cellula.
– Gli enzimi sono proteine che regolano le
reazioni chimiche.
Funzioni delle proteine.
•
•
•
•
•
•
•
•
Enzimi
Proteine strutturali
Proteine contrattili
Proteine di difesa
Proteine regolatrici
Proteine recettore
Proteine di trasporto
Proteine di riserva
Le proteine sono costituite solo da 20 tipi diversi di
amminoacidi
– Tra tutte le molecole, le proteine sono quelle
che presentano le maggiori differenze tra di loro
per struttura e funzione.
– La diversità tra proteine è basata sulle differenti
disposizioni in cui si può assemblare un gruppo
comune di 20 monomeri di amminoacidi.
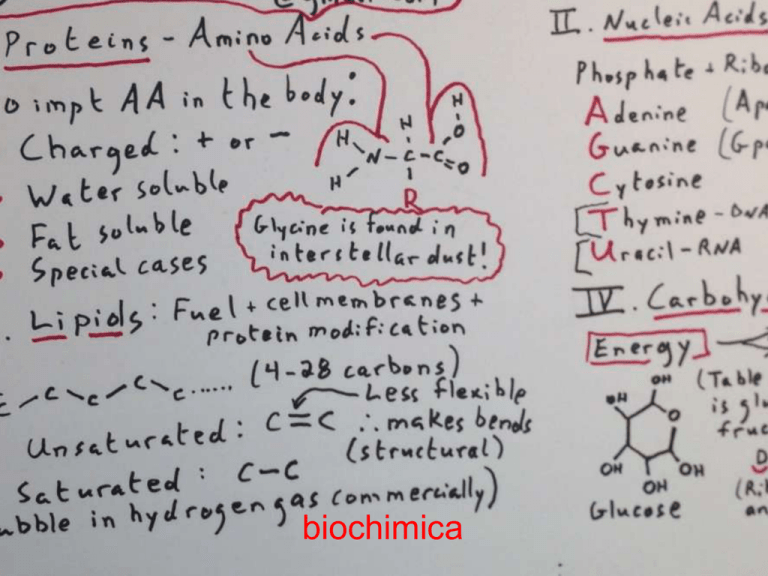
Ogni amminoacido contiene:
– un gruppo amminico;
– un gruppo carbossilico;
– un gruppo R, la regione variabile che
determina le proprietà specifiche di ciascuno
dei 20 diversi amminoacidi.
H
O
H
N
C
H
C
OH
R
Gruppo
amminico
Gruppo (acido)
carbossilico
• Ogni amminoacido ha proprietà specifiche
basate sulla propria struttura:
H
H
H
O
N
H
C
CH2
CH
CH3
H
C
O
N
OH
H
C
H
C
N
OH
H
Idrofobico
C
C
OH
H
CH2
CH2
OH
C
CH3
Leucina (Leu)
O
OH
Serina (Ser)
O
Acido aspartico
(Asp)
Idrofilico
• Gli amminoacidi si legano tra loro mediante legami
peptidici
– Le cellule legano tra loro gli amminoacidi
tramite reazioni di condensazione.
– I legami covalenti tra i monomeri di amminoacidi
sono detti legami peptidici.
Gruppo
carbossilico
H
H
H
O
N
H
C
Legame
peptidico
Gruppo
amminico
C
+
OH
O
H
N
C
Reazione
di condensazione
H
C
H
N
OH
R
R
Amminoacido
Amminoacido
H2O
H
H
O
C
C
R
H
N
C
H
R
Dipeptide
O
C
OH
La configurazione specifica della proteina
determina la sua funzione
Una proteina è costituita da una o più
catene polipeptidiche ripiegate secondo una
particolare configurazione che determina la
funzione della proteina.
Scanalatura
Scanalatura
La forma delle proteine
comprende quattro livelli strutturali
– La struttura primaria di una proteina è la
sequenza di amminoacidi che formano la sua
catena polipeptidica.
Leu Met
Pro
Gly Glu
Struttura primaria
Gly
Thr
Cys
Ser Lys
Asn Val
Val
Ile
Lys
Val
Ala
Pro
Leu Asp Ala Val Arg Gly Ser
Amminoacidi
Ala
Val
His
Phe
Val
Arg
– Nella struttura secondaria (il secondo livello della
struttura proteica), alcuni tratti del polipeptide si
ripiegano o formano delle spirali stabilizzate da
legami idrogeno.
– La spiralizzazione della catena polipeptidica dà
origine a una struttura secondaria indicata come
alfa elica.
– Un particolare tipo di ripiegamenti porta alla
struttura chiamata foglietto ripiegato.
Amminoacidi
Legame
idrogeno
C
C
N H
O C
Struttura secondaria
C
O C
N H
N H O C
C
C
C
H O
N H
O C
C
N
O H
H
O
N C CN
H
R CC N C CN
H
CC
O
H
O
O
H
O
C N C
CN
C
C H
H O C C N CN
H
O C
C
C
N H
O C
N H O C
R
C
H C
N H O
O C
C
C
N H
Alfa elica
N
H
O
H
O
N C CN
H
CC N C C N
H
C
O
H
O
O
H
O
C N CC
N
H
C N C
H O C
CN
H
O C
Foglietto ripiegato
– La struttura terziaria di una proteina è
l’aspetto generale e tridimensionale di un
polipeptide.
– In genere, la struttura terziaria è dovuta ai legami a idrogeno e
ionici che si formano tra alcuni dei gruppi R polari e alle interazioni
tra gruppi R idrofobici del polipeptide e l’acqua.
Struttura terziaria
Polipeptide
(singola unità
di transtiretina)
lisozima
Il lisozima è una proteina costituita da 129 amminoacidi.
cdc25
dna polimerasi taq
titin
La titina umana è una proteina costituita da 34.350 amminoacidi.
– La struttura quaternaria di una proteina risulta
dall’associazione di due o più catene
polipeptidiche.
– Un esempio di proteina che possiede una
struttura quaternaria è il collagene: una proteina
fibrosa costituita da tre alfa eliche avvolte a
Catena polipeptidica
spirale.
Struttura quaternaria
Transtiretina,
con quattro subunità
polipeptidiche
identiche
Collagene
emoglobina
insulina
Nucleotidi e
acidi nucleici
struttura base del nucleotide
H
H
N
N
N
H
OH
O
P
N
O
CH2
Base azotata
(A)
O
O
Gruppo fosfato
H
H
H
H
OH
N
H
Zucchero
H
ATP (adenosin trifosfato)
• L’ATP, una molecola in grado di trasferire
energia metabolica, è un nucleotide.
• Nella molecola di ATP (adenosin trifosfato)
lo zucchero a cinque atomi di carbonio è il
ribosio, la base azotata è l’adenina, e i
gruppi fosfato sono tre.
Adenosina
Adenosina difosfato
Trifosfato
Gruppi fosfato
H2O
P
Adenina
P
P
P
Idrolisi
Ribosio
ATP
ADP
P +
P +
Energia
• Nella cellula l’ATP funge da navetta per il trasporto
dell’energia chimica
– L’ATP fornisce l’energia necessaria per tutte le
forme di lavoro cellulare.
– In una molecola di ATP l’energia risiede nei legami
covalenti che uniscono i gruppi fosfato.
– L’ATP libera energia utile per le reazioni
endoergoniche attraverso la fosforilazione.
– La fosforilazione è il trasferimento di un gruppo
fosfato a una molecola per renderla più reattiva.
ATP
Lavoro chimico
Lavoro meccanico
Proteina
motrice
P+
Lavoro di trasporto
Membrana della proteina
Soluto
P
Reagenti
P
P
P
Prodotto
Molecola formata
Proteina mobile
ADP+ P
P
Soluto trasportato
• Il lavoro cellulare può essere sostenuto nel tempo
perchè l’ATP è una molecola rinnovabile, che viene
rigenerata dalle cellule.
ATP
Energia prodotta
dalle reazioni
esoergoniche
Energia utile
per le reazioni
endoergoniche
ADP + P
• Gli acidi nucleici sono polimeri di nucleotidi
portatori di informazioni
– Gli acidi nucleici sono polimeri di nucleotidi.
– Vi sono due tipi di acidi nucleici: l’acido
ribonucleico (RNA) e l’acido
deossiribonucleico (DNA).
• DNA e RNA sono polimeri di nucleotidi
• Il DNA è un acido nucleico costituito da lunghe catene
di nucleotidi.
– Il gruppo fosfato di un nucleotide si lega allo
zucchero del nucleotide successivo andando a
costituire uno scheletro zucchero-fosfato con le
basi azotate collocate all’esterno di questa
impalcatura.
Nucleoti
de
A
T
C
G
T
Scheletro zucchero-fosfato
adenina
citosina
guanina
timina
• Il DNA ha quattro tipi di basi azotate:
• adenina (A), timina (T), citosina (C) e guanina (G)
H
O
H3C
C
C
H
C
N
H
H
N
C
C
C
H
O
N
C
N
H
Timina (T)
C
Citosina (C)
Pirimidine
N
N
H
H
H
H
O
C
N
C
C
N
C
H
N
N
C
N
O
H
C
N
H
H
C
C
C
N
H
Adenina (A)
Guanina (G)
Purine
N
C
H
N
H
H
• Anche l’RNA è un acido nucleico ma è composto da
uno zucchero leggermente differente (il ribosio) e una
base azotata chiamata uracile (U) al posto della
timina.
Base azotata
(A, G, C, o U)
O
Gruppo
fosfato
H
O
C
N
C
Ossigeno
C
O
P
H
Legenda
Idrogeno
Carbonio
Azoto
H
O CH2
C
N
O
Uracile (U)
O–
O
H
H C
H C
C H
C
O
OH
Zucchero
(ribosio)
Fosforo
uracile
Il DNA ha la forma di un’elica a doppio filamento,
o doppia elica.
Miescher 1869
James Watson e Francis Crick
1953
– Un cromosoma di DNA è formato da due
polinucleotidi avvolti uno sull’altro in una
doppia elica.
C
A
C
C
T
G
G
A
T
C
G
A
T
T
A
Coppia di basi
G
T
A
A
T
A
C
T
– I legami idrogeno tra le basi tengono uniti i
filamenti.
– Ogni base è appaiata con una base
complementare:
A con T, e G con C.
G
C
T
O
A
A
Coppie di basi
appaiate
T
C
G
C
C
G
A
T
–O
OH
A
T
O
P
O
H2C
O
A
O
P
O
H2C
O
–O
A
T
A
O
P
O
H2C
O
T
A
A
O
CH2
O O–
O P
O
O
CH2
O
O–
P
O
O
O
CH2
O
O–
P
HO O
T
OH
G
CH2
O O–
P
O
O
G
C
O
A
O
C
G
O
–O
T
Legame idrogeno
O
–O
G
T
OH
P
O
O
H2C
C
T
Modello a nastro
Struttura chimica
Modello computerizzato
– Il materiale genetico che gli
organismi ereditano dai loro
genitori è costituito dal DNA.
– Nel DNA si possono
individuare i geni, specifici
segmenti della molecola che
codificano per una
informazione, ad esempio
per una sequenze di
amminoacidi che
caratterizza una proteina.
– Un cromosoma contiene una
lunga molecola di DNA che
contiene molti geni.
Biomolecole complesse.
• Le biomolecole possono interagire tra loro e
formare complesse molecole miste
• Nelle cellule, le proteine interagiscono tra di loro
formando molecole complesse, con funzioni specifiche:
– glicoproteine (fanno parte delle membrane cellulari);
– glicolipidi (svolgono funzioni simili alle glicoproteine);
– nucleoproteine (regolano la duplicazione e la
trascrizione del DNA);
– lipoproteine (regolano il trasporto dei lipidi nel
sangue).