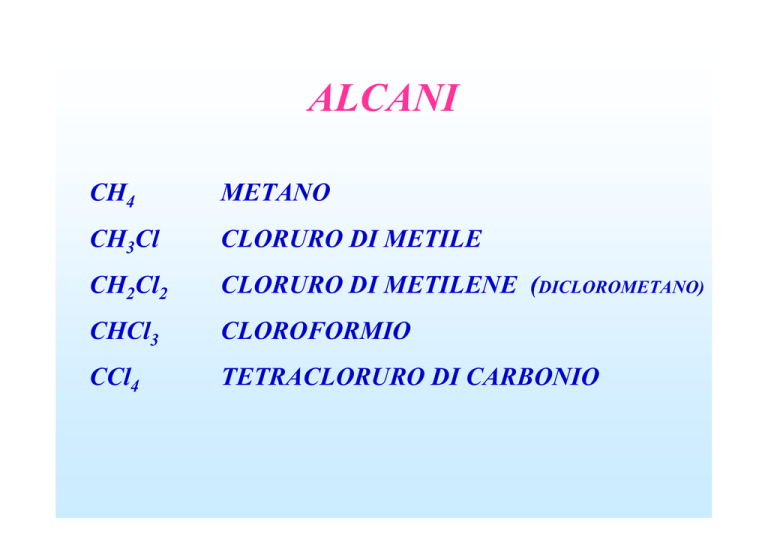
ALCANI
CH4
METANO
CH3Cl
CLORURO DI METILE
CH2Cl2
CLORURO DI METILENE (DICLOROMETANO)
CHCl3
CLOROFORMIO
CCl4
TETRACLORURO DI CARBONIO
ALCANI
CH3-CH3
ETANO
CH2Cl-CH2Cl
1,2-DICLOROETANO
CCl3-CH3
1,1,1-TRICLOROETANO
CHCl2-CHCl2
TETRACLORETANO
ALCANI
CH3-CH2-CH3
PROPANO
CH2Cl-CHCl-CH3
1,2-DICLOROPROPANO
ALCHENI
CH2 = CH2
ETILENE
CH2 = CHCl
CLORURO DI VINILE
CHCl = CHCl
1,2-DICLOROETILENE
CCl2 = CHCl
TRICLOROETILENE
CCl2 = CCl2
TETRACLOROETILENE
ALCHENI
CH2 = CH - CH3
PROPENE
CHCl = CH - CH2Cl
1,3-DICLOROPROPENE
ALCHENI
BUTADIENE
CH2 = CH - CH = CH2
ESACLORO-1:3-BUTADIENE
CCl2 = CCl - CCl = CCl2
DICLOROMETANO
USI INDUSTRIALI:
1. Sverniciante
2. Sgrassante
3. Denaturante dei cibi (p.e. decaffeinizzazione)
4. Manifatture plastiche
DICLOROMETANO
METABOLISMO
E’ metabolizzato per via ossidativa (cit. P-450
2E1) a formaldeide e acido formico, ma, in
particolare a CO
METABOLISMO DEL DICLOROMETANO
H
Cl
H
C
Cl
Cl
C
H
H
H
C
OH
OH
formaldeide
diclorometano
H
CO + H2O
C
COOH
acido formico
CO2 + H2O
DICLOROMETANO
TLVs (ppm)
TLV-TWA TLV-STEL ACGIH IARC R
50
A3
2b
DICLOROMETANO
TOSSICITA’
La tossicità è in relazione alla sua
biotrasformazione a CO (emivita COHb circa 16
ore).
Sull’animale da esperimento sono stati
evidenziati effetti cancerogeni a carico del fegato
e del polmone (topo) e della mammella (ratti)
DICLOROMETANO
MONITORAGGIO BIOLOGICO
diclorometano nel sangue (2 ore dopo inizio turno)
valutazione tedesca:
sangue
0,1 mg/L
0,2 mg/L
0,5 mg/L
1,0 mg/L
valori di riferimento:
ambiente
10 ppm
20 ppm
50 ppm
100 ppm
≤ 0,2 µg/L
DICLOROMETANO
MONITORAGGIO BIOLOGICO
COHb (fine turno)
sono riportati valori di COHb del 5% per esposizioni a 50
ppm.
Valori di riferimento:
non fumatori < 0,85%
fumatori
< 4,58%
DICLOROMETANO
MONITORAGGIO BIOLOGICO (BEI)
diclorometano urinario (fine turno di lavoro)
valori di riferimento:
200 µg/L
< 0,19 µg/L
CLOROFORMIO
.
E’ uno dei più antichi anestetici usati dall’uomo,
ma è scoraggiato il suo uso fin dal 1912.
CLOROFORMIO
.
METABOLISMO
Il metabolismo ossidativo porta alla formazione
dell’intermedio FOSGENE.
METABOLISMO DEL CLOROFORMIO
OH
H
microsomi
Cl
C
Cl
Cl
C
Cl
Cl
Cl
- HCl
H H O
O
cisteina
Cl
C
S
Cl
- 2HCl
fosgene
H2O
2HCl + CO2
C OH
NH
C
O
acido 2-oxotiazolidin-4-carbossilico
+ 2 GSH
- 2 HCl
GS
C
H C
C
SG
O
diglutationilditiocarbamato
CLOROFORMIO
TLVs (ppm)
.
TLV-TWA TLV-STEL ACGIH IARC R
10
A3
2b
CLOROFORMIO
.
TOSSICITA’
Elevate esposizioni possono causare danno
epatico e renale, oltre ad aritmie cardiache
verosimilmente dovute a sensibilizzazione del
miocardio alle catecolamine.
CLOROFORMIO
TOSSICITA’
Sperimentalmente il trattamento cronico causa necrosi
epatica centrolobulare e rigonfiamento torbido del
rene. Il FOSGENE è il metabolita ipotizzato tossico.
Nel rene è metabolizzato dal cit. P-450 2E1,
testosterone dipendente (l’enzima epatico non è sesso
dipendente)
CLOROFORMIO
TOSSICITA’
Effetti cancerogeni: nei ratti maschi è stato osservato
un eccesso di tumori epiteliali renali, nei topi di tumori
epatici. Si presume che gli effetti oncogeni siano
imputabili agli effetti necrotici con successiva
iperplasia rigenerativa.
TETRACLORURO DI CARBONIO
USI INDUSTRIALI:
1. Solvente in laboratorio
2. Pesticida in agricoltura
3.
Intermedio chimico nella produzione
fluorocarburi e nella pulizia dei metalli
di
TETRACLORURO DI CARBONIO
USI EXTRAINDUSTRIALI:
In passato veniva usato nel lavaggio a secco e come
agente sgrassante
TETRACLORURO DI CARBONIO
METABOLISMO
Viene assorbito per via inalatoria, cutanea e digestiva.
Viene metabolizzato via cit. P-450 2E1 a radicali liberi
(radicale triclorometilico e triclorometilperossido) che
si legano irreversibilmente al cit. P-450 inattivandolo
(attivazione suicida)
TETRACLORURO DI CARBONIO
TLVs (ppm)
TLV-TWA TLV-STEL ACGIH IARC R
5
10
A2
annotazione skin
2b
TETRACLORURO DI CARBONIO
TOSSICITA’
Il radicale libero triclorometilico attacca gli acidi
grassi enoici delle membrane del reticolo
endoplasmico liscio inducendo un radicale libero
secondario negli acidi grassi che, attaccati
dall’ossigeno instaurano il processo noto come
PEROSSIDAZIONE LIPIDICA.
In condizioni anaerobie, la rottura dei legami C-Cl
causano la formazione di metaboliti altamente reattivi
detti CARBENI, la cui struttura generale è R3C:
Cl3C:
CCl4 →
TETRACLORURO DI CARBONIO
MONITORAGGIO BIOLOGICO
indici tedeschi:
tetracloruro di carbonio nel sangue (dopo alcuni giorni di
esposizione)
70µg/L
METABOLISMO DEL
TETRACLORURO DI CARBONIO
CCl4
- Cl .
.O - O - CCl
3
+ e.
+ O2
O
+
2
GSH
+ RH
H - O - O - CCl3
Cl - C- Cl
H - O - CCl3
.
-R
- HCl
- GSSG
CO2
- H2O
+ RH
.CCl
3
- R.
+ O2
CHCl3
+ e.
+OO22
+ H2O
- .Cl
.CCl
3
:CCl2
- 2 HCl
.C
O.
1,2-DICLOROETANO
IMPIEGHI OCCUPAZIONALI
1. In agricoltura come fumigante
2. Sintesi del cloruro di vinile e di vinilidene
3. Sintesi altri idrocarburi alogenati
4. Sintesi dell’ossido di etilene
5. Come scavanger del Pb nell’industria petrolchimica
1,2-DICLOROETANO
METABOLISMO
Ossidato via Cit. P-450 a 2-cloroacetaldeide,
cloretanolo e acido 2-cloroacetico.
Si coniuga col GSH con possibile deplezione
METABOLISMO
DELL’1,2-DICLOROETANO
H
NADPH+O2
Cl
Cl
C
C
H
H
H
GSH
Cl-
NADP+H2O
Cl
H
C
S-(2-cloroetil)glutatione
COH
Cl-
H
2-cloroacetaldeide
ione episulfonio-glutatione
NADH+H+
H2O
Cl
-glu
-gli
Cl
NAD
2H+
H
C
CHOH
H
2-cloroetanolo
H
C
COOH
H
acido 2-clroroacetico
S,S'-etilen-bis-L-cisteina
1,2-DICLOROETANO
TLVs (ppm)
TLV-TWA TLV-STEL ACGIH IARC R
10
A4
2b
45
1,2-DICLOROETANO
TOSSICITA’
E’ epatotossico.
Causa steatosi epatica; nell’uomo sono state
osservate
alterazioni
epatobiliari,
distonie
neurovegetative e alterazioni della funzione
tiroidea.
METILCLOROFORMIO
(1,1,1-TRICLOROETANO)
Usi industriali: sintesi del cloruro di vinile
pulizia metalli
rimozione oli, grassi e
nell’industria elettrica e tessile
Usi extraindustriali: presente in colle e adesivi
cere
METILCLOROFORMIO
(1,1,1-TRICLOROETANO)
METABOLISMO
La fonte di assorbimento è per via inalatoria.
Solo il 4% viene metabolizzato via Cit. P-450 a
tricloroetanolo e successivamente ad acido
tricloroacetico.
Il 90% viene riespirato
METILCLOROFORMIO
(1,1,1-TRICLOROETANO)
Cl
Cl
H
C
C
H
Cl H
Cl
Cl
H
C
C
Cl O
tricloroacetaldeide
Cl
Cl
H
C
C
H
Cl OH
tricloroetanolo
Cl O
Cl
C
C
Cl H
acido tricloroacetico
METILCLOROFORMIO
(1,1,1-TRICLOROETANO)
TLVs (ppm)
TLV-TWA TLV-STEL ACGIH IARC R
350
450
A4
METILCLOROFORMIO
(1,1,1-TRICLOROETANO)
TOSSICITA’
Esposizioni a 1000 ppm causano un effetto
anestetico.
L’esposizione cronica causa neuropatie periferiche.
Sintomi: irritazione oculare, delle
respiratoria; nausea, vomito, diarrea.
mucose
e
METILCLOROFORMIO
(1,1,1-TRICLOROETANO)
MONITORAGGIO BIOLOGICO
MC sangue inizio turno dopo alcuni giorni di esposizione (tedesco)
550 µg/L
valori di riferimento
< 1 µg/L
MC aria espirata prima ultimo turno settimana (ACGIH)
40 ppm
valori di riferimento
< 7,7 ng/L
METILCLOROFORMIO
(1,1,1-TRICLOROETANO)
MONITORAGGIO BIOLOGICO
MC
urine fine primo emiturno previo svuotamento della vescica
595 µg/L
valori di riferimento < 260 ng/L
all’inizio del turno (LBE)
TCA urine fine esposizione settimanale (ACGIH)
10 mg/L
valori di riferimento < 60 µg/L
METILCLOROFORMIO
(1,1,1-TRICLOROETANO)
MONITORAGGIO BIOLOGICO
TCE urine fine esposizione (ACGIH)
30 mg/L
valori di riferimento < 160 µg/L
TCE sangue fine esposizione settimanale (ACGIH)
1 mg/L
valori di riferimento non noti
1,2-DICLOROPROPANO
USI INDUSTRIALI:
1. Sverniciante
2. Smacchiatore
3. Diluenti nitro
1,2-DICLOROPROPANO
USI EXTRAINDUSTRIALI:
1. Smacchiatore (“trieline” commerciali)
2. “glue sniffers”
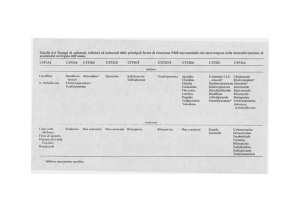
Composizione (%) dei più
comuni smacchiatori
1,2D TRI nES cES McP 2,3MP N.I.
Trielina ATENA
PIERPAOLI 94
ERMAS
100
FIRPA
24
Benzina AVIO
Smacch. PLUDTACH
100
6
10
40
40
27
30
16
20
10
13
70
1,2-DICLOROPROPANO
METABOLISMO
viene ossidato a epossipropano che può seguire
la via degli acidi mercapturici.
Può anche essere metabolizzato ad acido lattico
e acido ossalico.
METABOLISMO DELL'1,2-DICLOROPROPANO
CH2ClCHClCH3
1,2-dicloropropano
[CH2ClCH+CH3]
CH2CHOHCOOH
acido lattico
CH2OHCHOHCH3
propano-1,2-diolo
CO2
NHR
O
CH2ClCHOHCH3
H2C - CHCH3
CH2CHOHCH2SCH2CHCOOH
1-cloro-2-idrossipropano
1,2-epossipropano
N-acetil-S(2-idrossipropil)cisteina
CHOCHOHCH2Cl
COOHCHOHCH2Cl
ß-clorolactaldeide
ß-clorolattato
O
[CH2OHCHOHCH2Cl]
[CH2OHCH - CH2]
3-cloropropanoil-1,2-diolo
2,3-epossipropano-1-olo
HOOC - COOH
ossalato
NHR
CH2OHCHOHCH2SCH2CHCOOH
N-acetil-S(2,3-diidrossipropil)cisteina
1,2-DICLOROPROPANO
TLVs (ppm)
TLV-TWA TLV-STEL ACGIH IARC R
75
110
A4
3
1,2-DICLOROPROPANO
TOSSICITA’
Modesto epatotossico e nefrotossico.
Nel fegato causa steatosi con formazione di
noduli iperplastici.
Nel rene causa effetti tubulari probabilmente via
ß-liasi o formazione di uno ione episulfonio.
L’inalazione cronica può causare una
glomerulonefrite da immunocomplessi del tipo
“self-limited-autoimmune-disease”
Inalato o ingerito in dosi massive causa necrosi
tubulare acuta e sindrome epato-renale.
TRICLOROETILENE
USI INDUSTRIALI:
1. Sgrassante per metalli
2. Pulitura a secco
TRICLOROETILENE
USI EXTRAINDUSTRIALI:
1. Smacchiatore (“trieline” commerciali)
TRICLOROETILENE
METABOLISMO
Assorbito per via inalatoria viene metabolizzato via
cit. P-450 a cloralio idrato e per successiva
ossidazione ad acido tricloroacetico e riduzione a
tricloroetanolo.
TRICLOROETILENE
METABOLISMO
In percentuale minima può essere direttamente
coniugato col glutatione per formare un cisteinconiugato (N-acetil-diclorovinil-cisteina).
TRICLOROETILENE
METABOLISMO
Più del 99% dei metaboliti urinari
tricloroetilene sono formati via cit. P-450:
come TCA
6-8%
come TCE libero
5-6%
come TCE coniugato
22-25%
come ossalato
0,6-0,8%
come cistein-coniugato 0,001%
del
METABOLISMO DEL TRICLOROETILENE
Cl
O
Cl
H
oss.
Cl
Cl
Cl
oss.
Cl
O
acido tricloroacetico
OH
Cl
Cl
C-C
Cl
rid.
OH
Cl
C-C
H
Cl
cloralio idrato
tricloroetilene ossido
tricloroetilene
O
Cl
C-C
C=C
Cl
Cl
H
H
C-C
Cl
H
tricloroetanolo
(libero o coniugato)
TRICLOROETILENE
TLVs (ppm)
TLV-TWA TLV-STEL ACGIH IARC R
50
100
A5
2a
TRICLOROETILENE
TOSSICITA’
Epato e nefrotossico.
La nefrotossicità è legata alla coniugazione col
glutatione
e
alla
formazione
dell’acido
premercapturico diclorovinilcisteina, attivato via ßliasi a tiochetene.
TRICLOROETILENE
MONITORAGGIO BIOLOGICO (BEI)
TCA urine fine settimana
100 mg/g creat.
TCA+TCE urine fine turno fine settimana 300 mg/g creat.
TRI sangue fine turno fine settimana
4 mg/L
INTENZIONI DI VARIAZIONE
TCA urine fine turno fine settimana
TRI sangue fine turno fine settimana
80 mg/L
2 mg/L
TETRACLOROETILENE
USI INDUSTRIALI:
1. Lavatura a secco
2. Sgrassante dei metalli
TETRACLOROETILENE
METABOLISMO
Il metabolismo del tetracloroetilene è molto
modesto:
TCA
1-2%
ossalato
0,2-0,3%
cistein-coniugati
0,02-0,04%
TETRACLOROETILENE
TLVs (ppm)
TLV-TWA TLV-STEL ACGIH IARC R
25
100
A3
2a
TETRACLOROETILENE
TOSSICITA’
Può causare danni epatici e renali.
La nefrotossicità è legata al metabolismo via acidi
mercapturici
con
formazione
dell’acido
premercapturico triclorovinilcisteina e attivazione
a tiochetene via ß-liasi
TETRACLOROETILENE
MONITORAGGIO BIOLOGICO (BEI)
PCE aria espirata (prima ultimo turno settimana) 3 ppm
PCE sangue (prima ultimo turno settimana)
0,5 mg/L
TCA urine (fine turno fine settimana)
3,5 mg/L
1,3-DICLOROPROPENE
USI INDUSTRIALI (agricoltura):
miscela tecnica dei due isomeri cis e trans
1. fumigante
2. nematocida
1,3-DICLOROPROPENE
METABOLISMO
dopo 24 h viene eliminato come tale nelle urine
l’80% dell’isomero cis e il 56% dell’isomero trans.
Il rimanente viene metabolizzato per il 92% ad
acido mercapturico: N-acetil-S-(3-cloroprop-2enil)cisteina.
Il 2% di ciascun isomero compare nelle feci.
1,3-DICLOROPROPENE
METABOLISMO
dopo 96 ore il 4% dell’isomero cis e il 24%
dell’isomero trans viene esalato come CO2.
1,3-DICLOROPROPENE
TLVs (ppm)
TLV-TWA TLV-STEL ACGIH IARC R
1
A3
annotazione skin
2b
45
1,3-DICLOROPROPENE
TOSSICITA’
Tossico epatico e renale.
Nell’uomo sono state osservate: congiuntiviti e
ustioni, astenia, difficoltà respiratoria, cefalea,
nausea.
ESACLORO-1:3-BUTADIENE
USI INDUSTRIALI:
1. Prodotto collaterale durante la sintesi di
idrocarburi clorurati, in particolare tricloro e
tetracloroetilene.
2. Recupero del cloro (gas) nell’industria chimica.
3. Fumigante dei vitigni.
ESACLORO-1:3-BUTADIENE
METABOLISMO
Il metabolismo in vivo è limitato, ma la via
metabolica preferenziale è quella degli acidi
mercapturici.
Il 60% viene eliminato immodificato con le feci e
l’aria espirata.
1-2% eliminato con le urine come cisteinconiugato
(acido
1,1,2,3,4-pentacloro-1:3butadiensulfenico)
METABOLISMO DELL’
ESACLORO-1:3-BUTADIENE
Cl Cl
Cl Cl
Cl
Cl
+ GSH
C=C-C=C
Cl
fegato
- glu
- gli
GS - C = C - C = C
piccolo intestino
bile
Cl
Cl Cl
Cl
rissorbimento
rene
Cl
Cl
NH2
Cl
Cl Cl
ß-liasi
NH3 + CH3COOH+ HS - C = C - C = C
Cl
Cl Cl
cellule
tubulari
Cl
CHCH2S - C = C - C = C
COOH
Cl
HOS - C = C - C = C
Cl
Cl Cl
Cl
Cl
lumen
GGT/peptidasi
ESACLORO-1:3-BUTADIENE
TLVs (ppm)
TLV-TWA TLV-STEL ACGIH IARC R
0,02
A3
annotazione skin
3
ESACLORO-1:3-BUTADIENE
TOSSICITA’
E’ un potente nefrotossico (la via
metabolica degli acidi mercapturici è in
causa) tramite l’attivazione via ß-liasi.
E’ un nefrocancerogeno sperimentale.
ESACLORO-1:3-BUTADIENE
DL50 p.o. ratti
250-350 mg/kg
DL50 i.p.
200 mg/kg
n-ESANO
USI INDUSTRIALI:
1. Solvente per grassi
2. Solvente colle nei calzaturifici
n-ESANO
METABOLISMO
Assorbito per via inalatoria e cutanea, si accumula nel
tessuto adiposo.
Viene eliminato come 2,5-esanedione.
METABOLISMO DELL' n-ESANO
CH3CH2CH2CH2CH2CH3
n-esano
(ω-1) ossidazione
HO
CH3CHCH2CH2CH2CH3
2-esanolo
( ω-1) ossidazione
CH3CHCH2CH2CHCH3
CH3CCH2CH2CH2CH3
O
OH
OH
2,5-esanediolo
2-esanone
CH3CCH2CH2CHCH3
O
OH
5-idrossil-2-esanone
CH3CCH2CH2CCH3
O
O
2,5-esanedione
n-ESANO
TLVs (ppm)
TLV-TWA TLV-STEL ACGIH IARC R
50
annotazione skin
n-ESANO
TOSSICITA’
L’esposizione acuta causa un effetto narcotico.
L’esposizione cronica causa neuropatia periferica.
La patogenesi è correlata alla formazione del
metabolita 2,5-esanedione che è chimicamente un γdichetone. I γ-dichetoni reagiscono con gli aminogruppi delle proteine per formare anelli pirrolici.
n-ESANO
TOSSICITA’
Il citoscheletro dell’assone, e in particolare dei
neurofilamenti, è costituito da proteine molto stabili che
sono quindi un bersaglio elettivo.
n-ESANO
MONITORAGGIO BIOLOGICO (BEI)
2,5-esanedione urine fine turno
valori di riferimento
0,4 mg/L
< 0,5 mg/g creat.
CICLOESANO
IMPIEGHI OCCUPAZIONALI
1. Industria calzaturiera
2. Industria gomma sintetica
3. Industria chimica
4. Industria cosmetica (solvente oli, grassi, cere,
resine)
CICLOESANO
METABOLISMO
Viene assorbito per via inalatoria.
Viene escreto nelle urine come cicloesanolo
(coniugato con acido glucuronico); raggiunge il
picco
nella
fase
prossima
al
termine
dell’esposizione e non è quantificabile 6-8 ore
dopo.
CICLOESANO
METABOLISMO
I principali metaboliti sono 1,2-cicloesanolo e 1,4cicloesanolo; 1,2-cicloesanolo (23% della dose)
viene escreto in concentrazione quasi doppia
rispetto a 1,4-cicloesanolo (11% della dose).
t/2 1,2-cicloesanolo
t/2 1,4-cicloesanolo
17 ore
16,1 ore
METABOLISMO DEL CICLOESANO
H2
H2
H2
H2
H2
H2
H2
H2
H2
H-OH
H2
H2
O
H2
H2
H2
H2
H2
cicloesanone
cicloesanolo
H2
H2
H2
H-OH
H2
H-OH
H2
trans-1,2-cicloesanolo
H2
H-OH
H2
H-OH
H2
trans-1,4-cicloesanolo
CICLOESANO
TLVs (ppm)
TLV-TWA TLV-STEL ACGIH IARC R
100
CICLOESANO
TOSSICITA’
Tossico per il sistema nervoso centrale e periferico
(vedi n-esano).
CICLOESANO
MONITORAGGIO BIOLOGICO
Non sono indicati limiti biologici e non sono noti
valori di riferimento.
In una casistica italiana è stato osservato un valore
medio di 1,2-cicloesanolo di 0,5 mg/g di creatinina
(range 0,1-2,7) e un range di 1,4-cicloesanolo
compreso tra 0,1 e 10,7.
SOLFURO DI CARBONIO
USI INDUSTRIALI:
1. Produzione della viscosa
2. Industria dei solventi e degli insetticidi
3. Lavorazione di oli e resine
SOLFURO DI CARBONIO
METABOLISMO
Viene assorbito per via inalatoria e cutanea.
Viene eliminato tal quale soprattutto per via
respiratoria e solo l’1% viene eliminato con le
urine. Il 50-90% viene metabolizzato.
Due vie metaboliche: la (1) porta alla formazione
di ditiocarbamati e a coniugati col glutatione, la
(2) dà origine a solfuri reattivi.
METABOLISMO DEL SOLFURO DI CARBONIO
GSH
S=C=S
solfuro di carbonio
HS - C - SG
aminoacidi (e.g. glicina)
HS - C - NCCH2COOH
ditiocarbamato
S
H2O
S
H2C - CH - COOH
O=C
C=S
S NH
C
S
acido tiazolidin-2-tio-4-carbossilico
H2C - CH - COOH
S NH
C
O
acido ossitiazolidin-4-carbossilico
H2C
NH
2-tio-5-tiazolidone
SOLFURO DI CARBONIO
TLVs (ppm)
TLV-TWA TLV-STEL ACGIH IARC R
10
annotazione skin
SOLFURO DI CARBONIO
TOSSICITA’
acuta: eccitazione, confusione mentale, disturbi
gastro-intestinali, incoscienza e coma.
cronica: danni organici del cervello, rilevanti
danni aterosclerotici, effetti coronarici e
ipertensione (infarto del miocardio).
SOLFURO DI CARBONIO
MONITORAGGIO BIOLOGICO
LBE:
solfuro di carbonio urinario fine turno primo
emiturno di lavoro
13,8 µg/L
valori di riferimento
0,25 µg/L
SOLFURO DI CARBONIO
MONITORAGGIO BIOLOGICO (BEI)
acido 2-tiotiazolidin-4-carbossilico urine fine
turno
5 mg/g creat.
valori di riferimento
< 1 mg/g creat.
SOLFURO DI CARBONIO
MONITORAGGIO BIOLOGICO (BEI)
i metaboliti individuati sono verosimilmente
responsabili della ormai obsoleta reazione di
Vasak o della iodio-azide:
2 NaN3 + I2 → 3 N2 + 2 NaI
SOLFURO DI CARBONIO
MONITORAGGIO BIOLOGICO (BEI)
Tale reazione è aspecifica ed è catalizzata dalle
urine degli esposti con decolorazione della
soluzione. Più rapida era la decolorazione,
maggiore era l’entità dell’esposizione.
METANOLO
Usi industriali: utilizzato nella produzione di
cellulosa, resine sintetiche, formaldeide, acido
acetico e carburanti
Usi extraindustriali: usato come solvente nei prodotti
domestici
METANOLO
METABOLISMO
La principale via di assorbimento è quella gastrointestinale.
In ambito occupazionale è quella inalatoria.
Viene metabolizzato ed escreto nelle urine sotto
forma di formaldeide e acido formico.
Il 30% viene eliminato immodificato per via
respiratoria.
METABOLISMO DEL METANOLO
H
H C OH
H
H
H C O
H C O
CO2
H2 O
H
metanolo
formaldeide acido formico
METANOLO
TLVs (ppm)
TLV-TWA TLV-STEL ACGIH IARC R
200
250
annotazione skin
METANOLO
TOSSICITA’
l’intossicazione causa in iniziale senso di ebbrezza,
un periodo asintomatico (12-24 ore), successiva,
marcata, acidosi metabolica
I problemi alla visione insorgono con dolore oculare,
oscuramento della visione, restrizione del campo
visivo. La cecità può svilupparsi entro 48 ore.
Bersaglio iniziale è la cellula di Müller (cellula gliale
della retina) da cui origina il danno retinico.
La tossicità è dovuta agli elevati livelli di acido
formico
METANOLO
MONITORAGGIO BIOLOGICO (BEI)
Metanolo urine fine turno
15 mg/L
valori di riferimento
< 1 mg/L
ACETONE
Usi industriali: intermedio di sintesi, presente in
colle, vernici, inchiostri
Usi extraindustriali: presente nei prodotti domestici,
nei pennarelli, nello smalto per unghie
ACETONE
METABOLISMO
La fonte di assorbimento è per via inalatoria (50%),
modesto è l’assorbimento cutaneo.
Viene metabolizzato a CO2 e acqua, in piccola parte
ad acetato e formiato
t/2 → 4,3 h
Escreto prevalentemente come CO2. Una piccola
percentuale escreto con le urine e l’aria espirata.
METABOLISMO DELL’ACETONE
O
H3C
C
CH3
O
OH
C
C H2
CH3
acetone
1-idrossiacetone
OH OH
O
O
C H2
C
C
HC
CH3
CH3 OH
propan-1,2-diolo acido piruvico
ACETONE
TLVs (ppm)
TLV-TWA TLV-STEL ACGIH IARC R
500
750
A4
ACETONE
TOSSICITA’
Effetto narcotico
In generale poco tossico
ACETONE
MONITORAGGIO BIOLOGICO (BEI)
acetone urine fine turno
50 mg/L
valori di riferimento
0,1-2 mg/L
METILETILCHETONE
USI INDUSTRIALI:
1. Produzione pitture, lacche, adesivi, vernici,
plastiche, gomma, pelli sintetiche, oli lubrificanti
2. Industria farmaceutica e cosmetica
3. Solvente colle industria calzaturiera
METILETILCHETONE
METABOLISMO
La principale via di assorbimento è quella inalatoria
(53% della dose). Mostra anche un rapido
assorbimento cutaneo (soprattutto se la pelle è
umida).
La via metabolica è poco nota, ma la maggior parte
viene eliminato come CO2 e acqua.
Una piccola quota non trasformata viene eliminata
immodificata con l’aria espirata.
In alcuni esposti è stata osservata l’eliminazione di
2,3-butandiolo e 3-idrossi-2-butanone.
METABOLISMO DEL
METILCHETONE
H3C
C
CH2
CH3
O
metiletilchetone
OH
H3C
CH
OH
CH
CH3
2,3-butandiolo
OH
H3C
C
CH
CH3
O
3-idrossi-2-butanone
METILETILCHETONE
TLVs (ppm)
TLV-TWA TLV-STEL ACGIH IARC R
200
300
METILETILCHETONE
TOSSICITA’
100 ppm causano irritazione prime vie aeree
200 ppm causano irritazione oculare
300 ppm causano cefalea
concentrazioni superiori causano depressione del
sistema nervoso centrale.
METILETILCHETONE
MONITORAGGIO BIOLOGICO (BEI)
metiletilchetone urine fine esposizione
2 mg/L
METIL-iso-BUTILCHETONE
Usi industriali: colle, coloranti, detergenti
Usi extraindustriali: solventi per bricolage
METIL-iso-BUTILCHETONE
METABOLISMO
La principale via di assorbimento è inalatoria.
Una piccola frazione è eliminata come tale con le
urine.
Il rimanente viene metabolizzato probabilmente a 4metil-2-pentanolo e 4-metil-4-idrossi-2-pentanone.
METABOLISMO DEL
METIL-iso-BUTILCHETONE
H3C
C
O
CH2 CH3
CH
CH3
metil-iso-butilchetone
H3C
CH2 CH3
CH CH
OH
CH3
4-metil-2-pentanolo
H 3C
C
CH2 CH3
CH
O
OH
4-metil-4-idrossi-2-pentanone
METIL-iso-BUTILCHETONE
TLVs (ppm)
TLV-TWA TLV-STEL ACGIH IARC R
50
75
METIL-iso-BUTILCHETONE
TOSSICITA’
Irritante delle prime vie aeree.
Può causare nausea e cefalea.
METIL-iso-BUTILCHETONE
MONITORAGGIO BIOLOGICO (BEI)
metil-iso-butilchetone urine fine esposizione
valori di riferimento
2 mg/L
< 0,1 mg/L
N,N’-DIMETILFORMAMIDE
ESPOSIZIONE LAVORATIVA
Utilizzato per la preparazione di tessuti e pelli sintetiche
ESPOSIZIONE EXTRALAVORATIVA
Presente in solventi utilizzati per le pulizie domestiche
N,N’-DIMETILFORMAMIDE
METABOLISMO
L’assorbimento prevalente è per via polmonare (70%),
ma anche cutanea.
Emivita plasmatica = 1 ora e si distribuisce in modo
omogeneo a tutto l’organismo.
N,N’-DIMETILFORMAMIDE
METABOLISMO
Viene principalmente biotrasformato in N-idrossimetilN-metilformamide,
in
minor
misura
in
Nmetilformamide ed escreta con le urine.
Altro metabolita urinario importante è il derivato
mercapturato N-acetil-S-(N-metilcarbamoil)cisteina.
N,N’-DIMETILFORMAMIDE
METABOLISMO
22,3% escreta come N-idrossimetil-N-metilformamide
13,2% escreta come N-idrossimetilformamide
13,4% escreta come N-acetil-S-(N-metilcarbamoil)cisteina
0,3% escreta come tale
METABOLISMO
DELL’N,N’-DIMETILFORMAMIDE
O
H
N
C
H
C
CH3
N
H2C
OH
N-idrossimetil-N-metilformamide
O
H
CH3
O
CH3
CH3
C
N
O
OH
H
N-metilformamide
O
CH2
C
H
N
N
C
NH2
formamide
O
C
H
H
N-idrossimetilformamide
CH3
metil-isocianato
N-metilcarbamoilvalina-emoglobina
S-coniugato col glutatione
S-coniugato con cisteinil-glicina
S-coniugato con cisteina
N-acetil-S-(N-metilcarbamoil)cisteina
N,N’-DIMETILFORMAMIDE
TLVs (ppm)
TLV-TWA TLV-STEL ACGIH IARC R
10
A4
annotazione skin
3
N,N’-DIMETILFORMAMIDE
TOSSICITA’
L’esposizione cronica può causare danni epatici e
pancreatici, oltre a sintomi respiratori (dispnea) e
gastrointestinali.
Causa irritazione congiuntivale.
N,N’-DIMETILFORMAMIDE
MONITORAGGIO BIOLOGICO
(ACGIH)
N-acetil-S-(N-metilcarbamoil)cisteina urine prima ultimo
turno della settimana
40 mg/L
valori di riferimento
< 40 µg/L
N,N’-DIMETILFORMAMIDE
MONITORAGGIO BIOLOGICO
(ACGIH)
N-metilformamide urine fine turno
10 mg/L
valori di riferimento
< 1 mg/L