REGOLAZIONE DELL’ATTIVITA’ ENZIMATICA
- Regolazione a lungo termine: la quantità di enzima può essere controllata
regolando la velocità della sua sintesi o degradazione (minuti o ore)
- Regolazione a breve termine (secondi o frazioni di secondo): l’attività enzimatica
varia in funzione di stimoli ambientali, primo fra tutti la concentrazione di substrato
e di prodotto, in secondo luogo attraverso dei meccanismi di modulazione
(regolazione).
Gli enzimi che subiscono modulazione controllano passaggi
chiave delle vie metaboliche, perciò vengono anche detti:
Enzimi regolatori (regolano la velocità delle reazioni metaboliche)
1) MODULAZIONE ALLOSTERICA NON-COVALENTE (REVERSIBILE)
2) MODULAZIONE COVALENTE (REVERSIBILE o IRREVERSIBILE)
MODULAZIONE COVALENTE: l’enzima che deve essere regolato (in positivo o
in negativo) subisce una modificazione post-traduzionale ad opera di altri
enzimi, che a loro volta possono essere regolati.
Modificazioni più comuni:
fosforilazioni (su residui di Ser, Thr, Tyr, His)
acetilazione (Lys, Ammino-terminale)
ubiquitinilazione (Lys)
metilazione (Lys, Arg)
Altre……..
Ad opera di
► Chinasi
► Acetilasi
► Proteosoma
► Metilasi
La fosforilazione di residui di Ser, Thr, Tyr o His è la forma più comune
di modulazione covalente,
è controllata da 2 tipi di enzimi modificatori: CHINASI e FOSFATASI
Una proteina-chinasi trasferisce
un gruppo fosforico dall’ATP sul
sito di fosforilazione dell’enzima
2 subunità ciascuna
con un sito di
fosforilazione
Glicogenofosforilasi b
(meno attiva)
Una proteina-fosfatasi rimuove
il gruppo fosforico dall’enzima.
Proteina-chinasi e proteinafosfatasi sono a loro volta
regolate e in genere inserite in
una cascata di fosforilazioni
innescate da un segnale.
Fosforilasifosfatasi
LA FOSFORILAZIONE PUÒ
INIBIRE O ATTIVARE
L’ENZIMA.
Fosforilasichinasi
Glicogenofosforilasi a (più
attiva)
DEGRADAZIONE DEL GLICOGENO
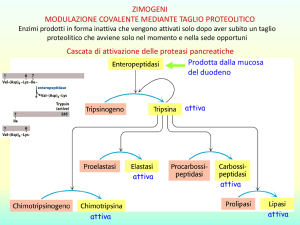
ZIMOGENI
MODULAZIONE COVALENTE MEDIANTE TAGLIO PROTEOLITICO
Enzimi prodotti in forma inattiva che vengono attivati solo dopo aver subito un taglio
proteolitico che avviene solo nel momento e nella sede opportuni
Cascata di attivazione delle proteasi pancreatiche
Prodotta dalla mucosa
del duodeno
attiva
attiva
attiva
attiva
attiva
MODULAZIONE ALLOSTERICA NON-COVALENTE
Enzimi allosterici: attività catalitica influenzata da cambiamenti della loro struttura
Aggiungendo ancora
substrato:
transizione T > R
completa
1) Hanno più subunità e più siti
attivi per il substrato
2) Legano le molecole di
substrato in modo cooperativo
3) Subiscono una transizione
dallo stato T allo stato R
4) NON seguono la cinetica di
Michaelis-Menten
Assenza di substrato
Enzima
stato T
meno affine
[S] aumenta: Il legame con le prime molecole di S
induce cambiamenti conformazionali che convertono
in modo cooperativo le subunità dell’enzima dallo
stato T allo stato R
Substrato = modulatore omotropico positivo dell’enzima
Gli enzimi allosterici possono essere
regolati controllando la concentrazione di
substrato
S
ET
Il substrato influenza l’equilibrio fra stato
a bassa affinità e stato ad alta affinità.
L’affinità dell’enzima per il
substrato è data dalla K0.5
E RS
S
Vmax
[S] che permette di raggiungere
metà della Velocità massima di
reazione
Equazione cinetica:
v0 =
Vmax [S]n
K0.5n + [S]n
K0.5
Regolazione eteroallosterica
MODULATORI ALLOSTERICI POSITIVI (ATTIVATORI)
MODULARORI ALLOSTERICI NEGATIVI (INIBITORI)
Possono modificare la K0,5 o la Vmax o entrambe
Cambia la K0,5 ma non la Vmax
+ attivatore
Cambia la Vmax ma non la K0,5
+ attivatore
+ inibitore
+ inibitore
Modulatori eteroallosterici
1) Si legano in siti diversi dal sito attivo = SITI REGOLATORI.
2) Il legame con il modulatore altera la struttura dell’enzima che nella nuova
conformazione ha proprietà cinetiche differenti.
3) Il legame modulatore/enzima è sempre NON-covalente e reversibile.
4) Un inibitore allosterico favorisce
la forma dell’enzima con minore
affinità per il substrato
stabilizzandola.
5) Un attivatore allosterico
favorisce la forma R dell’enzima
rendendola molto più affine al
substrato
Sito
catalitico
Sito
regolatore
substrato
Attivatore
Enzima Stato T
inattivo
Legame con attivatore
Enzima Stato R
Complesso Enzima
attivo-substrato
Esempio di modulazione allosterica: la PKA, coinvolta nella trasduzione del segnale
attraverso la membrana plasmatica che attiva l’adenilato ciclasi.
AMP ciclico
PPi
(5’3’-adenosina-monofosfato)
ATP
Adenilato ciclasi
Attivatore allosterico della PKA (proteinachinasi A, fosforila varie proteine target)
PKA: 2 domini REGOLATORI (ciascuno con 2 siti di legame per il cAMP)
2 domini CATALITICI
PKA attiva
PKA inattiva
PKA attiva
Berg et al., BIOCHIMICA 6/E, zanichelli editore S.p.A. Copyright © 2007
La modulazione di un enzima allosterico è
utilizzata nel meccanismo della
RETROINIBIZIONE (inibizione a feed back)
In un processo metabolico multistep il primo
enzima della via è un enzima allosterico che
viene inibito allostericamente dal prodotto
che si ottiene nell’ultima reazione della via.
Sintesi di Isoleucina a partire da Treonina:
processo in 5 reazioni.
La prima è catalizzata dalla treonina
deidratasi che è inibita allostericamente
dalla Isoleucina (prodotto finale)