Focus sulla Sclerosi Laterale Amiotrofica,
Palazzo Reale Caserta, 11-12 maggio 2012
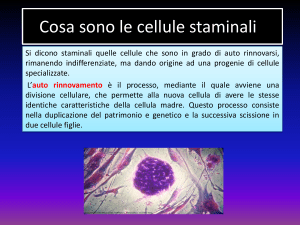
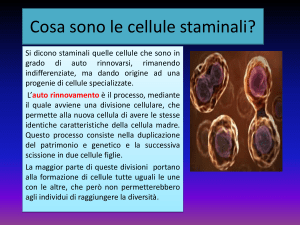
CELLULE STAMINALI e
MALATTIE DEL MOTONEURONE
Massimo Corbo
Centro Clinico NEMO
(NEuro Muscular Omnicentre)
Centro Clinico ad alta specializzazione per lo studio e la cura delle
distrofie muscolari e delle altre patologie neuromuscolari.
Ospedale Niguarda Ca’ Granda – Milano
•
Stem cells in ALS
2006
Silani et al., Lancet, 2004
Amniotic cells
Strategia complessa:
– Scelta del donatore (autologo vs allogenico)
– Scelta del tipo di SC (neurali vs non-neurali)
– SC mantenute e amplificate in vitro (inalterate)
– SC transdifferenziate (se non-neurali) o
geneticamente modificate (rilascio di fattori trofici)
– Associate a terapie specifiche
– Sito e via di iniezione delle SC
Replacement or Protection?
• R è il fine ultimo per la maggior parte delle MND
maggiori ostacoli:
• la sopravvivenza delle cellule
• l’ottenimento di unità motorie funzionalmente
valide
• l’ottenimento di proiezioni a lunga distanza
connesse con i muscoli
• P dei rimanenti MN in corso di degenerazione
più realistica
Cellule Staminali Embrionali (ES cells)
hanno il più alto potenziale per la ricerca biomedica e
clinica
in grado di autorinnovarsi illimitatamente
capacità di differenziarsi in tutti i tipi di cellule
somatiche
fonte illimitata di cellule e tessuti per malattie
disabilitanti o degenerative
• modelli animali di lesioni del midollo spinale (Keirstead et
al, 2005; Sharp et al, 2010), retinopatie (Lamba et al,
2009) e malattia di Parkinson (Yang et al, 2008):
→ FDA ha approvato trial con hES cell progenitors
per il trattamento dei Pz con lesioni midollari spinali e
retinopatie congenite
Cellule staminali embrionali
ES cell-derived MNs
• Grande potenziale proliferativo
• Si differenziano esprimendo marker MN (ChAT)
• Acquisiscono proprietà elettrofisiologiche dei MN maturi
• Assoni si estendono alla periferia e formano giunzioni neuromuscolari (embrioni di pollo)
• Dopo trapianto intraspinale formano unità motorie funzionali (ratto)
• Miglioramento motorio del ratto SOD1G93A ↔ mancata sopravvivenza dell’innesto (istologia)
Replacement
• Effetti positivi sono attribuiti alla generazione di MNlike cells
La strategia del R necessita da parte delle SC
trapiantate:
• la formazione di lunghi tratti di crescita assonale
• la formazione di giunzioni neuromuscolari
funzionalmente attive (solo 2 lavori l’hanno dimostrata)
Punto critico: distanza (animali più grandi: primati)
• presenza di altre cellule neuronali o non-neuronali (gliali) nel
trapianto secernenti fattori di crescita o in grado di creare
connessioni modulanti la funzione e la sopravvivenza dei MN
residui ⇒ effetti collaterali
Motor Neuron Protection
rather than Replacement?
Coinvolgimento extraneuronale:
nuovi protagonisti
• Negli ultimi anni si sono accumulate prove
del coinvolgimento ‘attivo’ di cellule
extraneuronali nei meccanismi che sono
alla base del processo degenerativo della
SLA.
Nei topi chimerici che
presentano cellule normali e
cellule che esprimono la
SOD1 mutante, è stato
dimostrato che la tossicità
per i motoneuroni richiede
che la SOD1 mutante sia
espressa anche nelle
cellule non neuronali (glia).
L’espressione della SOD1
mutante nei motoneuroni è
essenziale per lo sviluppo
della malattia, mentre la
riduzione dell’espressione
della SOD1 mutante nella
microglia riduce nettamente
la progressione della
malattia in fase avanzata
Impiego di cellule non-neurali per sostenere i MN morenti
• Microglia: 10% della popolazione del cervello e del midollo
spinale; di origine mieloide (SC di derivazione ematopoietica)
• Wild-type bone marrow transplantation in topi modello della
SLA familiare
aumenta la sopravvivenza
diminuzione della degenerazione di MN
• SC mesenchimali: non ematopoietiche, multipotenti;
- facili da isolare
- possono essere trapiantate come autologhe
- si indirizzano nelle zone di sofferenza cellulare
- si differenziano sulla linea mesench.: osso, cartilagine, etc
- anche verso cellule “astrocytic like” e “neuronal like”
• Effetti protettivi: produzione di Fattori Trofici
↓ gliosi e infiammazione neuroprotezione
Studi di trapianto cellulare nei modelli animali di MND
Studi di trapianto cellulare nei modelli animali di MND
Stem-cell therapy in
humans: Italy
Safety and Immunological Effects of Mesenchymal Stem Cell
Transplantation in Patients With Multiple Sclerosis and
Amyotrophic Lateral Sclerosis
Dimitrios Karussis, MD, PhD; Clementine Karageorgiou, MD; Adi Vaknin-Dembinsky, MD, PhD;
Basan Gowda-Kurkalli, PhD; John M. Gomori, MD; Ibrahim Kassis, MSc; Jeff W. M. Bulte, PhD;
Panayiota Petrou, MD; Tamir Ben-Hur, MD, PhD; Oded Abramsky, MD, PhD; Shimon Slavin,
MD
Arch Neurol. 2010;67(10):1187-1194. doi:10.1001/archneurol.2010.248
ABSTRACT
Objective To evaluate the feasibility, safety, and immunological effects of intrathecal and
intravenous administration of autologous mesenchymal stem cells (MSCs) (also called
mesenchymal stromal cells) in patients with multiple sclerosis (MS) and amyotrophic lateral
sclerosis (ALS).
Design A phase 1/2 open-safety clinical trial.
Patients Fifteen patients with MS (mean [SD] Expanded Disability Status Scale [EDSS] score,
6.7 [1.0]) and 19 with ALS (mean [SD] Amyotrophic Lateral Sclerosis Functional Rating Scale
[ALSFRS] score, 20.8 [8.0]) were enrolled.
Intervention After culture, a mean (SD) of 63.2 x 106 (2.5 x 106) MSCs was injected
intrathecally (n = 34) and intravenously (n = 14). In 9 cases, MSCs were magnetically labeled
with the superparamagnetic iron oxide ferumoxides (Feridex).
Main Outcome Measures The main outcome measure was the recording of side effects.
Follow-up ( 25 months) included adverse events evaluation, neurological disability assessment
by means of the EDSS, magnetic resonance imaging to exclude unexpected pathologies and
track the labeled stem cells, and immunological tests to assess the short-term
immunomodulatory effects of MSC transplantation.
Clinical follow-up of patients with multiple sclerosis
(MS) and amyotrophic lateral sclerosis (ALS) after
transplantation of mesenchymal stem cells (MSCs)
Karussis, D. et al. Arch Neurol 2010;67:1187-1194.
Magnetic resonance imaging after
injection of ferumoxides-labeled
mesenchymal stem cells
Karussis,
D.restrictions
et al. Arch
Neurol 2010;67:1187-1194.
Copyright
may apply.
A 3-T diffusion-weighted axial magnetic resonance imaging scan of the brain shows hyperintense signals in the
occipital horns of the brain ventricles, indicating the presence of dependent transplanted cells that were not
magnetically labeled
Karussis, D. et al. Arch Neurol 2010;67:1187-1194.
Copyright restrictions may apply.
Immunological effects in patients with multiple sclerosis (MS) and amyotrophic lateral sclerosis (ALS) injected
intravenously and intrathecally with mesenchymal stem cells (MSCs)
Karussis, D. et al. Arch Neurol 2010;67:1187-1194.
Copyright restrictions may apply.
Italian Ministery of Health
Autologous
Clinical Trial
G-CSF, then mannitol
G-CSF (Lenograstim)
RAZIONALE: potenzialità di cellule
staminali adulte midollari
(passaggio BEE?)
STUDIO: SSLA 40-65 anni,
SLA definita, probabile, prob+lab,
SLA < 12 mesi,
ALS-FRS-R > 3 in 3 items,
in Riluzolo
4 Pazienti per Centro (7)
EP: sicurezza e tollerabilità
ES: efficacia
STUDIO attuato (Torino, Genova, Milano,
Palermo, Pavia, Pisa, Roma)
HSCT for ALS
Blanco et al. 2005
J Clin Invest (2005)
The hematopoietic factor G-CSF is a neuronal ligand that counteracts
programmed cell death and drives neurogenesis.
Schneider A, Kru¨ger C, Steigleder T, et al.
G-CSF and G-CSFR are widely expressed in CNS neurons and their expression is induced
by ischemia.
G-CSF markedly improved long-term outcomes after cerebral ischemia in rats and G-CSF
not only had antiapoptotic activity, but also stimulated neurogenesis.
Impiego di cellule neurali per sostenere i MN morenti
• Tessuto nervoso: fonte naturale di cellule per le MND
• Le cellule staminali neurali (NSCs) sono state isolate sia
dalla corteccia sia dal midollo spinale da feti umani postmortem
• Le cellule derivate dalla corteccia fetale crescono in coltura in
forma di aggregati, noti come “neurosfere” (hNPC)
- hanno una sopravvivenza limitata
- dopo diversi passaggi si differenziano in astrociti (e neuroni)
- non formano teratomi: a differenza delle embrionali e dell’iPS
• Se il neurone non è il primo fine, le hNPC sono più utilizzabili
Studi di trapianto cellulare nei modelli animali di MND
Cellule staminali embrionali
Incompatibilità immunologica dovuta all’incremento di
espressione delle molecole del MHC durante la
differenzazione delle cellule embrionali (hES cells)
Clonazione
terapeutica:
trasferimento del
nucleo di una
cellula somatica
(SCNT)
Fusione cellulare
SCNT e Fusione Cellulare non
risolvono completamente il
problema della reazione
immunologica del trapianto
allogenico di progenitori derivati da
cellule embrionali né il problema
etico per la distruzione di embrioni
e oociti.
Equivalenti funzionali delle Cellule Staminali Embrionali
Identificazione di pluripotency-inducing factors
In 2006, Takahashi and Yamanaka:
attraverso l’over-expression della combinazione di solo
4 fattori di trascrizione: octamer 3/4 (Oct4),
SRY box–containing gene 2 (Sox2),
Kruppel-like factor 4 (Klf4),
c-Myc
• sufficienti a riprogrammare dei fibroblasti murini verso uno stato
simil-embrionico induced pluripotent stem (iPS cells)
pochi mesi dopo, da fibroblasti umani hiPS cells
nel 2007-2008, Yu et al e Park et al con una combinazione di
geni lievemente diversa
POU5F1 (OCT4),
• Cellule somatiche umane riprogrammate
SOX2,
NANOG,
LIN28A (LIN28)
iPS cells
Simili alle cellule staminali embrionali (hES cells)
- per morfologia, proprietà di crescita ed espressione
dei marker fenotipici
- possibilità di differenziarsi in linee cellulari multiple
con lo stesso livello di efficienza delle hES cells
La riprogrammazione molecolare è un metodo
elegante per generare cellule staminali pluripotenti,
ma rimane un processo poco compreso e altamente
inefficiente (cellule somatiche umane: 1/1000)
Vantaggi potenziali delle iPS cells
• Derivate dai fibroblasti o B linfociti (non necessitano
embrioni o oociti) non comportano problemi etici e/o
politici
• Il metodo per generare iPS cells è relativamente semplice
e eseguibile dalla maggior parte di laboratori che usano
tecniche e strumentazione standard
Banche di iPS cells sono ottenute da volontari sani di
differenti età, origini etniche e sesso.
utilità per gli studi di screening farmacologici per
una miglior predizione delle tossicologie
generate da Pz possono dare disease/mutation
specific cell lines SLA, m. di Parkinson e SMA
iPS cells nel trattamento della sickle cell disease
Neuroni dopaminergici derivati dalle iPS cells funzionalmente
integrati nel cervello di ratti adulti con malattia di Parkinson
significativo miglioramento sintomatico (Yang et.al, 2008)
Cellule endoteliali derivate dalle iPS cells funzionalmente
normali iniettate in topi con emofilia A incremento
significativo dei plasmatici livelli del fattore VIII e correzione
della diatesi emorragica (Xu et.al, 2009)
Cellule Staminali (SC):
terapia per le Malattie Neurodegenerative
1) Definire la competitività della terapia con SC:
rischio accettabile per il Pz
malattie a vario grado di disabilità: PD, ALS
terapie a differente efficacia
sicurezza delle SC:
proliferazione e differenzazione difficili da
controllare
i modelli animali non predicono:
- la tossicità,
- l’insorgenza di una risposta biologica (immunitaria),
- il rischio di un tumore dopo l’impianto nel Pz.
Cellule staminali (SC):
terapia per le Malattie Neurodegenerative
2) Determinare quale cellula deve essere generata dalle SC:
patologia della malattia
terapia basata sul rimpiazzo cellulare:
cellule differenti per differenti malattie
PD neuroni dopaminergici (DA); ALS motoneuroni
la patologia della malattia può colpire le cellule derivate
dalle SC trapiantate:
tessuto mesencefalico embrionale impiantato nei Pz
con PD
cloni terapeutici (ES cells con nucleo da cellule
somatiche) o iPSc
maggior suscettibilità al processo patologico.
Cellule staminali (SC):
terapia per le Malattie Neurodegenerative
3) Dimostrare nei modelli animali che l’uso delle SC da un
miglioramento significativo dei deficit funzionali:
prima dell’applicazione clinica
il comportamento delle SC in vitro o nell’animale può esser
diverso di quello nel Pz
il modello animale non mima tutti gli aspetti della patologia
umana mancata efficacia delle SC nei trial clinici
4) Determinare il meccanismo biologico responsabile degli
effetti di un trattamento con SC nel modello animale:
rimpiazzo cellulare
ripristino (parziale) della circuiteria neuronale PD
immunomodulazione, neuroprotezione per soppressione di
meccanismi proinfiammatori NSCs verso le lesioni
demielinizzanti
Terapia con Cellule Staminali nella M. di Parkinson
Terapie con Cellule Staminali nella Sclerosi Laterale Amiotrofica
Massimo Corbo,
Neurologist (clinical director)
Fabrizio Rao,
pulmonologist
Christian Lunetta,
neurologist
Mario Melazzini
scientific director
Alberto Fontana
president
Nadia Cellotto,
Physiatrist
Ksenjia Gorni,
child neurologist
Elisabetta Roma
pulmonologist
Gabriella Rossi,
psychologist
Eleonora Maestri,
data manager
Donatella Pozzi,
head nurse
Physiotherapists
Grazie per l’attenzione