LEUCEMIA MIELOIDE CRONICA: LA STORIA
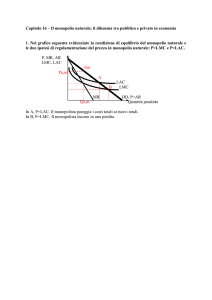
La leucemia mieloide cronica (LMC) è stata descritta per la prima volta da scienziati
inglesi e tedeschi nel 18451, che osservarono la morte dei pazienti colpiti dalla malattia
entro 12 mesi dalla diagnosi. Dopo più di 100 anni, arrivando ai nostri giorni, la
prospettiva per i pazienti con LMC è completamente cambiata. La ricerca ha portato
allo sviluppo di nuove opzioni terapeutiche che colpiscono selettivamente le basi
molecolari della malattia rendendo la sopravvivenza un obiettivo reale per il paziente.
La storia dell’evoluzione nella gestione della LMC è un cardine della medicina.
L’importanza del modo in cui la malattia è attualmente trattata va oltre i confini della
LMC e del cancro.
La leucemia mieloide cronica è una malattia progressiva caratterizzata da una serie di
fasi: 1) fase cronica; 2) fase accelerata; 3) fase blastica. Senza alcun trattamento, la
progressione attraverso ogni fase è inevitabile e fino a poco fa la LMC era una malattia
terminale per i pazienti2.
Le opzioni di trattamento disponibili per la gestione della LMC alla fine dell’Ottocento
e all’inizio del Novecento erano insoddisfacenti. Prima degli anni Cinquanta, era
utilizzata la radiazione della milza ma era poco efficace o prolungava la sopravvivenza
di circa 30 mesi. Negli anni Quaranta furono introdotti i derivati del gas mostarda e in
qualche caso prolungarono le aspettative di vita. Comunque si era ancora distanti dal
curare le cause della malattia. Negli anni Cinquanta la radioterapia fu sostituita dal
busulfano, una chemioterapia basata sull’agente alchilante. Questa cura fu popolare per
alcuni anni e aiutò a prolungare la sopravvivenza da 2,5 a 3,5 anni. Ma oggi questa cura
non è più usata per la gestione cronica della malattia. Successivamente, l’idrossiurea,
agente antineoplastico, sostituì il busulfano3.
La LMC ha un tratto distintivo, la presenza del cromosoma Philadelphia. Con la
scoperta di questa caratteristica da parte di Nowell e Hungerford negli anni Sessanta,
per la prima volta si collegò la mutazione genetica alla malattia. Anche se ciò non ebbe
un effetto immediato a quel tempo sui pazienti, fu un momento determinante nella
comprensione scientifica della biologia del cancro e rappresentò un passo importante
per i ricercatori nella studio di nuovi interventi terapeutici4.
All’inizio degli anni Ottanta, vi furono due grandi progressi: i trapianti di cellule
staminali da midollo osseo, e l’introduzione della terapia con interferone alfa. Nel 1956
il primo trapianto di midollo osseo ebbe luogo tra due gemelli monozigoti. Anche se la
mortalità era alta, si dimostrò che per la prima volta la LMC poteva essere curata 5. Con
l’introduzione dell’interferone si ebbe il primo agente sperimentato per sopprimere il
cromosoma Philadelphia nel midollo osseo. Presto divenne il trattamento di scelta per
quei pazienti non idonei al trapianto di cellule staminali allogeniche6.
Ci vollero 24 anni dopo la scoperta del cromosoma Philadelphia perché fosse definito il
gene collegato all’anomalia cromosomica, il gene BCR-ABL. Il prodotto di questo
gene, la proteina di fusione BCR-ABL, è una tirosin-chinasi, un enzima coinvolto nella
segnalazione cellulare. Da un punto di vista terapeutico, gli enzimi possono essere più
facilmente ostacolati rispetto a altri tipi di proteina – la capacità di neutralizzarlo era
quindi una vera possibilità7.
Nel 1998 vi fu un passo in avanti allorché fu usato su un paziente il primo inibitore della
tirosin-chinasi, l’imatinib8. Sfortunatamente la resistenza alla cura cominciò ad
emergere e fu associata alla riattivazione del segnale BCR-ABL9. Negli ultimi anni, per
superare i limiti correlati a questo precursore, i ricercatori biomolecolari hanno
concentrato i propri sforzi nel migliorare e superare i limiti della terapia standard, e
dunque trovare molecole capaci di essere efficaci anche nei pazienti resistenti.
Dasatinib, che nel 2007 ha ricevuto l’autorizzazione all’immissione in commercio da
parte delle autorità europee, rappresenta l’evoluzione di questo concetto. Questa
molecola, infatti, mostra una maggior affinità per la proteina BCR-ABL e ciò si riflette
in una efficacia terapeutica anche nei pazienti con LMC resistenti o intolleranti.
L’esecuzione di test mutazionali sui pazienti affetti da Leucemia Mieloide Cronica,
resistenti a imatinib, è particolarmente importante per determinare se sono presenti
mutazioni nelle proteine BCR-ABL e per adottare strategie terapeutiche alternative.
Ulteriori informazioni:
1
Randolph T. Chronic Myelocytic Leukemia - Part I: History, clinical presentation, and
molecular biology. Clin Lab Sci. 2005;18(1):38-48
2
Jabbour E et al. Targeted therapy in chronic myeloid leukemia. Expert Rev Anticancer
Ther 2008;8(1):99-110
3
Geary CG. The story of chronic myeloid leukaemia. Br J Haematol. 2000;110(1):2-11
4
Randolph T. Chronic Myelocytic Leukemia - Part I: History, clinical presentation, and
molecular biology. Clin Lab Sci. 2005;18(1):38-48
5
Biotechnology Learning Hub. Timeline for bone marrow transplants.
Available at: http://www.biotechlearn.org.nz/themes/biotech_therapies/timeline_for_
bone_marrow_transplants (Last accessed June 2008)
6
Mughal TI et al. Chronic myeloid leukemia: current status and controversies.
Onc. 2004;18(7):837-844
7
Druker BJ. Investigator profile. J Hematother Stem Cell Res. 2001;10(6):721-724
8
Druker BJ. Investigator profile. J Hematother Stem Cell Res. 2001;10(6):721-724
9
Gorre ME et al. Clinical resistance to STI-571 cancer therapy caused by BCR-ABL gene
mutation or amplification. Science. 2001;293(5531):876-880