Cinetica enzimatica
Cenni alla cinetica delle reazioni
•
•
•
•
•
Velocita’ di reazione
Reazioni di I° e II° ordine
Molecolarita’ di una reazione
Molecolarita
t1/2
Velocita’ e costanti di equilibrio
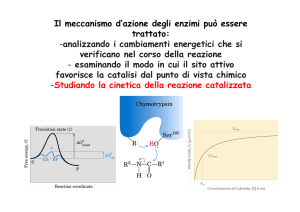
CINETICA ENZIMATICA
OVVERO:
LO STUDIO DELLA VELOCITA’ DI REAZIONE
FATTORI CHE INFLUENZANO LA VELOCITA’ DI
REAZIONE:
-Concentrazione del substrato
-Concentrazione dell’enzima
-pH
-Temperatura
-Inibitori, Attivatori
-Concentrazione
Co ce t a o e dei
de Sali
Sa ((forza
o a ionica)
o ca)
La velocità di una reazione
enzimatica
i ti iin ffunzione
i
d
della
ll
concentrazione del substrato
(D. Voet, J.G. Voet, Biochemistry, 3° ed., John Wiley & Sons, 2004)
Teoria di Michaelis e Menten
Teoria di Briggs e Haldane
(Teoria dello “stato
stato stazionario”)
stazionario )
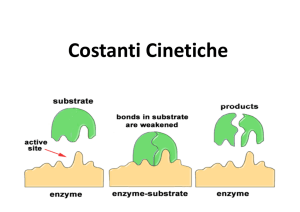
E+S
ES
E+P
(D. Voet, J.G. Voet, Biochemistry, 3° ed., John Wiley & Sons, 2004)
k1
E+S
k2
ES
E+P
Dove:
k-1
e se:
d[ES]
= 0 = k1[E][S ] − k2 [ES] − k−1[ES]
dt
sostituendo con : [E ] = [E0 ] − [ES ]
[ES ] = k +[Ek0 ][S ]
2
−1
+ [S ]
k1
k [E ][S ]
v = cat 0
k 2 + k −1
+ [S ]
ma p
poiché:
k2 = kcat
k2
≥ k-1
v = kcat [ES ]
k1
Questa è l’equazione di Michaelis-Menten, dove:
k 2 + k −1
KM =
k1
Equazione di Michaelis e Menten
k cat [E 0 ][S ]
v=
K M + [S ]
dove:
k cat [E0 ] = Vmax
La concentrazione del substrato alla quale
è denominata
KM
1
v = V max
2
, la costante di Michaelis.
Notare che a basse [S] , dove [S] << KM :
k cat
v =
KM
[E 0 ][S ]
Poiché KS per la dissociazione di [ES] è uguale a
si ha:
k
KM = KS +
2
k −1
k1
k1
E’ chiaro che quando k-11>> k2, ll’equazione
E
equazione si semplifica a:
KM = KS
Se : kcat [E0 ] = Vmax si ha che :
v=
Vmax [S ]
da cui :
K M + [S ]
[S] >> K M ,
v = Vmax
Vmax
[S ] << K M , v =
× [S ]
KM
Vmax
[S ] = K M , v =
2
k1
E+S
k2
ES
E+P
e:
k-1
[E ][S ] = K
[ES ] S
v = k cat [ES ]
[E] = [E0 ] − [ES] da cui :
[
E 0 ][S ]
[ES ] =
K S + [S ]
Dove: k2 = kcat <<
e
k −1
k1
k-1
= KS
kcat [E0 ][S ]
v=
K S + [S ]
Quest ultima equazione è uguale a quella iniziale
Quest’ultima
iniziale, dove
KM è uguale alla costante di dissociazione del
p
enzima-substrato,, KS .
complesso
(D.L. Nelson, M.M. Cox, Lehninger Principles
of Biochemistry, 4th ed., W.H. Freeman &
Co., 2005)
Dato:
Vmax [S ]
v=
K M + [S ]
prendendo i reciproci :
1 ⎛ KM ⎞ 1
1
⎟⎟
= ⎜⎜
+
v ⎝ Vmax ⎠ [S ] Vmax
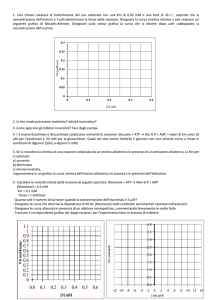
Grafico
fi di Lineweaver
i
e Burk
k ((o ddeii reciproci)
i
i)
v
+ Vmax
v = −KM
[S ]
G fi di Eadie
Grafico
E di e Hofstee
H f
(D. Voet, J.G. Voet, Biochemistry, 3° ed., John Wiley & Sons, 2004)
(A. Fersht, Structure and mechanism in protein science, W.H.
Freeman & Co., 1999)
Il significato
g
dei pparametri di Michaelis e Menten:
kcat :
-
nell semplice
li meccanismo
i
di Michaelis
Mi h li e Menten
M
in
i cuii vii è un solo
l
complesso enzima-substrato e tutte gli steps di “binding” sono veloci,
kcat è semplicemente la costante di I° ordine per la conversione
chimica del complesso ES nel complesso EP;
-
(per reazioni più complesse, kcat è una funzione di tutte le costanti di I° ordine e non può
essere assegnata
g
a un particolare
p
processo
p
eccetto quando
q
intervengano
g
delle
semplificazioni;)
-
kcat
Vmax
=
[E0 ]
, questa quantità è detta anche numero di turnover
perché rappresenta
p
pp
il numero massimo di molecole di substrato
convertite in prodotto per sito attivo nell’unità di tempo (o il numero
di volte che l’enzima ‘turns over’ per unità di tempo.
KM :
-sebbene
sebbene valida
alida per il semplice meccanismo di Michaelis e Menten o in casi in
cui comunque KM = KS, la vera costante di dissociazione del complesso enzimasubstrato, KM può essere considerata in qualche caso come una costante di
di
dissociazione
i i
apparente.
-KM è unica per ogni coppia enzima-substrato. Substrati differenti che reagiscono
con uno stesso enzima hanno KM differenti; così come enzimi differenti che
agiscono su uno stesso substrato hanno KM differenti.
-In reazioni enzimatiche dove esistono più complessi ES, KM rappresenta comunque la quantità di
enzima legato sotto qualsiasi forma al substrato.
-In
I tuttii i casii KM è la
l concentrazione
i
del
d l substrato
b
alla
ll quale:
l
KM
Vmax
v=
2
è una costante di dissociazione apparente che può essere considerata come la costante di
dissociazione complessiva di tutte le specie di enzima legato.
kcat/KM:
quando
[S ] << K
M
, ES si forma in quantità minima. Di conseguenza,
[E ] ≈ [E0 ]
kcat [E0 ][S ] kcat
≈
× [E ][S ]
v=
KM
KM
In questo caso, kcat/KM è la costante apparente di secondo ordine
della reazione enzimatica; la velocità della reazione varia direttamente in
proporzione a quante volte enzima e substrato si incontrano in soluzione.
Questa quantità è quindi una misura dell’efficienza catalitica dell’enzima.
Vi è un limite superiore al valore di kcat/KM : esso non può essere più
grande di k1, cioè la decomposizione di ES a dare E +P non può avvenire
con maggior frequenza di quanto E ed S si uniscono a formare ES
ES.
Gli enzimi più efficienti hanno valori di kcat/KM prossimi al limite di
diffusione di 108 -109 M-1 x sec-1.
Praticamente l’enzima catalizza una reazione ogni volta che esso
incontra una molecola di substrato.
kcat : numero di micromoli di S convertite in P per secondo da
una micromole di enzima operante in condizioni saturanti di S
S.
KS
K
K’
k1
k2
k3
E+S
ES
k-11
ES’
k-22
k4
ES”
k-33
k5
EP’
k-44
k6
EP”
k-55
E+P
k-66
(D. Voet, J.G. Voet, Biochemistry, 3° ed., John Wiley & Sons, 2004)
(D. Voet, J.G. Voet, Biochemistry, 3° ed., John Wiley & Sons, 2004)
(D. Voet, J.G. Voet, Biochemistry, 3° ed., John Wiley & Sons, 2004)