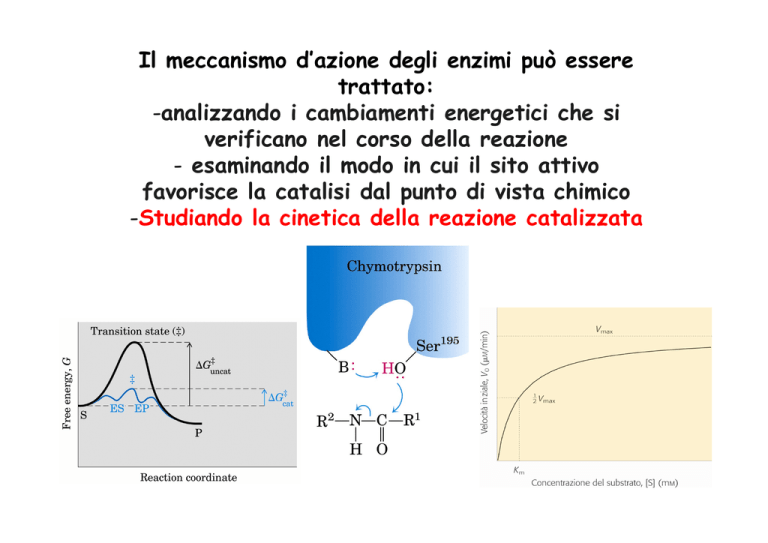
Il meccanismo d’azione degli enzimi può essere
trattato:
-analizzando i cambiamenti energetici che si
verificano nel corso della reazione
- esaminando il modo in cui il sito attivo
favorisce la catalisi dal punto di vista chimico
-Studiando la cinetica della reazione catalizzata
CINETICA CHIMICA
Lo studio del tempo che impiega un sistema di reazione a
raggiungere lo stato di equilibrio permette di capire
come avviene una reazione e in che modo la si può
influenzare.
Scopo della CINETICA CHIMICA è studiare la velocità
di una trasformazione chimica (velocità di reazione) e i
fattori che la influenzano, determinare il meccanismo
della reazione, ossia l’insieme degli stadi elementari
(eventi a livello molecolare) attraverso i quali si compie
la reazione.
Velocità di reazione
Per studiare la velocità di una reazione chimica e i fattori che la governano occorre
definire una grandezza determinabile sperimentalmente che possa essere assunta
come misura della velocità stessa.
Si consideri una reazione in fase omogenea, si supponga che sia spontanea (∆G < 0) e
che il sistema di reazione si trovi ancora lontano dall’equilibrio. Se si analizzano le
variazioni nelle quantità di reagente (R) e di prodotto (P) nel tempo, si ottiene
La velocità di una reazione diminuisce progressivamente al procedere della
reazione (la pendenza della tangente alla curva diminuisce).
EQUAZIONE CINETICA
Velocità di reazione
L’ equazione cinetica o legge cinetica esprime la dipendenza della
velocità di una reazione dalle concentrazioni dei reagenti
• k è la costante di velocità
• m ed n sono coefficienti che possono essere pari a zero, numeri interi o frazionari,
il cui valore può essere determinato solo sperimentalmente.
• Ogni coefficiente determina l’ ordine di reazione, rispetto al proprio componente
• la somma m+n determina l'ordine globale della reazione.
EQUAZIONE CINETICA
aA + bB → prodotti
k = costante di velocità
o costante cinetica
v = k (cA)m (cB)n
m = ordine della reazione rispetto al reagente A
n = ordine della reazione rispetto al reagente B
m + n = ordine complessivo della reazione
può succedere che m = a e n = b,
anche se spesso m e n sono diversi dai
coefficienti stechiometrici di A e B
Le unità di misura della costante cinetica dipendono dall’ordine della reazione
v = c t–1 = k cm+n
Primo ordine k = c t–1/c = t–1
Secondo ordine k = c t–1/c2 = c–1 t–1
Terzo ordine k = c t–1/c3 = c–2 t–1
(s–1)
(mol–1 L s–1)
(mol–2 L2 s–1)
Reazione reversibile di primo ordine
k1
[A ]←
→
[B ]
k -1
-v=
d [A ]
= - k 1 [A ] + k - 1 [B]
dt
k1 e k-1= costanti di velocità di I ordine
all’equilibrio le velocità delle reazioni nei due sensi diventano
eguali e la velocità complessiva pari a 0
0 = - k 1 [A ] eq + k - 1 [B] eq
[B]
[A]
eq
eq
k1
=
=K
k -1
K = costante di equilibrio
In una reazione reversibile di I ordine,
K (costante di equilibrio) è pari al rapporto tra le costanti di velocità
delle due reazioni
Reazione reversibile di primo ordine
K = costante di equilibrio
pari al rapporto delle costanti di
velocità delle due reazioni
ORDINE DI REAZIONE
A+B
1° ordine
1° ordine
2° ordine
X
X
X
P
A
B
AB
PSEUDOPRIMORDINE
A + B
lenta
C
veloce
B + P
Se le reazioni sono costituite da una successione di processi elementari, ciascuno
è caratterizzato da una propria velocità. La velocità complessiva della reazione
è determinata dalla velocità dello stadio più lento che determina quindi la
velocità dell’intera reazione
CINETICA CHIMICA: riepilogo
m
n
ordine di reazione
legge cinetica
0
0
0
1
0
1
s–1
0
1
1
s–1
2
0
2
mol–1 L s–1
1
1
2
mol–1 L s–1
k
adimensionale
Cinetica enzimatica
1913: Michaelis e Menten
approccio cinetico basato su:
assunzione del “quasi equilibrio” (“equilibrio rapido”)
assunzione della velocità iniziale
DIPENDENZA DELLA VELOCITÀ DI REAZIONE
DALLA CONCENTRAZIONE DI SUBSTRATO
k1
k2
k3
EQUAZIONE DI MICHAELIS-MENTEN: assunzioni
1) [S] >> [E] (importanza della velocità iniziale,Vo,
ovvero la velocità misurata prima che il 10% del
substrato si sia consumato)
2) Il complesso enzima-substrato è in equilibrio con
l'enzima libero ed il substrato. Questa situazione di
equilibrio non è disturbata dalla formazione del
prodotto (k3 trascurabile).
3) La dissociazione di ES in E + P è la tappa limitante
v0 = k3 [ES]
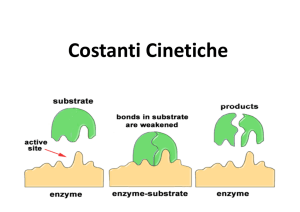
REAZIONE CATALIZZATA DA ENZIMI
k1
k3
k2
Equazione di Michaelis-Menten
v0 = Vmax [S]
KM +[S]
Descrive la variazione della velocità di una reazione catalizzata da
un enzima al variare della concentrazione di substrato ed è un’
iperbole rettangolare avente come asintoto Vmax.
1925: Briggs e Haldane
Assunzione dello “stato stazionario” d[ES]/dt = 0
durante tutto il periodo di tempo in cui si possono misurare
delle velocità iniziali il complesso ES rimane costante perchè la
velocità con cui il complesso ES si forma a partire da E+S è
uguale alla somma delle velocità con cui si scinde a dare E+P ed
E+S. ( k3 non trascurabile rispetto a k2 ).
Derivazione
dell’equazione
di
assunzione dello stato stazionario
Michaelis-Menten:
Assunzioni:
-[S] >> [E] in modo tale che la formazione del
complesso ES non alteri significativamente la
concentrazione iniziale di S
-La velocità della reazione inversa (E + P→ES)
è trascurabile
-Stato stazionario: [ES] costante
k1
k3
k2
Quando [S] >>[E], la velocità della reazione
è proporzionale alla concentrazione di ES
La dissociazione di ES in E + P è la tappa
limitante
v0 = k3 [ES]
k1
k3
v0 = k3 [ES] (tappa limitante)
k2
Stato stazionario: [ES] è costante nel tempo; le velocità di formazione e di
dissociazione del complesso ES sono uguali.
K1 [E] [S] = k2 [ES] + k3 [ES]
K1 [E] [S] = (k2 + k3) [ES]
[E] [S] = k2 + k3
[ES]
k1
[E] = [Et] – [ES]
KM
[E] [S] = KM
[ES]
([Et] –[ES]) [S] = KM
[ES]
Stato stazionario
k1
k3
v0 = k3 [ES]
k2
([Et] –[ES]) [S] = KM
[ES]
([Et] –[ES]) [S] = KM[ES]
v0 = k3[Et][S]
KM +[S]
k3[Et] = Vmax
([Et] [S]) –[ES][S] = KM[ES]
[ES] (KM + [S]) = [Et][S]
[ES] = [Et][S]
KM+ [S]
v0 = Vmax [S]
KM +[S]
Vmax = k3 [ES] è la massima velocità iniziale
ottenibile per una data quantità di enzima in condizioni
di saturazione di substrato.
Velocità di reazione (v0) = quantità di substrato
trasformato in prodotto nell’unità di tempo. Si esprime in
mmoli di prodotto/L (mM)/min.
Vmax = velocità massima della reazione.
Saturazione dei siti attivi dell’enzima
Km = costante di Michaelis.
È la concentrazione del
substrato alla quale la velocità
della reazione è metà della
velocità massima. Si esprime in
mmoli/L (mM)
L’equazione si adatta
alle osservazioni
sperimentali?
Equazione di Michaelis e Menten
Quando [S] << Km si ha una cinetica del 1° ordine rispetto al substrato
v = Vmax [ S]
Km
Quando [S] = K
m
l’equazione
diviene:
v = 1 Vmax
2
Quando [S] >> Km si ha una cinetica di ordine 0: v = Vmax
L'equazione cinetica è di 1°ordine nei confronti dell'enzima totale:
…ancora sulla Km…
k1
- in generale, la KM rappresenta
l’affinità
substrato
dell’enzima
per
il
-basso valore di KM = alta affinità
(è sufficiente una concentrazione
bassa di substrato per avere ½
Vmax)
k3
k2
Km= k2 + k3
k1
K3 << k2
Km= k2
k1
-alto valore di KM = bassa affinità
(è necessaria una concentrazione
alta di substrato per avere ½
Vmax)
-Ogni
enzima
ha
caratteristica
Km
per
determinato substrato
una
un
Km1 Km2
…ancora sulla KM…
Vmax × [S]
v=
KM + [S]
KM
KM = S
Vmax
v=
2
ha le dimensioni moli/L
kcat
KM = KS +
k1
k 2 + k3
= KM
k1
se
k 2 >> k 3
(Ipotesi dell’equilibrio di Michaelis-Menten)
KM = KS
…ancora sulla KM…
v=
A basse concentrazioni di substrato:
[S] << KM
KM + [S] ≅ KM
Vmax
v=
x [S]
KM
n=1
In condizioni di saturazione:
[S] >> KM
v ≅ Vmax
Se
[S] = KM
1
v = Vmax
2
n=0
Vmax × [S]
KM + [S]
KM è unica per ogni coppia enzima-substrato
KM costante di affinità
sangue
fegato
I-III KM = 40 µM
IV
KM = 10 mM
Glucosio nel sangue a digiuno 3 mM (velocità di trasformazione minore)
assunzione di carboidrati 9.5 mM (V ~½ Vmax)
NUMERO DI TURNOVER: Kcat
E+ S
k1
k2
ES
kcat
E+ P
A substrato saturante [E]T = [ES], k3 = kcat, (numero di
turnover) e…
Vmax = kcat[E]T
kcat è la costante di velocità di 1° ordine (rispetto alla
concentrazione di enzima) della dissociazione
ES
E+P
kcat è il numero di turnover: cioè la velocità di reazione
quando l’enzima è saturato con il substrato.
…ancora sul Kcat…
Kcat = Vmax
[Et]
Kcat (numero di turnover)
numero massimo di moli di substrato convertite
in prodotto nell’unità di tempo per mole di
enzima (per mole di sito attivo dell’enzima)
quando l’enzima è saturo con il substrato
Kcat (s-1) è una misura di quanto velocemente
un dato enzima può catalizzare una specifica
reazione
…ancora sul Kcat…
kcat
1
kcat
dimensione s-1
= tempo richiesto da 1 molecola di E
(siti catalitici) x trasformare 1 molecola
di S
Numero di turnover di alcuni enzimi
kcat (s-1)
Enzymes
Substrate
Catalase
H2O2
Carbonic anhydrase
HCO3-
400,000
Acetylcholinesterase
Acetylcholine
140,000
β-Lactamase
Benzylpenicillin
Fumarase
Fumarate
40,000,000
2,000
800
RecA protein (ATPase) ATP
Il numero di molecole di substrato trasfomate in
prodotto da una molecola di enzima in un secondo
0.4
Costante di specificità, kcat/ KM
E+S
k1
k2
k3
ES (v ) E + P
o
A substrato saturante, k3 = kcat, numero di turnover
A [substrato] bassa
Second order
k3
Vmax [S]
k3 [E][S]
[E][S]
vo =
=
=
Km + [S]
Km + [S]
Km
Si trascura [S]
Costante di specificità
COSTANTE DI SPECIFICITÀ
Se
[S] << KM
Vmax × [S]
v=
KM + [S]
L’equazione di MM
diventa:
kcat
KM
[E]t ≅ [E]
Vmax = kcat [E] t
kcat
v=
[E] t [S]
KM
n=2
costante di specificità
Definisce come si comportano E e S quando vi è
abbondanza di siti enzimatici disponibili
Costante di specificità:
il modo migliore di valutare l’efficienza catalitica di un enzima con substrati
diversi
[S] << KM
[E]t≅ [E]
kcat
[E][S]
v=
KM
kcat
= costante di velocità di 2° ordine
KM
kcat
VS1 =
[E][S1]
KM S1
se [S1] = [S2]
kcat
VS2 =
E
KM S2
[ ][S2]
VS1 (kcat / KM ) S1 [S1]
=
VS2 (kcat / KM ) S2 [S2 ]
kcat
=
KM
VS1 (kcat / KM ) S1
=
VS2 (kcat / KM ) S2
costante di specificità
Valori di kcat/Km della chimotripsina verso differenti
substrati
=
–
– –
=
O
R O
H3C–C–N–C–C–O–CH3
H H
R=
kcat / Km
Glicina
–H
1.3 ╳ 10-1
Norvalina
–CH2–CH2–CH3
3.6 ╳ 102
Norleucina
–CH2–CH2–CH2–CH3
3.0 ╳ 103
Fenilalanina
–CH2–
1.0 ╳ 105
(M-1 s-1)
PERFEZIONE CATALITICA
k 2 + kcat
= KM
k1
quando
kcat >> k 2
il prodotto si forma rapidamente
kcat
k 1 kcat
=
= k1
KM k 2 + kcat
k1 = costante di velocità di 2° ordine
Il limite superiore di kcat/KM è k1, cioè la dissociazione di ES in E
e P non può avvenire più rapidamente della formazione di ES.
Gli enzimi più efficienti hanno valori di kcat/KM vicini al limite
controllato dalla velocità di diffusione delle molecole di 108-109 M-1
s-1. Essi cioè catalizzeranno una reazione ogni volta che una
molecola di substrato si lega al sito attivo.
Significato delle due costanti di velocità kcat e kcat/KM.
kcat rappresenta la costante
di velocità di primo ordine
per la trasformazione del
complesso ES in E + P. Essa è
determinabile quando
l'enzima è saturato con il
substrato (segmento della
curva di Michaelis-Menten
indicato con A).
Il rapporto kcat/KM è la
costante di velocità di
secondo ordine per la
trasformazione di E + S in E
+ P per concentrazioni molto
basse di substrato
(segmento indicato con B). Le
reazioni a cui si riferiscono
queste costanti di velocità
sono riassunte sotto il
grafico.
Vmax [S]
vo =
Km + [S]
1° ordine
[S] = Bassa → Alta
E3
E2
E1
[S] = prefissata
Proporzionale alla
concentrazione di
enzima
Ordine zero
v0= Vmax S
KM + S
Pendenza =
1 = Km . 1 + 1
V0 Vmax [S ] Vmax
y = bx + c
y = 1/v0
x = 1/ S
b = Km/Vmax
c = 1/Vmax
L’equazione di Lineweaver-Burk:
- è una trasformazione dell’equazione di Michaelis –Menten
- permette di calcolare in modo più accurato Km e Vmax
Reazione catalizzata da enzimi
Effetto della TEMPERATURA
Effetto della temperatura sulle reazioni chimiche
Sperimentalmente si nota
che la costante cinetica
aumenta esponenzialmente
con la temperatura.
La legge esponenziale fu
dedotta su basi empiriche
da Arrhenius nel 1887
R = costante dei gas
k = A e–Ea/RT
T = temperatura assoluta (K)
Ea = energia di attivazione: energia di collisione critica che una coppia di
molecole deve possedere affinché avvenga la reazione.
A = fattore di frequenza (costante di Arrhenius): fattore che
rappresenta la frequenza degli urti efficaci (dipende dalla frequenza
complessiva degli urti e dall’orientazione delle molecole negli urti stessi).
Reazione catalizzata da enzimi
Effetto del
- stato di ionizzazione di
residui del sito attivo
- stato di ionizzazione delle
catene laterali di tutta la
catena polipeptidica: effetto
sulla struttura nativa
Il pH ottimale rispecchia quello dell’ambiente
in cui l’enzima svolge normalmente le sue funzioni
EFFETTO DEL PH SULL’ATTIVITÀ ENZIMATICA:
considerazioni
Lo stato di ionizzazione delle catene laterali della catena
polipeptidica ha effetto sulla struttura nativa
• Gli estremi di pH denaturano le proteine a causa dell’instaurarsi di forze
repulsive.
• Variazioni di pH possono determinare dissociazione di enzimi oligomerici in
monomeri inattivi.
Lo stato di ionizzazione di residui del sito attivo ha effetto sulla
capacità catalitica
•
I residui responsabili dell’attività catalitica possono contenere coppie
acido-base; pertanto lo stato di ionizzazione è critico per una buona catalisi
(quindi può variare Kcat).
Inoltre:
•
Gli equilibri chimici tra enzima e substrato variano.
• La ionizzazione del substrato può influenzare il legame produttivo tra
enzima e substrato dovuto ad interazioni ioniche, legami a idrogeno o
interazioni idrofobiche (quindi influenzare la Km).