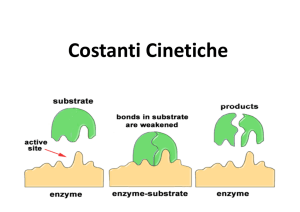
Cinetica enzimatica
Cenni alla cinetica delle reazioni
•
•
•
•
•
Velocita’ di reazione
Reazioni di I° e II° ordine
Molecolarita’ di una reazione
t1/2
Velocita’ e costanti di equilibrio
CINETICA ENZIMATICA
OVVERO:
LO STUDIO DELLA VELOCITA’ DI REAZIONE
FATTORI CHE INFLUENZANO LA VELOCITA’ DI
REAZIONE:
-Concentrazione del substrato
-Concentrazione dell’enzima
-pH
-Temperatura
-Inibitori, Attivatori
-Concentrazione dei Sali (forza ionica)
La velocità di una reazione
enzimatica in funzione della
concentrazione del substrato
(D. Voet, J.G. Voet, Biochemistry, 3° ed., John Wiley & Sons, 2004)
Teoria di Michaelis e Menten
Teoria di Briggs e Haldane
(Teoria dello “stato stazionario”)
E+S
ES
E+P
(D. Voet, J.G. Voet, Biochemistry, 3° ed., John Wiley & Sons, 2004)
k1
E+S
k2
ES
E+P
Dove:
k-1
e se:
d[ES]
= 0 = k1[E][S ] − k2 [ES] − k−1[ES]
dt
sostituendo con : [E ] = [E0 ] − [ES ]
[ES ] = k +[Ek0 ][S ]
2
−1
+ [S ]
k1
k [E ][S ]
v = cat 0
k 2 + k −1
+ [S ]
ma poiché:
k2 = kcat
k2
≥ k-1
v = kcat [ES ]
k1
Questa è l’equazione di Michaelis-Menten, dove:
k 2 + k −1
KM =
k1
Equazione di Michaelis e Menten
k cat [E 0 ][S ]
v=
K M + [S ]
dove:
k cat [E0 ] = Vmax
La concentrazione del substrato alla quale
è denominata
KM
1
v = V max
2
, la costante di Michaelis.
Notare che a basse [S] , dove [S] << KM :
k cat
v =
KM
[E 0 ][S ]
Poiché KS per la dissociazione di [ES] è uguale a
si ha:
k
KM = KS +
2
k −1
k1
k1
E’ chiaro che quando k-1>> k2, l’equazione si semplifica a:
KM = KS
Se : kcat [E0 ] = Vmax si ha che :
v=
Vmax [S ]
da cui :
K M + [S ]
[S] >> K M ,
v = Vmax
Vmax
[S ] << K M , v =
× [S ]
KM
Vmax
[S ] = K M , v =
2
k1
E+S
k2
ES
E+P
e:
k-1
[E ][S ] = K
[ES ] S
v = k cat [ES ]
[E] = [E0 ] − [ES] da cui :
[
E 0 ][S ]
[ES ] =
K S + [S ]
Dove: k2 = kcat <<
e
k −1
k1
k-1
= KS
kcat [E0 ][S ]
v=
K S + [S ]
Quest’ultima equazione è uguale a quella iniziale, dove
KM è uguale alla costante di dissociazione del
complesso enzima-substrato, KS .
(D.L. Nelson, M.M. Cox, Lehninger Principles
of Biochemistry, 4th ed., W.H. Freeman &
Co., 2005)
Dato:
Vmax [S ]
v=
K M + [S ]
prendendo i reciproci :
1 ⎛ KM ⎞ 1
1
⎟⎟
= ⎜⎜
+
v ⎝ Vmax ⎠ [S ] Vmax
Grafico di Lineweaver e Burk (o dei reciproci)
v
v = −KM
+ Vmax
[S ]
Grafico di Eadie e Hofstee
(D. Voet, J.G. Voet, Biochemistry, 3° ed., John Wiley & Sons, 2004)
(A. Fersht, Structure and mechanism in protein science, W.H.
Freeman & Co., 1999)
Il significato dei parametri di Michaelis e Menten:
kcat :
-
nel semplice meccanismo di Michaelis e Menten in cui vi è un solo
complesso enzima-substrato e tutte gli steps di “binding” sono veloci,
kcat è semplicemente la costante di I° ordine per la conversione
chimica del complesso ES nel complesso EP;
-
(per reazioni più complesse, kcat è una funzione di tutte le costanti di I° ordine e non può
essere assegnata a un particolare processo eccetto quando intervengano delle
semplificazioni;)
-
kcat
Vmax
=
[E0 ]
, questa quantità è detta anche numero di turnover
perché rappresenta il numero massimo di molecole di substrato
convertite in prodotto per sito attivo nell’unità di tempo (o il numero
di volte che l’enzima ‘turns over’ per unità di tempo.
KM :
-sebbene valida per il semplice meccanismo di Michaelis e Menten o in casi in
cui comunque KM = KS, la vera costante di dissociazione del complesso enzimasubstrato, KM può essere considerata in qualche caso come una costante di
dissociazione apparente.
-KM è unica per ogni coppia enzima-substrato. Substrati differenti che reagiscono
con uno stesso enzima hanno KM differenti; così come enzimi differenti che
agiscono su uno stesso substrato hanno KM differenti.
-In reazioni enzimatiche dove esistono più complessi ES, KM rappresenta comunque la quantità di
enzima legato sotto qualsiasi forma al substrato.
-In tutti i casi KM è la concentrazione del substrato alla quale:
KM
Vmax
v=
2
è una costante di dissociazione apparente che può essere considerata come la costante di
dissociazione complessiva di tutte le specie di enzima legato.
kcat/KM:
quando
[S ] << K
M
, ES si forma in quantità minima. Di conseguenza,
[E ] ≈ [E0 ]
kcat [E0 ][S ] kcat
v=
≈
× [E ][S ]
KM
KM
In questo caso, kcat/KM è la costante apparente di secondo ordine
della reazione enzimatica; la velocità della reazione varia direttamente in
proporzione a quante volte enzima e substrato si incontrano in soluzione.
Questa quantità è quindi una misura dell’efficienza catalitica dell’enzima.
Vi è un limite superiore al valore di kcat/KM : esso non può essere più
grande di k1, cioè la decomposizione di ES a dare E +P non può avvenire
con maggior frequenza di quanto E ed S si uniscono a formare ES.
Gli enzimi più efficienti hanno valori di kcat/KM prossimi al limite di
diffusione di 108 -109 M-1 x sec-1.
Praticamente l’enzima catalizza una reazione ogni volta che esso
incontra una molecola di substrato.
kcat : numero di micromoli di S convertite in P per secondo da
una micromole di enzima operante in condizioni saturanti di S.
KS
K
K’
k1
k2
k3
E+S
ES
k-1
ES’
k-2
k4
ES”
k-3
k5
EP’
k-4
k6
EP”
k-5
E+P
k-6
(D. Voet, J.G. Voet, Biochemistry, 3° ed., John Wiley & Sons, 2004)
(D. Voet, J.G. Voet, Biochemistry, 3° ed., John Wiley & Sons, 2004)
(D. Voet, J.G. Voet, Biochemistry, 3° ed., John Wiley & Sons, 2004)