Ammine
9Struttura
9Classificazione
9Nomenclatura
9Reattività
Corso di Chimica e Propedeutica Biochimica
N
H3C
Proff. M. De Rosa/C.Schiraldi
H
CH3
Nelle ammine gli orbitali dell’azoto sono ibridati sp3.
3 degli orbitali ibridi sono impegnati nella formazione di legami V
con H o C. Il quarto orbitale ibrido è occupato dal doppietto
elettronico solitario dell’N che conferisce carattere basico e
nucleofilo alle ammine.
Gli angoli di legame sono leggermente inferiori rispetto al valore
tetraedrico teorico. La geometria delle molecole è piramidale.
Scaricato da Sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C.Schiraldi
Ammine: classificazione
Si chiamano primarie le ammine che hanno un solo
gruppo R- (alchilico o arilico) legato all’azoto.
Sono secondarie e terziarie le ammine al cui atomo di
azoto sono legati, rispettivamente, due e tre gruppi R(alchilici o arilici)
H
R N
H
R''
R N
H
ammina primaria
R N
R'
R'
ammina secondaria
Corso di Chimica e Propedeutica Biochimica
ammina terziaria
Proff. M. De Rosa/C.Schiraldi
NOMENCLATURA
¾La nomenclatura IUPAC per le ammine primarie,
individuata e numerata la catena carboniosa più
lunga, cambia la desinenza –o dell’alcano
corrispondente nella parola –ammina.
¾Per le ammine secondarie e terziarie, si indicano,
preceduti dalla lettera N, i residui legati all’azoto.
Il nome comune si ottiene anteponendo alla parola ammina, i
nomi dei residui alchilici che hanno sostituito gli atomi di
idrogeno.
Scaricato da Sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C.Schiraldi
H
H
H
H
H C H
H C H
H C H
H C H
H C H
H C H
H C NH2
H C H
H C H
NH2
metanammina
amminometano
metilammina
H
NH2
etanammina
amminoetano
etilammina
H C H
N H
H C H
H C H
H
NH2
1-propanammina
1-amminopropano
1-propilammina
2-propanammina
2-amminopropano
2-propilammina
H
C2H5
H
CH3
H
H
N,N-dimetil-etanammina
N,N-dimetil-amminoetano
N-metil-etanammina
dimetil etil ammina
N-metil-amminoetano
metil etil ammina
H
CH3
H
H
H
N CH3
H
N
H H
H
H
N-metil-cicloesanammina
N-metil-amminocicloesano
dimetil cicloesil ammina
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C.Schiraldi
NH2
CH3
N H
benzenammina
amminobenzene
fenilammina
anilina
N-metilbenzenammina
N-metil-amminobenzene
metilfenilammina
N-metil-anilina
CH3
H3C C CH3
N CH3
N-metil-N-2(2-metilpropil)benzenammina
N-metil-N-tert-butil-amminobenzene
metil-tert-butil-fenilammina
N-metil-N-isopropil-anilina
Scaricato da Sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C.Schiraldi
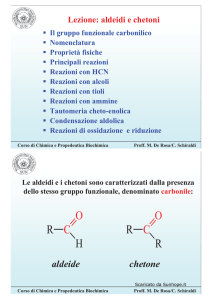
Ammine: proprietà fisiche
Le ammine sono polari ed interagiscono con attrazioni dipolo-dipolo.
Le ammine primarie e secondarie possono legarsi mediante ponti di
idrogeno.
Le ammine hanno punti di ebollizione più bassi di quelli dei corrispondenti
alcoli per la maggiore elettronegatività dell’O rispetto all’N
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C.Schiraldi
Ammine: basicità
Kb = 6 • 10-4
N
CH3
H
CH 3
Kb = 5 • 10-4
Kb = 6.6 • 10-5
N
N
H
H+
H
H
CH3
H 3C
CH3
H+
H+
H
H
H
N
N
N
CH3
CH3
H
H
CH3
H3 C
CH3
CH 3
CH3
Scaricato da Sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C.Schiraldi
Ammine : basicità
In generale, in soluzione acquosa:
R2NH > RNH2 > R3N
Basicità crescente
Le ammine secondarie risultano le più basiche poiché i loro acidi
coniugati presentano la miglior combinazione tra stabilizzazione
dovuta alla presenza dei gruppi alchilici legati all’atomo di N e
stabilizzazione per solvatazione.
Le ammine sono molto più basiche dei composti analoghi contenenti
O: l’N, essendo meno elettronegativo è un miglior donatore di una
coppia di elettroni (per il legame con un protone).
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C.Schiraldi
Ammine aromatiche: basicità
Kb = 4,2 • 10-10
N
H
H
benzenammina
Kb = 5,5 • 10-4
N
H
H
cicloesanammina
La presenza di un sostituente arilico rende l’ammina meno basica!
Scaricato da Sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C.Schiraldi
Ammine aromatiche: basicità
NH2
NH2
NH2
NH2
Il doppietto elettronico dell’azoto del gruppo amminico
è delocalizzato sull’anello le ammine aromatiche
sono meno basiche delle ammine alifatiche.
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C.Schiraldi
Ammine: basicità
Scaricato da Sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C.Schiraldi
Ammine : nucleofilicità
La nucleofilicità delle ammine è influenzata dalla natura dei gruppi
legati all’azoto. Considerando l’effetto induttivo elettron donatore
dei gruppi alifatici, la nucleofilicità delle ammine dovrebbe
aumentare all’aumentare del numero di sostituenti alchilici:
NH2
C2H5
H N
H
H5C2
C2H5
N
H
H5C2
C2H5
N
C2H5
Carattere nucleofilo dell’azoto amminico
L’andamento presenta eccezioni se l’ammina è stericamente
impedita. Le ammine aromatiche sono meno nucleofile di quelle
alifatiche per lo stesso motivo che ne spiega la minore basicità
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C.Schiraldi
REAZIONI DI SOSTITUZIONE NUCLEOFILA DI
AMMINE CON ALOGENO ALCANI
I
H
H
C
H
H
C
N
H
H
H
H
CH3
N
H
CH3
I-
H
CH3
N
H
CH3
HI
L’ammina primaria conduce un attacco nucleofilo sul carbonio
legato all’atomo di alogeno (SN2). Segue una deprotonazione
dello ione ammonio sostituito. Si forma un’ammina secondaria.
Se è presente un eccesso di alogenoalcano, il forte carattere
nucleofilo dell’ammina secondaria comporta la possibilità di un
secondo attacco nucleofilo……
Scaricato da Sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C.Schiraldi
I
H
H
C
H
H
H
C
N
H
H
N
CH3
CH3
H
CH3
I-
N
CH3
CH3
CH3
CH3
HI
Dall’attacco nucleofilo dell’ammina secondaria sulla seconda
molecola di alogeno alcano si ottiene la formazione di
un’ammina terziaria.
Se è presente un eccesso di alogenoalcano, l’ammina terziaria
può esercitare un nuovo attacco nucleofilo su quest’ultimo
dando luogo alla formazione di un sale di ammonio
quaternario ...
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C.Schiraldi
I
H
H
C
H
H
C
N
H3C
H
H
CH3
CH3
N
H3C
ICH3
CH3
Il terzo attacco nucleofilo porta alla formazione del sale di
tetraalchilammonio (in particolare, nella reazione riportata
si forma ioduro di tetrametilammonio).
Scaricato da Sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C.Schiraldi
REAZIONI DELLE AMMINE (PRIMARIE) CON
ACIDO NITROSO: DIAZOTAZIONE
La diazotazione consiste nella trasformazione di un’ammina (RNH2
o ArNH2) nel corrispondente sale di diazonio (RN2+X- o ArN2+X-).
Tale reazione si ottiene aggiungendo un’ammina primaria ad una
soluzione fredda di nitrito di sodio in acido solforico o acido
cloridrico diluiti.
Tali reazioni prevedono innanzitutto la formazione dell’elettrofilo
(ione nitrosonio) per protonazione dell’acido nitroso e successiva
perdita di acqua.
H
O
O
O
O H+
N
O N
N
HO N
H
ione nitrosonio
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C.Schiraldi
DIAZOTAZIONE DI AMMINE PRIMARIE
Stadio 1: Addizione di ione nitrosonio
all’ammina
Stadio 2: trasferimento di protone con
formazione di N-nitrosammina. La
base può essere una molecola di acqua,
l’ammina o il controione dello ione
nitrosonio
Stadi 3-4: equilibrio tautomerico
Stadio 5: protonazione
Stadio 6: perdita di acqua con
formazione dello ione diazonio RN2+.
Scaricato da Sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C.Schiraldi
DIAZOTAZIONE DI AMMINE PRIMARIE
Gli ioni diazonio alchilici sono molto
instabili: si decompongono per dare
azoto gassoso e carbocationi che
possono a loro volta dar luogo alla
formazione di diversi prodotti.
N.B. : Nel caso di ammine secondarie, la reazione si ferma alla formazione di
nitrosammina (vedi meccanismo)
Le ammine terziarie, invece, reagiscono con i nitriti in ambiente acido
per dare sali di trialchilnitrosoammonio (la rex si ferma al primo stadio)
R'
R N
R''
R'
R N N O
R''
N O
ione trialchilnitrosammonio
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C.Schiraldi
REAZIONI DELLE AMMINE AROMATICHE CON
ACIDO NITROSO: DIAZOTAZIONE
Le ammine aromatiche primarie, come quelle alifatiche, reagiscono
con i nitriti in ambiente acido per dare sali di diazonio. I sali di
diazonio arilici sono, a differenza di quelli alchilici, stabili in soluzione
acquosa acida a bassa temperatura risultando quindi utili nelle sintesi
organiche.
N
N
NH2
N
N
NaNO2 (H+)
in acqua a 0°C
….
catione diazonio
Scaricato da Sunhope.it
Corso di Chimica e Propedeutica Biochimica
Proff. M. De Rosa/C.Schiraldi
Cl
In presenza di sali
rameici i sali di
diazonio arilici si
possono convertire
in altri derivati
aromatici.
N2
N
CN
N
N2
OH
+ N2
Corso di Chimica e Propedeutica Biochimica
A temperatura ambiente e in
presenza di acqua, i sali di
diazonio arilici si convertono
nei
corrispondenti
fenoli,
eliminando una molecola di
azoto.
Proff. M. De Rosa/C.Schiraldi
Scaricato da Sunhope.it