ivo cacelli – chimica ambientale I - 2015
metalli pesanti -
1
Inquinamento da metalli pesanti
I metalli pesanti sono sostanze con cui conviviamo quotidianamente, perché sono alla base della
composizione di molti organismi viventi, ed anche del nostro stesso corpo. Molti di essi, però, sono
potenzialmente tossici, per cui se penetrano nell’ambiente e quindi nel nostro organismo in dosi
superiori a quelle tollerabili, comportano gravi conseguenze sulla salute.
Nel contesto della chimica dell’ambiente, con il termine metalli pesanti si intendono alcuni elementi
della tavola periodica. Ci occuperemo dei quattro metalli pesanti e di un semimetallo più rilevanti
dal punto di vista ambientale: mercurio (Hg), piombo (Pb), cadmio (Cd), cromo (Cr) e arsenico
(As). Questi elementi sono presenti nella crosta terrestre in concentrazioni più basse dello 0.1%,
per cui la loro quantità è largamente inferiore ad altri elementi non metallici come carbonio, azoto,
ossigeno, etc. o altri semimetalli come il silicio. Ai fini della attività biologica umana, i metalli
possono essere suddivisi in due grandi categorie:
1) Metalli essenziali per la vita (a dosi molto basse): Fe, Co, Cr, Cu, Mn e Zn. Ad alte
concentrazioni diventano pericolosi e sono deleteri per i sistemi biologici.
2) Metalli o semimetalli non essenziali per la vita: non hanno alcun ruolo nei processi biologici: Al,
As, Be, Cd, Hg, Ni, Pb. La loro interazione con i processi biologici è sempre dannosa, anche in
basse quantità.
Nessuno di questi metalli ha
finora
contaminato
l’ambiente in modo da
rappresentare un pericolo su
larga scala, ma si sono
osservati
fenomeni
di
inquinamento locale di una
certa rilevanza per ciascuno
di questi metalli.
L’inquinamento ambientale
dei metalli differisce da
quello dei composti organici
tossici (come per es. i
pesticidi) perché i metalli non
sono degradabili in forme non tossiche, in quanto la contaminazione ambientale riguarda proprio
l’elemento chimico e non il particolare composto disperso nell’ambiente. Tuttavia i composti
formati dai metalli hanno una differente pericolosità, legata alla facilità con cui vengono assunti ed
alla diversa interazione con i cicli biologici umani. La decontaminazione avviene attraverso la
trasformazione dei composti metallici in forme insolubili e quindi non disponibili biologicamente;
la destinazione definitiva è il suolo e i suoi sedimenti.
Caratteristiche chimiche dei metalli pesanti.
Allo stato elementare gli elementi detti ‘metalli pesanti’ formano i metalli, in cui gli elettroni sono
delocalizzati in tutto il volume e gli atomi sono tenuti insieme dalla attrazione elettrostatica che si
instaura tra gli elettroni di valenza e gli ioni positivi metallici. Nel metallo non esistono quindi
molecole vere e proprie, ma aggregati reticolari di atomi metallici tenuti insieme da forze di tipo
elettrostatico. Questo spiega alcune proprietà dei metalli come le loro elevate conducibilità elettrica
(elettroni estremamente mobili) e termica, la loro malleabilità e duttilità. In questa forma i metalli
pesanti hanno alta densità, in genere maggiore di 5 g/cm3.
Nei legami con gli altri elementi chimici formano invece delle molecole e si comportano quasi
sempre come cationi, dato che hanno bassa elettronegatività e bassi potenziali di ionizzazione. Ciò
ivo cacelli – chimica ambientale I - 2015
metalli pesanti -
2
significa che gli elettroni esterni sono debolmente legati all’atomo e nei processi di formazione di
legame chimico vengono ceduti ad altri elementi più elettronegativi. In questi casi il composto
risultante viene chiamato complesso metallico. Un complesso metallico è costituito da un atomo
metallico centrale, con carica positiva, che
coordina attorno a sé un numero definito di
molecole polari o di anioni, chiamati leganti. Il
numero di leganti coordinati va di solito da 2 a
6, ma può arrivare fino a 12.
Tre dei metalli di cui ci interesseremo (Hg, Cd,
Cr) fanno parte dei gruppi appartenenti agli
elementi di transizione, anche se i primi due
hanno orbitali d completamente riempiti e
mostrano un comportamento chimico più affine
a quello dei metalli del blocco p, come per
esempio il piombo. A causa delle piccole
differenze di energia tra gli elettroni del livello
ns, np e gli elettroni nel livello (n-1)d e i bassi potenziali di ionizzazione, i metalli hanno la
possibilità di assumere molti stati di ossidazione fra 0 e +8. Per esempio quando si parla di
composti del ferro si specifica se l’elemento è nello stato di ossidazione +2 (ferro ferroso o Fe(II))
oppure +3 (ferro ferrico o Fe(III)). Proprio per l’accessibilità a diversi stati di ossidazione, molti
elementi di transizione hanno proprietà catalitiche. Inoltre, i loro ioni sono spesso colorati, perché
hanno la possibilità di assorbire ed emettere luce nella regione spettrale del visibile.
Gli altri due elementi Pb e As non sono elementi di transizione ed hanno i gusci d completamente
riempiti. Per questo si comportano in modo diverso; As è un metalloide e non forma complessi, ma
legami covalenti stabili, usando principalmente orbitali p, mentre Pb forma complessi, ma si trova
più frequentemente come ossido o alogenuro.
I metalli hanno una grande affinità per lo zolfo e per i solfuri in genere, con cui formano composti
relativamente stabili. Oltre che nella crosta terrestre, i composti metallici si trovano sciolti in acqua
e possono essere trasportati dall’aria sia come gas (per es. Hg) che adsorbiti su particolato. Tutti e 5
gli elementi che considereremo (Hg, Cd, Pb, As, Cr) sono pericolosi come cationi e/o legati a catene
di atomi di carbonio, in particolare catene alchiliche a formare alchili o alchilati in cui il legame
metallo – carbonio è essenzialmente covalente, piuttosto che ionico.
Attività tossica
La loro attività tossica all’interno degli organismi biologici deriva dalla loro affinità con lo zolfo.
Molti enzimi contengono dei gruppi solfidrilici ∙∙∙SH che possono complessare cationi metallici.
Una volta legati ai metalli, gli enzimi assumono una struttura modificata tipo R-S-M-S-R, dove due
atomi di zolfo complessano il metallo e non riescono più ad effettuare il loro compito biologico, che
è di regolare la velocità delle reazioni metaboliche nei cicli biochimici, con danni alla salute.
Quando i metalli si trovano in composti insolubili in acqua non possono venire a contatto con gli
enzimi della fase acquosa, per cui la loro azione tossica è assai minore e transitano nell’organismo
senza causare gravi danni.
Le forme più pericolose sono quelle che agiscono rapidamente per cui la terapia non riesce ad agire
in tempi utili, come per esempio l’ossido arsenioso As2O3. Un’altra caratteristica che aumenta
fortemente la tossicità è la capacità di attraversare la membrana encefalica o la barriera placentare
nelle donne incinte. Nel caso di Hg e Pb le forme più tossiche sono quelle in cui il metallo è legato a
gruppi alchilici e la molecola (covalente) riesce a passare le membrane biologiche. I corrispondenti
ioni carichi sono meno capaci di attraversare le membrane a causa della sfera di solvatazione che si
forma attorno ad essi, e per questo risultano in generale meno tossici per il SNC, ma possono
produrre danni ad organi interni come il fegato e i reni. Inoltre in soluzione acquosa il pH e la
ivo cacelli – chimica ambientale I - 2015
metalli pesanti -
3
presenza di altre sostanze complessanti può diminuire la concentrazione di ioni
metallici dannosi ed abbassare la tossicità della soluzione.
Una delle possibili terapie contro l’avvelenamento da metalli pesanti è la
somministrazione di dimercaprolo (CH2OH-CHSH-CH2-SH) che contiene due
gruppi SH che riescono a strappare il metallo dall’enzima, restituendo a
quest’ultimo la sua funzionalità biologica. Sono molto efficaci anche altre
sostanze come l’EDTA (figura a destra) che chelano il metallo sottraendolo all’enzima.
MERCURIO
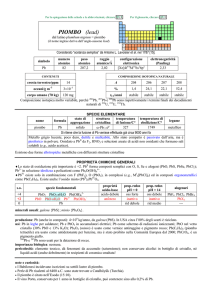
NA=80 T fus=-39ºC Tb=357 ºC Num. Oss.=+1,+2 densità=13.5
gr/cm3
Il mercurio è l’unico metallo liquido alla temperatura ambiente e
conduce bene l’elettricità per cui viene usato per costruire interruttori,
batterie etc. Un tempo veniva usato allo stato vapore nelle lampade a
Hg (adesso sostituite con sodio) e fino a pochi anni fa nei termometri
per il suo alto coefficiente di dilatazione termica.
Tossicità
Forma metallica: Il mercurio è il più volatile tra i metalli che incontreremo per cui si può trovare
anche in fase gassosa allo stato puro Hg0 che è assai tossico. Infatti il mercurio puro, se respirato,
legandosi agli enzimi passa la barriera encefalica e nel cervello viene ossidato a Hg2+ che può creare
seri danni alla materia cerebrale con problemi di coordinazione motoria, di vista e di altri sensi. Il
mercurio liquido è meno tossico e se ingerito viene quasi tutto eliminato nelle feci e urine.
Ione mercuroso: Lo ione mercuroso (numero di ossidazione +1) Hg22+ se ingerito non è molto
tossico perché in soluzione acquosa e nello stomaco forma cloruro mercuroso Hg 2Cl2 (calomelano)
che è un composto stabile, non partecipa alle reazioni biologiche e viene
eliminato nelle feci prima di provocare danni alla salute.
Ione mercurico: Lo ione mercurico (numero di ossidazione +2) è
potenzialmente molto tossico, ma non riesce a passare la membrana encefalica e
placentare. Nelle sue forme inorganiche per es. HgCl2 o HgS (cinabro, estratto
dalle miniere) Hg2+ non viene biologicamente assorbito in grandi quantità.
Negli scarichi sia industriali che domestici lo ione mercurico Hg 2+ può venire
trattato con solfuro sodico Na2S che forma HgS il quale, come molti altri
solfuri, è insolubile e precipita, permettendo così di eliminare il mercurio dalla
soluzione. Gran parte del mercurio ambientale è presente come ione 2+; i livelli attuali di Hg 2+ sono
in genere da 2 a 5 volte i livelli pre industriali.
Composti organici covalenti: I composti covalenti come il metil mercurio (vedi dopo) sono di gran
lunga i più pericolosi perché possono entrare nella catena alimentare in grande quantità e questa
forma riesce a passare le membrane biologiche.
Fonti: Le immissioni antropogeniche sono in aumento di 1.5% all’anno e derivano dalla
combustione del carbone e olio combustibile, dagli inceneritori e da prodotti industriali contenenti
Hg. Le fonti naturali sono determinate dalle eruzioni vulcaniche e dalla sublimazione del metallo
dalla crosta terrestre, a causa della sua volatilità. L’entità delle due fonti è circa la stessa. Il
mercurio in fase vapore nell’aria viene dopo un certo tempo ossidato a Hg2+ e convertito in aerosol
che ricade al suolo sotto forma di pioggia o neve. Una certa quantità di mercurio nella forma
ossidata proviene anche dal dilavamento delle rocce provocato dalle piogge acide. Quindi il
mercurio ionico è la forma in maggiore quantità sulla superficie del suolo.
ivo cacelli – chimica ambientale I - 2015
metalli pesanti -
4
Metilmercurio: Il mercurio può formare composti covalenti con radicali alchilici che sono assai
pericolosi. Il più comune è il metilmercurio Hg(CH3)2 o composti misti come CH3HgCl o
CH3HgOH. Questi composti non sono sali che si ionizzano in soluzione acquosa e sono piuttosto
volatili. Il mercurio che proveniente dalle emissioni nell’atmosfera o dalle dilavazioni delle rocce
per piogge acide, finisce in una certa quantità nelle acque
insieme a quello che vi viene immesso direttamente.
Prevalentemente si ha Hg2+ che si diffonde ed arriva verso i
fondali. Qui per opera di batteri nei sedimenti fangosi di
fiumi e laghi in condizione anaerobiche viene trasformato in
metilmercurio (biometilazione), che diffonde nelle acque
poco profonde e presso la superficie assorbe radiazione e
vaporizza come vapore di Hg. Questo viene trasportato dai
venti e si diffonde nell’atmosfera per cui può entrare negli
organismi attraverso la respirazione. Ma l’evento più
pericoloso avviene nella migrazione dai fondali alla
superficie, dove il metil mercurio si accumula in altissime
concentrazioni in pesci e molluschi ed entra cosi nella catena alimentare. Va sottolineato che il
problema nasce dal fenomeno della bio accumulazione, per cui la quantità di metil mercurio nei
pesci può essere di gran lunga superiore alla quantità nelle acque in cui essi vivono. Inoltre nei pesci
il metil mercurio si lega al materiale biologico contenente gruppi SH e si diffonde quindi in tutto il
corpo del pesce.
La forma organica di Hg è molto più pericolosa delle sue forme inorganiche come HgCl2 ed altri
composti simili. Il metilmercurio passa le membrane biologiche e nelle cellule viene convertito ad
Hg2+ molto tossico. A causa della sua solubilità nei grassi animali, nell’uomo l’emivita del
metilmercurio è di circa 70 giorni, mentre quella dei sali inorganici è di pochissimi giorni. C’è
perciò un’accumulazione, nel senso che la quantità di metilmercurio nell’organismo può essere ben
superiore alla dose giornaliera, ciò che costituisce un serio problema.
La tragedia di Minamata. Negli anni ’50 a Minamata (Giappone) l’industria chimica Chisso
Corporation usava Hg2+ come catalizzatore per la produzione di cloruro di polivinile, e parecchio di
esso veniva scaricato nella baia della città. Il metilmercurio formatosi dalla biometilazione nei
sedimenti della baia si accumulava nei pesci, che rappresentavano l’alimentazione principale di
molti abitanti. La concentrazione di metilmercurio nelle acque arrivò fino a 100 ppm, contro il
limite di sicurezza di 0.5 ppm. Migliaia di abitanti furono colpiti da intossicazione da Hg
proveniente dai pesci e molti di essi morirono. I primi sintomi furono osservati nei gatti che si
cibavano di pesci, facevano salti anomali e si gettavano in acqua annegando a causa di malfunzioni
del sistema nervoso. Nell’uomo i sintomi da avvelenamento furono tardivi, ma i danni al SNC
furono assai gravi: perdita di vista e udito, paresi, perdita di coordinazione motoria. Anche i feti
furono seriamente colpiti, inclusi quelli nati da madri con sintomatologie lievi. Nel 2001 furono
riconosciute 2256 vittime di cui 1784 morte e più di 10000 persone hanno ricevuto risarcimenti
dalla Chisso.
PIOMBO
NA=82 Tfus=327ºC Tb=1750 ºC Num. Oss. =+2,+4 densità= 11.3 gr/cm3
Il piombo è duttile e malleabile (cioè si lascia lavorare con facilità) a
causa della bassa temperatura di fusione. A differenza del mercurio, la sua
tensione di vapore è bassa a temperatura ambiente, per cui il piombo
gassoso è praticamente assente. È più abbondante rispetto a Hg, Cd, As in
natura, e per le sue numerose applicazioni commerciali è ed è stato
maggiormente disperso nell’ambiente.
ivo cacelli – chimica ambientale I - 2015
metalli pesanti -
5
Il piombo nella storia
Il piombo è stato il primo metallo nella storia a essere estratto dal suo minerale solfuro di piombo
PbS per essere modellato. Se ne parla già in papiri egizi del 1500 a.C. e nel libro dell’Esodo. Nei
tempi antichi si usava per coperture, sostegni, tubi e recipienti di cottura cibi. La massima
dispersione nell’ambiente si è avuta ai tempi dell’impero romano: utensili, ciotole, monete. Già gli
antichi greci conoscevano la pericolosità del piombo che veniva ingerito attraverso alimenti cotti in
recipienti di piombo. Gli antichi romani invece usavano il piombo anche per migliorare il sapore del
vino, per cui la concentrazione di piombo nelle ossa degli antichi romani è circa 100 volte quella
degli abitanti di oggi. Qualcuno ha ipotizzato che l’uso del piombo sia stato una delle cause della
caduta dell’impero romano, per i suoi effetti sul sistema neurologico e riproduttivo. Anche nel
medioevo si conservavano le bevande alcoliche in recipienti di piombo. Nei paesi industrializzati la
dispersione di piombo nell’ambiente è fortemente diminuita negli ultimi decenni a causa del fatto
che è stato sostituito da altre sostanze come antidetonante nelle benzine. Nei paesi in via di sviluppo
l’uso e la dispersione di piombo è invece in aumento.
Effetti sulla salute
Il piombo non svolge alcuna funzione biologica nel corpo umano ed è uno dei metalli che ha gli
effetti più negativi sulla salute umana. La tossicità del piombo nell’organismo deriva dalla sua
presenza non nel sangue, ma nei tessuti molli. Quasi tutto il piombo assunto per
via digerente, inalatoria o cutanea finisce nel sangue dove raggiunge una
concentrazione massima possibile, per cui l’eccesso passa nei tessuti come il
cervello fino alle ossa, dove tende a sostituirsi al calcio del tessuto osseo, dato
che Pb2+ e Ca2+ hanno dimensioni simili. Nelle intossicazioni croniche il piombo
si deposita quasi tutto nelle ossa dove permane per decenni. Gli individui a
maggior rischio anche per bassi livelli di Pb2+ sono i feti e i bambini, soprattutto
perché il loro cervello è in crescita. Il piombo passa la barriera placentare e
finisce nel cervello del feto, dove interferisce con il suo normale sviluppo psicofisico con disturbi
dell’attenzione, del comportamento e probabilmente abbassa il QI. La sua azione neurotossica
dipende dalla sua tendenza (come molti altri metalli) a formare complessi organometallici stabili
con i gruppi fosforici dei fosfolipidi di cui sono ricche le cellule nervose.
Oltre a quelli appena menzionati, l’intossicazione cronica da piombo ha una varietà di effetti
negativi sulla salute, in quanto interferisce con numerosi cicli biologici: anemia, demielinizzazione,
infertilità maschile e femminile, malattie renali. L’intossicazione acuta causa nausea, vomito,
diarrea, anemia emolitica, insufficienza renale e a dosi molte elevate può essere letale.
Le fonti di piombo
Proiettili. Il piombo metallico si trova nei proiettili usati dai cacciatori. Molti uccelli colpiti
muoiono per avvelenamento da piombo e pure uccelli che ingeriscono pallini da caccia rimasti sul
terreno, scambiandoli per semi. Anche i rapaci che cacciano questi uccelli sono a rischio piombo.
Per questo in vari paesi i pallini di piombo sono stati proibiti. Potenzialmente anche l’uomo può
assumere piombo mangiando selvaggina uccisa con munizioni al piombo. Va ricordato che il Pb0 è
in sé un problema ambientale minore, ma il rischio è che si trasformi in Pb2+ che è invece tossico.
Condutture idrauliche. Il piombo è stato largamente usato per saldature e tubi di condutture
idriche. Il passaggio dell’acqua nei tubi può disciogliere del piombo che finisce nell’acqua
contaminandola. Con acque dure si forma carbonato di piombo PbCO 3 che forma una pellicola
protettiva e impedisce il contatto Pb/acqua, ma con acque dolci è necessario aggiungere dei fosfati
che producono lo stesso effetto. Prima di bere da fontane di piombo è consigliabile far scorrere
l’acqua in modo da diminuire la possibile concentrazione di piombo che viene più facilmente
assimilato dall’organismo nelle bevande che non nei cibi solidi. Adesso che le tubature non sono
più fatte di piombo la dose di piombo assunta con l’acqua potabile è fortemente diminuita per cui
attualmente la maggior assunzione avviene dai cibi.
ivo cacelli – chimica ambientale I - 2015
metalli pesanti -
6
Batterie per automobili. Il piombo metallico viene usato, insieme con l’ossido PbO2, nelle batterie
di accumulatori dei veicoli a motore; questo costituisce al momento l’uso primario di tale elemento.
Una volta che le batterie non funzionano più vengono trasportate per essere riciclate ed in questa
fase ci possono essere dispersioni di piombo
nell’ambiente.
Da Il Fatto Quotidiano 16/1/2013
Saldature
Avvelenamento da piombo:
Il piombo è anche usato nelle saldature come metallo, ma
spiegazione inaspettata della
può ossidarsi all’aria e trasformarsi in Pb2+.
violenza
Smalti e pigmenti. Una forma di ossido di piombo PbO
.... Non sembra che ci siano dati
(giallo) veniva usato per smaltare la ceramica e conferirle
disponibili per l’Italia, ma l’ondata di
lucentezza. Oltre alla possibile dispersione nell’ambiente,
violenza che ha colpito le città degli
Stati Uniti negli anni ’90 si correla
se la ceramica viene usata per conservare o consumare
molto bene con l’avvelenamento da
cibi, una dose di piombo viene assunta con gli alimenti.
In primo luogo con la quantità
Questo avviene tuttora in Messico, dove la principale piombo.
di piombo nell’ambiente come risultato
fonte di assunzione di piombo avviene attraverso i cibi sia dell’uso della benzina super, sia di
assunti o conservati in recipienti di ceramica. Oggigiorno
vernici al piombo nelle case e altri
si usano invece silicati di piombo che sono molto poco fattori. Poi, c’è una correlazione diretta
fra la probabilità di commettere un
solubili in acqua, per cui rilasciano pochissimo piombo
crimine violento e la quantità di
nell’ambiente.
piombo misurata nel sangue.
Un altro composto usato per pigmenti è un miscuglio di
Pb2O3 e Pb3O4 (minio) che è rosso ed ha la proprietà di proteggere il ferro dalla corrosione.
Additivi al piombo nelle benzine. Il piombo IV forma dei composti covalenti come il piombo
tetraetile Pb(C2H5)4 che è stato largamente usato come additivo alla benzina per conferirle proprietà
antidetonanti, cioè per evitare lo scoppio nel cilindro del motore, prima della compressione
massima. Negli scarichi delle auto veniva rilasciato PbO che è volatile e si disperde nell’ambiente.
Inoltre nelle fasi di trasporto e di rifornimento il piombo tetraetile tende a evaporare per la sua
volatilità e si disperde nell’aria. Questo composto non si scioglie nell’acqua ma
può venire assorbito attraverso la cute ed è molto tossico sia per il fegato che per
il sistema nervoso centrale, dato che è in grado di passare le membrana
encefalica. Dosi molto elevate di composti tetra-alchilici sono letali. Adesso che
gli additivi al piombo sono stati sostituiti con altri antidetonanti (benzene,
toluene, metil-t-butiletere, ferrocene, …) la concentrazione nelle aree urbane è
diminuita drasticamente e come conseguenza la concentrazione di piombo nel sangue è pure
diminuita. Qualcuno ha detto però che si è sostituito un composto neurotossico con uno
cancerogeno, anche se il benzene dovrebbe essere totalmente distrutto nella marmitta catalitica.
D’altra parte la presenza di piombo nelle benzine distrugge le marmitte catalitiche, per cui in ogni
caso andava eliminato come additivo alle benzine.
In natura la metilazione del piombo (a differenza di Hg) avviene in maniera limitata e quasi tutto il
piombo legato a gruppi organici presente nell’ambiente è di origine antropica (benzine).
Conclusioni: Il piombo è meno pericolosa del mercurio, ma poiché viene liberato da una più
ampia varietà di fonti, in genere si trova a livelli di inquinamento superiori a quelli del mercurio e
più vicini alla soglia in cui compaiono fattori di avvelenamento. Inoltre il numero di persone
esposte a piombo è superiore a quelle esposte a mercurio. Entrambi i metalli sono più tossici nella
forma di composto organico rispetto alla forma di cationi.
CADMIO
NA=48 Tfus=312ºC Tb=767 ºC Num. Oss. =+2 densità= 8.6 gr/cm3
Il cadmio allo stato elementare ha aspetto metallico bianco-argenteo con riflessi azzurrognoli, è
tossico e relativamente raro. Si trova nei minerali dello zinco ed è largamente impiegato nelle pile
ivo cacelli – chimica ambientale I - 2015
metalli pesanti -
7
ricaricabili. Come catione ha un unico numero di ossidazione +2. Forma
diversi sali ionici ma non composti covalenti con gruppi organici.
Le fonti di cadmio
I minerali di cadmio sono rari e si trovano in piccole quantità. Il solfuro di
cadmio CdS, l'unico minerale di cadmio importante, è quasi sempre
associata al solfuro di zinco. Perciò il cadmio viene estratto in genere come
sottoprodotto dell'estrazione e della raffinazione dello zinco ed anche del piombo e del rame per cui
si è osservata contaminazione da cadmio nelle zone di impianti di fusione di zinco, piombo e rame.
Si trova anche nel carbone in piccole quantità che vengono rilasciate nell’ambiente durante la
combustione.
Usi industriali
Il cadmio è usato principalmente come elettrodo nelle batterie ricaricabili (nickel-cadmio) in cui si
ossida a Cd(OH)2 che si ritrasforma in Cd0 durante la ricarica. Poiché negli inceneritori è difficile
trattenere i vapori di cadmio, le batterie vanno eliminate nella raccolta differenziata.
Si usa come pigmento nella forma di solfuro CdS di color giallo
soprattutto per colorare le plastiche. La precisa tonalità del giallo dipende
dalle dimensioni delle particelle nella polvere. Questo composto è stato
largamente impiegato dai pittori, come Van Gogh ed altri, per ottenere
colori giallo brillante. Recentemente si è usato il cadmio anche nelle celle
fotovoltaiche.
Assunzione
Poiché il cadmio assomiglia allo zinco, che è necessario per vita animale e vegetale, le piante lo
assorbono come Cd2+ sciolto nell’acqua di irrigazione per cui viene inserito nella catena alimentare
fino all’uomo. Gli alimenti contaminati possono essere patate, grano, riso ed altri cereali. Le
contaminazioni da cadmio più rilevanti sono in prossimità di miniere per l’estrazione di minerali
non ferrosi e di impianti di fusione degli stessi.
Il più grave incidente ambientale da cadmio è avvenuto in Giappone dove le colture di riso di una
certa regione erano irrigate con l’acqua di un fiume che aveva a monte una industria di estrazione e
fusione dello Zn, che era contaminato con Cd. Il riso era pure contaminato e alte dosi di Cd vennero
assunte dagli abitanti locali, molti dei quali furono colpiti da una malattia ossea con forti dolori alle
articolazioni. La ragione era che molto Ca2+ delle ossa veniva sostituito con Cd2+, che ha la stessa
carica e dimensioni simili (come visto prima, lo stesso accade con il piombo) ma non esercita le
stesse funzioni del calcio nelle ossa, che in questo modo si indeboliscono a vanno incontro a
fratture.
Effetti sulla salute e protezione
Oltre agli effetti sul sistema scheletrico appena visto, il cadmio ha molteplici effetti negativi sulla
salute dell’uomo. I meccanismi sono tipicamente due: legami con i gruppi solfidrici degli enzimi e
sostituzione di metalli simili, ma biologicamente utili. I principali effetti dannosi del cadmio sono i
seguenti:
• inibisce il rilascio di acetilcolina (neurotrasmettitore) originando iperattività, cefalea ed altro
• sostituisce lo Zn nelle arterie creando disturbi cardiovascolari come ipertensione
• altera il metabolismo del calcio e fosforo con osteoporosi e fragilità dentale
• antagonizza lo zinco per la produzione d’insulina e testosterone, con disfunzioni sessuali nei
maschi.
Perciò il cadmio è molto tossico e un solo grammo nell’organismo può essere letale, al contrario
dello zinco che è presente nell’organismo in 2-3 grammi e svolge funzioni biologiche. Per bassi
livelli di cadmio l’uomo ha una difesa naturale costituita dalla metallo-tioneina, una proteina
ivo cacelli – chimica ambientale I - 2015
metalli pesanti -
8
contenente molti gruppi –SH che chelano il Cd2+ nel corpo umano. Il complesso viene poi eliminato
con le urine. Per alti livelli di cadmio questa sostanza non è sufficiente e il cadmio si accumula nel
fegato e nei reni, dove può rimanere anche per decenni, con gravi danni funzionali.
CROMO
NA=24 Tfus=1857ºC Tb=2672 ºC Num. Oss. =+3,+6 densità= 7.1 gr/cm3
Il cromo si trova nei composti chimici quasi sempre negli stati di ossidazione +3 o +6. In condizioni
ossidanti (o aerobiche) è presente il Cr(VI) (cromato) come CrO42-mentre in condizioni riducenti (o
anaerobiche) prevalgono i composti del Cr(III). Il primo risulta
più solubile del secondo, che precipita in soluzione acquosa come
Cr(OH)3. Entrambe le forme sono di colore giallo.
Gli effetti sulla salute sono assai diversi visto che il Cr(III) è poco
tossico mentre il Cr(VI) è molto tossico, ad è considerato un
agente cancerogeno a causa del suo forte potere ossidante che gli
permette di ossidare anche molte molecole biologiche come per
esempio il DNA.
Uso del cromo
Il cromo si estrae sotto forma di cromite (FeCr 2O4). Circa metà della cromite estratta nel mondo
viene dal Sudafrica. Altri produttori importanti sono il Kazakistan, l'India e la Turchia. La
produzione industriale di cromo è cresciuta molto nell’ultimo secolo a causa della grande utilità di
questo metallo nella protezione dalla corrosione. Viene infatti aggiunto agli acciai o depositato in
sottili strati sulle superfici metalliche (cromature). Viene anche usato nella concia della pelle; il
Cr(III) si lega alle proteine della cute dell’animale formando un pellame resistente all’acqua e ai
batteri.
Cromo nelle acque potabili
Dato il suo elevato punto di fusione il cromo non si trova
nell’aria, ma soltanto sulla superficie della Terra e nelle
acque, in cui manifesta la sua massima pericolosità. Il
cromo è un comune inquinante dell’acqua, soprattutto
nelle falde vicine a industrie per la placcatura o anche
vicino a depositi di rifiuti pericolosi. La forma più
frequente è il Cr(VI) perché è più solubile in acqua del
Cr(III). Infatti per eliminarlo si fa reagire per es. con solfiti
che lo riducono a Cr(III) che precipita e può essere
separato dall’acqua.
CCA come preservante del legno
dal Corriere della Sera – 25/9/2013
Brescia, dai rubinetti esce
sempre più cromo
Dai rubinetti della zona ovest di
Brescia e della Bassa Valtrompia
scende acqua con sempre più
cromo. Un aumento legato ad
una questione geofisica: non
sono
aumentate
le
fonti
inquinanti, il problema è che i
veleni rilasciati nell'ambiente in
passato proseguono inesorabili
la loro discesa verso la falda
profonda.
Una fonte di Cr significativa per l’ambiente è costituita
dall’arseniato cromato di rame (CCA, Chromated Copper
Arsenate), un preservante del legno di cui si è fatto un
ampio uso nel passato. Questa sostanza veniva impiegata per proteggere le strutture in legno, che
con il tempo rilasciano nell’acqua non solo cromo ma pure arsenico e rame. Durante un periodo di
fissazione di varie settimane, il Cr(VI) del trattamento viene ridotto quasi completamente a Cr(III)
mediante una reazione con il carbonio presente nel legno. Questo processo porta alla produzione di
complessi insolubili che si liberano con estrema lentezza dal legno trattato, immettendo Cu, As e Cr
nell’ambiente.
ivo cacelli – chimica ambientale I - 2015
metalli pesanti -
9
ARSENICO
NA=33 Tsubl=614 ºC Num. Oss. =-3,+3,+5 densità= 5.7 gr/cm3 [Ar]3d10 4s2 4p3
L’arsenico non è un vero metallo, ma un metalloide, cioè ha proprietà
intermedie tra metalli e non metalli (infatti . Nella tavola periodica sta
nello stesso gruppo dell’azoto e del fosforo che
hanno configurazione elettronica s2p3. Tipicamente
forma tre legami con numero di ossidazione -3 o +3
As(III) a seconda della elettronegatività dell’altro
elemento, oppure 5 legami in cui si trova nella
configurazione sp3d ed ha numero di ossidazione +5, As(V). Nelle figure
accanto sono mostrati lo ione arsenito As(III) derivante dall’acido arsenioso
HAsO2 e dello ione arseniato As(V) derivante dall’acido arsenico H 3 AsO4.
Dal punto di vista chimico si comporta come il fosforo e per questo accade
che giacimenti di fosfati o fosfati commerciali siano contaminati dagli
analoghi composti dell’arsenico. Rispetto al fosforo forma più facilmente
legami ionici che covalenti.
L’ossido di arsenico bianco As2O3 è famoso come veleno ed è stato
largamente usato nella storia per omicidi e suicidi. Fino al 1600 era da alcuni considerato
terapeutico a piccole dosi ed ancora oggi diversi farmaci cinesi contengono piccole dosi di arsenico,
dato che sembra che tracce di As nell’organismo producano effetti benefici per la salute umana.
Danni alla salute
L’assunzione di arsenico nell’organismo produce danni gastro intestinali (vomito, diarrea), gravi
danni alla pelle e cancro al polmone. In generale As(III) risulta più tossico di As(V) che viene
comunque ridotto ad As(III) nel corpo umano. Il meccanismo di azione è quello tipico dei metalli di
legarsi agli enzimi solforati e di inibirne il corretto funzionamento. Dato che forma legami covalenti
stabili con il carbonio, l’arsenico viene in parte metilato nel fegato, perdendo la sua tossicità perché
in questa forma non è in grado di formare legami con gli enzimi e viene eliminato con le urine.
Quindi il meccanismo di metilazione costituisce un processo di detossificazione naturale
dell’organismo, anche se ha come conseguenze possibili danni al DNA.
Fonti di arsenico
L’arsenico si trova in natura in modeste quantità. Le
fonti antropogeniche di dispersione nell’ambiente
sono costituite da:
• uso di As in pesticidi, diserbanti e insetticidi come
l’arseniato di calcio Ca3(AsO4)2 e arseniato di
piombo Pb3(AsO4)2
• estrazione e fusione di oro, rame, nickel nei cui
minerali si trova dell’arsenico
• processi di produzione di ferro e acciaio
• combustione del carbone, di cui è un contaminante.
Arsenico nell’acqua potabile
L’acqua potabile contaminata da arsenico rappresenta
un’importante, forse la più importante, fonte di
assunzione di questo elemento per molte persone. La
contaminazione di origine naturale è spesso più
14 gennaio 2013
Nella provincia di Viterbo in 40
comuni su 60 sono in vigore dal primo
gennaio specifiche ordinanze per
combattere il problema arsenico: i
sindaci in pratica hanno dichiarato la
non potabilità dell’acqua. In base alle
ordinanze in vigore gli unici utilizzi
consentiti sono il lavaggio di
indumenti, stoviglie e ambienti, scarico
water e impianti di riscaldamento.
Vietato bere, cuocere, preparare
alimenti e bevande, perfino lavarsi i
denti. Non consentito fare la doccia nel
caso in cui si abbiano patologie
cutanee.
ivo cacelli – chimica ambientale I - 2015
metalli pesanti -
10
importante di quella antropogenica, a causa della presenza dell’arsenico nella crosta terrestre. In
molte parti del mondo le falde freatiche sono contaminate da arsenico inorganico, che essendo
inodore e insapore, non risulta facile da individuare.
Il maggiore problema ambientale per l’arsenico nelle acque potabili accadde del Bangladesh negli
anni 70, dove la concentrazione
risultò anche 50 volte la dose di soglia
indicata dalla OMS. Il problema
derivò dai pozzi per irrigazione e
acqua potabile, che furono scavati in
grande quantità per debellare colera e
peste, proprio in un progetto
dell’OMS. Anche le colture tipiche di
questa regione come cereali e fagioli,
furono contaminate. Come già
menzionato,
gli
effetti
di
avvelenamento cronico da arsenico
sono cancro alla pelle, al fegato, reni
a soprattutto al polmone, che furono effettivamente osservati nella popolazione del Bangladesh.
Si sono registrati problemi anche in Cile, dove si è ritenuto che il numero di decessi in età inferiore
a trenta anni sia collegato all’eccessiva presenza di arsenico nelle acque potabili.