ATOMI
Solo all'inizio del XIX secolo J. Dalton propose la
teoria atomica moderna
Dalton formulò la sua teoria atomica avvalendosi delle
conoscenze chimiche che possedeva:
➢
la legge della conservazione della massa (di Lavoisier)
➢
la legge delle proporzioni definite (di Proust)
ChimicaGenerale_lezione2
1
Legge della conservazione della
massa
in un sistema chiuso: in una reazione
chimica, la massa dei reagenti è esattamente
uguale alla massa dei prodotti
nulla si crea, nulla si distrugge,
ma tutto si trasforma
ChimicaGenerale_lezione2
2
Legge delle proporzioni definite
quando due o più elementi reagiscono, per formare
un determinato composto, si combinano sempre
secondo proporzioni in massa definite e costanti
Secondo Proust, "...un composto è un prodotto
privilegiato al quale la natura ha dato una
composizione costante".
Esempio: carbonato di rame, CuCO3, naturale o preparato in laboratorio,
contiene rame, carbonio e ossigeno sempre nelle stesse proporzioni.
ChimicaGenerale_lezione2
3
La teoria atomica di Dalton
la materia è formata da piccolissime particelle
indivisibili e indistruttibili (gli atomi) che non
possono essere né create né distrutte
gli atomi di uno stesso elemento sono tutti uguali
tra loro
gli atomi di un elemento non possono essere
convertiti in atomi di altri elementi
gli atomi di elementi diversi si combinano tra loro
in rapporti di numeri interi e generalmente piccoli,
dando così origine a composti
ChimicaGenerale_lezione2
4
Legge delle proporzioni definite
In un dato composto,
gli elementi che lo costituiscono sono sempre
combinati nelle stesse proporzioni in peso,
indipendentemente dall’origine
e dal metodo di preparazione.
H + Cl
2
2
→2
HCl
ChimicaGenerale_lezione2
5
Legge proporzioni multiple
Se due elementi formano più di un composto,
i vari pesi di uno di essi
che si combinano con lo stesso peso dell’altro
stanno nel rapporto di numeri interi piccoli.
N2O , NO , NO2
16 grammi di ossigeno
si combinano rispettivamente con
28, 14, 7 grammi di azoto.
Rapporto 4 : 2 :1
ChimicaGenerale_lezione2
6
Problema per i chimici dell’800:
come determinare i pesi atomici e le formule
molecolari simultaneamente
Gay-Lussac (1808)
i volumi delle sostanze che si combinano (P,T costanti)
stanno tra loro in rapporto di numeri interi semplici.
NH3 (g) + H2CO3 (aq) → NH4HCO3(aq)
2 NH3 (g) + H2CO3
(aq)
→ (NH4)2CO3(aq)
Rapporto 1:2 (valida la legge delle proporzioni multiple)
ChimicaGenerale_lezione2
7
Avogadro
Intuizione: gli atomi in fase gassosa possono
essere molecole biatomiche!
azoto + ossigeno
→ ossido di azoto
1 volume + 1 volume
→
2 volumi
n molecole + n molecole →
2n molecole
N2 + O2
→
2NO
2H2 + O2
→
2 H2O
ChimicaGenerale_lezione2
8
Cannizzaro (1858)
Ogni molecola contiene un numero
intero di atomi di ogni elemento.
Ax By Cz
HClO
HClO2
HClO3
HClO4
ChimicaGenerale_lezione2
9
facendo uso del principio di
Avogadro…
“…nelle stesse condizioni di pressione e temperatura
volumi uguali di gas contengono lo stesso numero di
molecole, le masse di questi volumi devono stare tra loro
come le masse delle molecole, ovvero come i pesi
molecolari”.
Con questo insieme di pesi molecolari relativi, Cannizzaro
definì che il peso molecolare dell’idrogeno doveva essere 2
e fissò i valori dei pesi molecolari assoluti degli altri
elementi.
Il riferimento attuale è il peso del 12C che è definito
esattamente 12.
ChimicaGenerale_lezione2
10
Elettroni, protoni e neutroni
Gli atomi, quindi tutta la materia,
sono formati da tre particelle
fondamentali: gli elettroni, i
protoni ed i neutroni.
Le masse del protone e del
neutrone sono quasi uguali,
mentre la massa dell’elettrone è
molto più piccola.
La carica del neutrone è nulla.
La carica dell’elettrone è uguale a
quella del protone, ma di segno
contrario.
ChimicaGenerale_lezione2
11
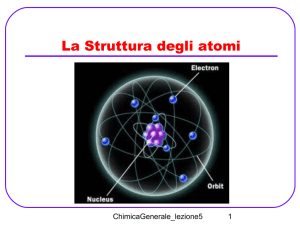
Struttura dell’atomo
L’atomo è soprattutto
spazio vuoto!
La figura non è in scala:
se il nucleo fosse di queste
dimensioni la nube elettronica si
estenderebbe per 200m!
ChimicaGenerale_lezione2
12
Proprietà delle particelle
atomiche
ChimicaGenerale_lezione2
13
Numero Atomico “Z”
La carica netta di un atomo è zero, quindi il
numero di protoni e di elettroni è uguale.
Il numero atomico “Z” di un elemento è
definito come il numero di protoni
presenti nel nucleo.
ChimicaGenerale_lezione2
14
Numero di massa A
Il numero di massa A è pari alla somma delle masse
di tutti i protoni e neutroni presenti in un atomo
Quando di un elemento si vuole specificare il numero di
massa, lo si scrive in alto (in posizione apice), a sinistra
del simbolo chimico
A
Z
X→simbolo elemento
ChimicaGenerale_lezione2
15
Esempio
Qual'è numero di massa di
un atomo di fosforo con 16 neutroni?
Se l'atomo ha una massa effettiva di 30.9738u,
qual'è la sua massa in grammi?
Qual'è la massa dell'atomo di fosforo
relativamente a quella del carbonio con numero
di massa 12?
ChimicaGenerale_lezione2
16
Gli atomi di P hanno 15 protoni (ricavabile da numero
atomico Z); quindi posso ricavare il numero di massa
pari a protoni + neutroni: (15+16)= 31
La massa dell'atomo in grammi si ottiene usando il
fattore di conversione
1u = 1.66054 x 10-24 g
massa31P=(30.9738u) x (1.66054 10-24 g/u)= 15.14332 x
10-23 g
La massa rispetto al carbonio sarà
30.9738/12.0000=2.58115ovvero l'atomo di fosforo-31
è 2.58115volte più pesante del carbonio-12.
ChimicaGenerale_lezione2
17
Elementi Ioni ed Isotopi
Ad ogni numero atomico corrisponde un
diverso elemento chimico.
In un atomo neutro il numero atomico è pari
anche al numero di elettroni; in caso contrario
l'atomo è detto ione.
Atomi aventi stesso numero atomico ma
diverso numero di neutroni (quindi diverso
numero di massa A) sono detti isotopi.
ChimicaGenerale_lezione2
18
Abbondanza Isotopica %
(Numero atomi di un isotopo)
(Numero totale atomi di tutti isotopi
dell'elemento)
ChimicaGenerale_lezione2
19
ChimicaGenerale_lezione2
20
Peso Atomico
Da dati sperimentali risulta evidente che ogni elemento
ha una sua massa e che questa è relativa agli altri
elementi.
In base a questo è possibile definire una scala relativa
delle masse atomiche.
Viene introdotta una scala di pesi atomici relativi basati
sull’unità di massa atomica (uma) che è chiamata
anche peso atomico.
ChimicaGenerale_lezione2
21
uma
l’unità di massa atomica viene definita come
1/12 esatto della massa di un
particolare atomo di carbonio,
chiamato carbonio-12
In questa scala, il peso atomico dell’idrogeno è 1.00794
uma, quello del sodio 22.989768 uma.
ChimicaGenerale_lezione2
22
Peso atomico e abbondanza
isotopica
La massa atomica di un elemento è
sempre più vicino alla massa dell'isotopo
più abbondante.
Peso Atomico = [(abbondanza%
dell'isotopo1)/100] x (massa isotopo1)+
[(abbondanza% dell'isotopo2)/100] x
(massa isotopo2) +.....
ChimicaGenerale_lezione2
23
Esempio
Il bromo ha 2 isotopi : uno con massa
78.918338 u e abbondanza 50.69%, l'altro di
massa 80.916291 u con abbondanza 49.31%.
Calcola peso atomico del bromo.
Peso atomico del bromo = [(50.69/100) x
78.918338] + [(49.31/100) x 80.916291] =79.90
ChimicaGenerale_lezione2
24
ChimicaGenerale_lezione2
25
Tavola Periodica degli elementi
La tavola periodica degli elementi
è lo schema con il quale vengono
ordinati gli elementi sulla base del
loro numero atomico Z.
ChimicaGenerale_lezione2
26
Tavola periodica di Mendeleev
Ideata dal chimico russo Dimitrij Mendeleev nel 1869,
contemporaneamente ed indipendentemente dal
chimico tedesco J. L. Meyer, inizialmente contava
numerosi spazi vuoti, previsti per gli elementi che
sarebbero stati scoperti in futuro, alcuni nella seconda
metà del 1900. Si basava sui pesi atomici, poichè il
concetto di numero atomico divenne chiaro solo agli
inizi del XX secolo.
ChimicaGenerale_lezione2
27
Gruppi e Periodi
ChimicaGenerale_lezione2
28
Gruppi
Ogni gruppo (colonna) della tabella
comprende gli elementi che hanno la
stessa configurazione elettronica
esterna: all'interno di ogni gruppo si
trovano elementi con caratteristiche
chimiche simili
ChimicaGenerale_lezione2
29
I e II Gruppo:
metalli alcalini
e alcalinoterrosi
ChimicaGenerale_lezione2
30
Gruppo 4
Carbonio (in basso)
Silicio (centro a sin)
Stagno (centro dx)
Piombo (in alto)
ChimicaGenerale_lezione2
31
Gruppo 5
N e P non metalli
As e Sb semimetalli
Bi metallo
ChimicaGenerale_lezione2
32
Gruppo 7
Cloro (gassoso, a sin);
bromo (liquido, al centro);
iodio (solido, a dx)
ChimicaGenerale_lezione2
33
Periodi
Ogni periodo (riga) della tabella
inizia con un elemento il cui atomo ha
come configurazione elettronica
esterna un elettrone di tipo s,
e procedendo verso gli atomi
successivi nel periodo,
il numero atomico Z aumenta di una
unità ad ogni passaggio.
ChimicaGenerale_lezione2
34
ChimicaGenerale_lezione2
35
Regioni
Metalli: solidi, duttili
malleabili, conduttori di
calore ed elettricità
Metalloidi: ambiguità di
comportamento
Non metalli: solidi
gassosi o liquidi, non
Metalli
conduttori (eccezione per
carbonio-grafite)
Metalli di Metalloidi
transizione
ChimicaGenerale_lezione2
36
Non metalli
Metalli: filo di molibdeno, oggetto in bismuto, grani di rame
Non metalli: Bromo liquido, iodio solido
Metalloidi: silicio
ChimicaGenerale_lezione2
37
Le Molecole
La molecola è la parte più piccola di un elemento o di
un composto che può esistere libera e stabile in natura
Modelli in scala approssimativa delle molecole diatomiche
ChimicaGenerale_lezione2
38
Modello Molecole
Molecole di fosforo bianco P4
Molecole di zolfo rombicoS8
ChimicaGenerale_lezione2
39
ChimicaGenerale_lezione2
40
Le Formule Chimiche
La formula chimica di una sostanza
descrive la sua composizione chimica
Riporta il tipo di atomo
e il numero di essi presenti
AxByCz
ChimicaGenerale_lezione2
41
Formule Molecolari e
Formule di Struttura
La formula molecolare fornisce il numero
di atomi di ciascun tipo all’ interno della
molecola.
La formula di struttura evidenzia la
connessione tra gli atomi.
I trattini che uniscono i simboli degli atomi
rappresentano i legami chimici.
I legami sono forze che uniscono gli atomi a distanze e
angoli caratteristici.
ChimicaGenerale_lezione2
42
ChimicaGenerale_lezione2
43
Formule e modelli strutturali
Ball-and-stick mette
in evidenza la
struttura 3D e i
legami delle
molecole, con sfere
di colore diverso per
i diversi atomi;
Space-filling mostra
le dimensioni relative
di atomi e la forma
della molecola.
ChimicaGenerale_lezione2
44
Il metano CH4
ChimicaGenerale_lezione2
45
I Composti Ionici
Alcuni composti come “NaCl” sono formati da un
raggruppamento di ioni.
Ioni sono atomi o gruppi di atomi
con carica elettrica
Cationi, ioni positivi, da atomi che tendono a cedere e-( es. Na+)
Anioni, ioni negativi, da atomi che tendono ad acquisire e-(es. Cl-)
ChimicaGenerale_lezione2
46
ChimicaGenerale_lezione2
47
Catione o anione?
Un atomo di un elemento formerà
preferenzialmente un catione o un anione?
I metalli generalmente cedono elettroni
formando cationi
I non metalli frequentemente acquistano
uno o più elettroni dando origine agli
anioni
ChimicaGenerale_lezione2
48
Ioni
+
Li→Li +e
-
e +F→F
-
-
ChimicaGenerale_lezione2
49
Ioni monoatomici- Metalli
I metalli dei Gruppi 1A-3A formano ioni positivi
con carica pari al gruppo di appartenenza
Gruppo 1A
Na -1e- → Na+
Gruppo 2A
Ca -2e- → Ca2+
3+
Gruppo 3A
Al -3e → Al
I metalli di transizione formano cationi, ma il
comportamento non è facilmente prevedibile.
ChimicaGenerale_lezione2
50
Ioni monoatomici-non metalli
I non metalli formano spesso ioni con
carica negativa pari al (n°del gruppo-8)
5A N(7p 7e-)
6A S(16p 16e )
7A Br(35p 35e-)
+3e- → N3-(7p 10e-)
2+2e → S (p 16 18e )
+1e- → Br-(35p 36e-)
ChimicaGenerale_lezione2
51
Cariche di cationi e anioni
monoatomici
ChimicaGenerale_lezione2
52
Ioni Poliatomici
Gli ioni poliatomici sono
costituiti da 2 o più atomi e
l'insieme possiede carica
elettrica
NH4+, catione ammonio
CO
23
, anione carbonato
ChimicaGenerale_lezione2
53
ChimicaGenerale_lezione2
54
Esercizio
Scrivere gli ioni presenti in:
Li2CO3
Fe2(SO)4
CaCl2
Ca3(PO4)2
Scrivere la formula di : anione floruro,
nitrato, solfuro
ChimicaGenerale_lezione2
55
Nomi dei composti ionici
Nella formula il catione precede l'anione
Nella lettura l'anione è seguito dalla
specificazione del catione
CaBr2 bromuro di calcio
ChimicaGenerale_lezione2
56
Alcuni Composti Ionici
ChimicaGenerale_lezione2
57
Proprietà dei composti ionici
+
-
Legge di Coulomb : Fattraz= K (n e)(n e)
2
d
In base alla legge di Coulomb la forza di
attrazione tra ioni con carica opposta
aumenta con
L'aumento di carica dello ione
La diminuzione di distanza tra ioni
ChimicaGenerale_lezione2
58
ChimicaGenerale_lezione2
59
Proprietà strutturali
La struttura reticolare
propria dei composti
ionici è responsabile di:
Stato solido
Durezza
ChimicaGenerale_lezione2
60
Fratture nei solidi ionici
Un colpo sul cristallo avvicina ioni di carica uguale:
la repulsione causa la rottura del cristallo.
ChimicaGenerale_lezione2
61
Composti Molecolari
Sebbene molte sostanze abbiano
una formula chimica associata, non
sempre tali sostanza sono costituite
da molecole.
saccarosio
Molte sostanze comuni sono
composte da molecole (l'acqua, lo
zucchero da tavola, i gas che
costituiscono l'aria), mentre altre
sostanze altrettanto comuni non lo
sono (il sale è un composto ionico,
per esempio).
ChimicaGenerale_lezione2
62
Composti molecolari binari
(2 elementi)
Molti composti molecolari binari sono
combinazione tra elementi dei gruppi 4A7A,o tra questi e l'idrogeno.
La formula è scritta elencando gli elementi
in ordine crescente
Nella pronuncia viene prima l'elemento
maggioritario con il giusto prefisso
NF3 trifloruro d'azoto
ChimicaGenerale_lezione2
63
Nomenclatura composti non
ionici
Scrivere la formula di
Biossido di carbonio
Dicloruro di zolfo
Trifluorurodi boro
Triossido di fosforo
ChimicaGenerale_lezione2
64