REGIONE SICILIANA
AZIENDA USL N° 6
DIPARTIMENTO DEL FARMACO
Anno 4° n°13 aprile - giugno 2003
AZIENDA
6
PALERMO
Via Pindemonte, 88 90129 – Palermo
e-mail: [email protected]
REGIONE SICILIANA
AZIENDA USL N° 6
DIPARTIMENTO DEL FARMACO
AZIENDA
6
PALERMO
Comitato di Consulenza:
Direzione Sanitaria A. USL N° 6 – Palermo
Comitato di Redazione:
Dott.ssa Franca Galante Resp. Dipartimento del Farmaco
Dott.ssa Marisa Parelli
Dott.ssa Anna Rogato
Farmacista Dirigente
Farmacista Dirigente
Stampa a cura del signor RIELA e collaboratori
Servizio Economato A USL 6
REGIONE SICILIANA
AZIENDA USL N° 6
DIPARTIMENTO DEL FARMACO
AZIENDA
6
PALERMO
Sommario
NOVITA' FARMACI ………………………………………………….pag
1
DISPOSIZIONI IN MATERIA DI “GENERICI”…………………….pag
2
A proposito di stupefacenti ……………………………………….pag
13
Ministero della Salute ………………………………………………pag
" Manifesto sui Principi Etici dell'informazione sui farmaci "
16
Farmacopea Ufficiale XI Ed. ……………………………………...pag
17
IN MATERIA DI FARMACOVIGILANZA………………………….. .pag
18
SPECIALITA’ MEDICINALI IMMESSE IN COMMERCIO……….. pag
21
MEDICINALI GENERICI IMMESSI IN COMMERCIO……………. pag
22
MODIFICHE A.I.C. …………………………………………………… pag
24
DECRETI MINISTERO DELLA SALUTE …………………………..pag
26
SOSPENSIONI……………………………………………………...…pag
28
REVOCHE……. ……………………………………………………….pag
29
REGIONE SICILIANA
AZIENDA USL N° 6
DIPARTIMENTO DEL FARMACO
REGIONE SICILIANA
AZIENDA USL N° 6
DIPARTIMENTO DEL FARMACO
Topiramato
L’antiepilettico Topiramato, secondo
quanto riportato da un nuovo studio,
pubblicato sul numero del 17 maggio
2003 della rivista “ The Lancet”, è in
grado di favorire l’astinenza negli
individui con dipendenza da alcool.
Nello studio sono stati arruolati 150
soggetti, forti bevitori, randomizzati
al trattamento con Topiramato (
posologia massima 300 mg/die per os
) o con placebo per tre mesi ,
unitamente ad un minimo intervento
di terapia comportamentale.
Nel gruppo di soggetti trattati con
Topiramato, rispetto al placebo, è
stata evidenziata una maggiore
probabilità di astenersi dal consumo
di alcool ed una significativa
riduzione dei livelli di GGT , Gamma
Glutamil
Transferasi,
enzima
aumentato nelle epatopatie alcooliche.
Ranpirnasi
Ranpirnasi è un nuovo agente con
azione citostatica / citotossica nei
confronti di diverse linee tumorali,
attualmente sperimentato, in fase III,
nel trattamento del mesotelioma
maligno inoperabile.
Ranpirnasi è una ribonucleasi,
presente negli anfibi, che agisce
distruggendo l’RNA e questo
particolare meccanismo d’azione
potrebbe consentire la sua attività
antitumorale contro alcune linee cellulari
di tumore, resistenti alla chemioterapia
convenzionale.
Ranpirnasi si è inoltre dimostrato
efficace nel trattamento di virus mutati e
potrebbe rappresentare un potenziale
agente antivirale nei confronti di HIV e
SARS.
Vaccino antinfluenzale in spray
La FDA ha approvato a giugno il primo
vaccino antinfluenzale in formulazione
spray nasale. Il vaccino è costituito dai
tre ceppi di virus influenzali, due del tipo
A e uno del tipo B, raccomandati
dall’OMS per la stagione influenzale
2003-2004.
Il vaccino è stato studiato in precedenti
studi clinici condotti su circa 20.200
soggetti e l’efficacia nel prevenire
l’influenza è risultata pari all’87 % circa
nei soggetti di età compresa tra i 5 e i 17
anni.
I più comuni effetti collaterali riscontrati
durante il trattamento con tale vaccino
sono rappresentati da congestione nasale,
rinorrea, faringite e tosse.
Il nuovo vaccino antinfluenzale spray è
controindicato
nei
soggetti
immunodepressi , nei soggetti con asma
e altre malattie reattive delle vie
respiratorie, nei soggetti di età inferiore
ai 5 anni e superiore ai 50 anni e nei
soggetti con allergia alle uova o a
precedenti vaccini.
Fonte:Giofil
REGIONE SICILIANA
AZIENDA USL N° 6
DIPARTIMENTO DEL FARMACO
ASSESSORATO REGIONALE PER LA SANITA'
ASSESSORATO REGIONALE PER LA SANITA'
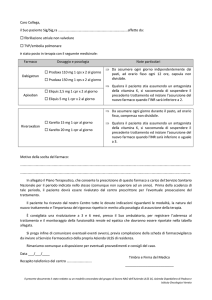
Circolare n. 1111 del 18.04.03 Legge n. 178 del 8.8.02 - art. 9 " Prezzo di rimborso dei farmaci di uguale
composizione ". Aggiornamento dell'elenco dei medicinali non coperti da
brevetto.
L’Assessorato Regionale alla Sanità con circolare n. 1111 del 18
aprile, rende noto l’elenco dei medicinali soggetti alla disciplina
del prezzo di riferimento , sulla base dell’aggiornamento
ministeriale del 08 aprile 2003, consultabile sul sito Internet :
www ministerosalute.it.
La circolare precisa che :
i nuovi prezzi di riferimento regionale si applicano a
decorrere dal 28 aprile 2003 ;
viene confermata l’esclusione dall’elenco delle specialità
medicinali
“ Adalat Crono 14 cpr 30 mg ” e
“ Adalat Crono 14 cpr 60 mg ” ;
la sostituzione del farmaco avente un prezzo superiore a
quello di rimborso deve essere eseguita, in assenza
dell’indicazione della non sostituibilità ( art.7, c.2,
L.405/2001), con il medicinale generico o con la specialità
medicinale avente il prezzo più basso, nell’ambito del
principio attivo e confezione di riferimento;
in presenza dell’annotazione della “ non sostituibilità ” o
nel caso in cui non venga accettata la sostituzione
proposta dal farmacista, la differenza tra il prezzo di
rimborso ed il prezzo del farmaco prescritto è a carico
dell’assistito;
2
REGIONE SICILIANA
AZIENDA USL N° 6
DIPARTIMENTO DEL FARMACO
i
pensionati di guerra e i titolari di pensione vitalizia sono
esenti dal pagamento della quota di cui sopra.
Di seguito viene pubblicato l’elenco regionale dei
PREZZI DI RIMBORSO AL 28.04.2003 RIFERITI AL
GENERICO A PREZZO MINORE
3
REGIONE SICILIANA
AZIENDA USL N° 6
DIPARTIMENTO DEL FARMACO
MINISTERO DELLA SALUTE
DECRETO 4 aprile 2003 - G.U. n. 122 del 28.05.03
Modifiche ed integrazioni al decreto del Ministro della Sanità del 24 maggio 2001,
concernente " Approvazione del ricettario per la prescrizione dei farmaci di cui all'allegato IIIbis al DPR del 9 ottobre 1990, n. 309, introdotto dalla legge 8 febbraio 2001, n. 12 "
Prescrizione farmaci analgesi oppiacei nella terapia del dolore
M. Musacchia, M. Parelli
Con tale decreto, in vigore il 29.05.03,
è stato predisposto ( art.1 ) il nuovo
modello di ricettario in triplice copia
per la prescrizione dei farmaci
analgesici oppiacei impiegati nella
terapia del dolore e ricompresi nel
seguente allegato III bis
al DPR
309/90, introdotto
dalla Legge
12/2001:
Buprenorfina
Codeina
Diidrocodeina
Fentanyl
Idrocodone
Metadone
Morfina
Ossicodone
Ossimorfone
Idromorfone
Il decreto pubblica altresì le relative
" Norme d'uso " del nuovo ricettario
in triplice copia, stampato anche nelle
lingue francese e tedesca.
Le norme introdotte con il predetto
decreto riguardano in particolare :
Buprenorfina ( art.2 )
La prescrizione di medicinali contenenti
Buprenorfina
in tutte le forme
farmaceutiche nell'ambito della terapia
del dolore severo in corso di patologia
neoplastica o degenerativa per una cura
di durata non superiore a trenta giorni,
deve essere redatta sulla ricetta in
triplice copia, di cui al D.M. 4 aprile
2003.
Medicinali con principi
associazione ( art.3 )
attivi
in
I
medicinali
contenenti
farmaci
compresi nelle tabelle I, II e III di cui al
DPR 309/90 e compresi nell'allegato IIIbis della L. 12/2001, in associazione con
altri farmaci che sono collocati nella
tabella V di cui al DPR 309/90 , sono
prescritti con ricetta da rinnovarsi volta
per volta , salvo quando sono comprese
nella tabella n. 4 della F.U.
Quando i predetti medicinali sono usati
nella terapia del dolore , per un periodo
non superiore a trenta giorni, devono
essere
prescritti
con
ricetta
autocopiante in triplice copia, secondo
quanto previsto dalla L.12/2001.
13
REGIONE SICILIANA
AZIENDA USL N° 6
DIPARTIMENTO DEL FARMACO
Conservazione delle ricette in farmacia
( art.4 )
Il farmacista, dopo la spedizione, deve
conservare per cinque anni dall'ultima
registrazione le ricette che prescrivono
medicinali compresi nelle tabelle I,III e
IV di cui all'art.14 del DPR 309/90.
Nel caso di dispensazione a carico del SSN
il farmacista è tenuto a conservare una
copia della ricetta originale o fotocopia
della ricetta originale, recante la data di
spedizione.
In sintesi i cambiamenti apportati con
l'emanazione del nuovo decreto, come
riportato nella circolare del Ministero della
Salute
del
30.06.03
2003
n.
800.UCS/AG1/4870, sono i seguenti :
Prescrizione senza obbligo di dovere
utilizzare le " tutte lettere " per
scrivere la dose, il modo e il tempo di
somministrazione e la quantità di
confezioni. Per descrivere il medicinale
prescritto e la posologia ed il numero di
confezioni si possono utilizzare i caratteri
numerici e le normali contrazioni;
Eliminazione dell'obbligo di indicare
l'indirizzo di residenza del paziente ;
Eliminazione dell'obbligo, da parte del
prescrittore, di conservare per sei mesi
la copia della ricetta a sé destinata;
Prescrizione di medicinali contenenti
Buprenorfina in tutte le forme
farmaceutiche.
Il DM 4 aprile 2003 specifica (art.6) che i
ricettari già approvati con il precente DM
del 24 maggio 2001 e distribuiti sul
territorio nazionale possono essere
utilizzati, fino ad esaurimento delle scorte,
dai medici e veterinari, rispettando le
nuove " Norme d'uso " di seguito
integralmente
riportate
:
Norme d'uso della ricetta per la prescrizione dei farmaci di cui
all'allegato III-bis del T.U.
1. La presente ricetta deve essere utilizzata per prescrivere, a soggetti
affetti da dolore severo, solo i seguenti principi attivi :
Buprenorfina
Codeina
Diidrocodeina
Fentanyl
Idrocodone
Metadone
Morfina
Ossicodone
Ossimorfone
Idromorfone
14
REGIONE SICILIANA
AZIENDA USL N° 6
DIPARTIMENTO DEL FARMACO
2. La ricetta ha validità di trenta giorni, escluso quello di emissione.
3. Il medico o veterinario può prescrivere, con ogni ricetta, una terapia per
un periodo non superiore a trenta giorni. La posologia indicata deve
comportare che l'assunzione dei medicinali prescritti sia completata
entro trenta giorni. Fatti salvi i casi in cui è necessario adeguare la
terapia, la prescrizione non può essere ripetuta prima del
completamento della terapia indicata con la precedente prescrizione.
4. Con ogni ricetta possono essere prescritti sino a due medicinali diversi o
due dosaggi diversi dello stesso medicinale.
5. Per le prescrizioni a carico del Sevizio Sanitario Nazionale, il medico
rilascia all'assistito la ricetta originale e la copia per il SSN; per le
prescrizioni non a carico del SSN o veterinarie il medico rilascia solo la
ricetta originale.
6. Il farmacista che dispensa i medicinali forniti dal Servizio Sanitario
Nazionale, appone i bollini autoadesivi sulla copia della ricetta per il
SSN, sia nello spazio ad essi destinato, sia ( ove necessita ) sul retro
della ricetta e, in mancanza di spazio, anche su un foglio allegato alla
medesima.
7. Il farmacista che allestisce una preparazione magistrale indica il relativo
costo nello spazio destinato ai bollini autoadesivi.
8. Il veterinario riporta nello spazio destinato ai bollini autoadesivi le parole
" uso veterinario " e, nello spazio destinato al codice del paziente, indica
la specie, la razza e il sesso dell'animale curato.
9. La ricetta risulterà firmata dal medico o dal veterinario, in originale sulla
prima pagina e in copia sulle altre.
15
REGIONE SICILIANA
AZIENDA USL N° 6
DIPARTIMENTO DEL FARMACO
Manifesto sui principi etici dell'informazione sui farmaci
Ministero della Salute
Ufficio Stampa
Comunicato n. 77 del 30 aprile 2003
Manifesto sui Principi Etici dell’Informazione sui Farmaci
Con proprio comunicato stampa il Ministero della Salute rende noto che il 30 aprile è stato
siglato il “ Manifesto sui Principi Etici dell’Informazione sui Farmaci ”.
Le parti firmatarie, Ministro della Salute, Associazioni di categoria dei produttori e
distributori dei farmaci, Associazioni di categoria dei medici e dei farmacisti, hanno
concordato su otto punti che si impegnano ad applicare a tutela dei cittadini e del Servizio
Sanitario Nazionale.
Il “Manifesto” afferma che il farmaco è un valore riconosciuto da tutta la comunità
scientifica e laica, indispensabile per la salute e che la ricerca nell’ambito
farmaceutico è fondamentale per il benessere dell’umanità .
Punto nodale del “Manifesto” è subordinare l’attività di marketing delle Aziende
farmaceutiche al principio che “il farmaco è un bene etico”.
Medici e farmacisti, a loro volta, sono chiamati a svolgere un’attenta informazione sui
farmaci e ad impegnarsi attivamente nella farmacovigilanza.
I pazienti dovranno essere adeguatamente informati sugli effetti dei farmaci prescritti e sui
danni legati all’eccessivo uso dei farmaci.
Il “Manifesto” ribadisce che il medico utilizzerà i farmaci sulla base
della
documentazione e dell’evidenza scientifica ed il farmacista si impegnerà ad informare
pazienti e sanitari sugli effetti collaterali dei farmaci, sul loro corretto utilizzo ,
conservazione e smaltimento, nonché a favorire l’uso dei farmaci meno costosi, a parità di
principio attivo e senza ridurre il livello dell’assistenza.
Solidali ad intervenire nella tutela del “bene farmaco” anche i produttori di medicinali con
le loro associazioni e gli informatori scientifici del farmaco per una informazione
trasparente e scientificamente valida.
I distributori farmaceutici e le associazioni di categoria confermano, con la sigla del
“Manifesto”, il loro impegno nella “buona conservazione e distribuzione dei farmaci”,
con particolare riguardo alla tempestività ed alla qualità del servizio.
16
REGIONE SICILIANA
AZIENDA U.S.L. N. 6
DIPARTIMENTO DEL FARMACO
Differimento del termine per l'adeguamento alle Norme di
Buona Preparazione dei medicinali in farmacia
Il Ministero della Salute con decreto 23.05.03 - G.U. n. 126 del 03.06.03-,
in considerazione dei tempi tecnici che si rendono necessari per
l'adeguamento alle " Norme di Buona Preparazione dei medicinali in
farmacia", contenute nella XI edizione della F.U., ha ulteriormente
differito al 1 gennaio 2004 il termine per l'entrata in vigore delle
norme stesse.
Si fa presente inoltre che il Ministero della Salute ha recentemente
decretato - G.U. n. 139 del 18.06.03 - l'entrata in vigore in Italia dal
10.07.03 dei testi nelle lingue inglese e francese dei capitoli generali e
delle monografie pubblicati nel Supplemento 4.5 della 4* edizione della
Farmacopea europea.
A differenza della F.U. ricordiamo che tali testi non devono essere
obbligatoriamente conservati in farmacia, secondo quanto previsto
invece per la F.U. dall'art. 123, comma 1, lettera b del Testo Unico
delle Leggi sanitarie.
17
REGIONE SICILIANA
AZIENDA U.S.L. N. 6
DIPARTIMENTO DEL FARMACO
IN MATERIA DI
FARMACOVIGILANZA
Come anticipato con il precedente numero del Bollettino (n.12/2003) in
attuazione alla direttiva 2000/38/CE è stato approvato il Decreto
Legislativo 8 aprile 2003 n.95, pubblicato sulla GURI n. 101 del 3
maggio 2003, che apporta sostanziali modifiche al Decreto Legislativo 18
febbraio 1997, n. 44 in materia di Farmacovigilanza.
L'Assessorato Regionale della Sanità, con nota del 13.06.03, puntualizza
che la nuova normativa sostituisce integralmente gli articoli 2,3,4 e 11
del precedente D. Lvo e definisce le competenze ed attività :
1.
della Direzione Generale per la Valutazione dei
Medicinali e per la Farmacovigilanza del Ministero della
Salute ( art.1, punto2 );
2.
delle Regioni (art.1, punto 3 );
3.
del responsabile di farmacovigilanza delle strutture
sanitarie ( art.1 punto c ).
Le modifiche principalmente apportate dalla nuova norma
riguardano il titolare dell'autorizzazione all'immissione in
commercio e gli operatori sanitari tenuti a segnalare le reazioni
avverse, come di seguito specificamente indicato dall'Assessorato
Regionale alla Sanità.
Medici e operatori sanitari
I medici e gli altri operatori sanitari sono tenuti a segnalare tutte
le sospette reazioni gravi e inattese di cui vengono a
conoscenza nell'ambito della propria attività. Vanno comunque
segnalate tutte le sospette reazioni avverse osservate, gravi, non
gravi, attese ed inattese da tutti i vaccini e da farmaci posti sotto
monitoraggio intensivo ed inclusi in elenchi pubblicati
periodicamente dal Ministero della Salute.
18
REGIONE SICILIANA
AZIENDA U.S.L. N. 6
DIPARTIMENTO DEL FARMACO
Nelle more della pubblicazione di tali elenchi i medici e gli altri
operatori sanitari della Regione Siciliana devono
continuare a segnalare tutte le sospette reazioni avverse
osservate ivi comprese quelle attese o non gravi.
Non vanno segnalate le reazioni avverse verificatesi in
corso di sperimentazione clinica.
Le segnalazioni di sospette reazioni avverse devono essere
trasmesse, attraverso l'apposita scheda, tempestivamente, al
Responsabile di farmacovigilanza della struttura sanitaria di
appartenenza, ivi comprese quelle dei vaccini.
I medici e gli altri operatori sanitari operanti in strutture
sanitarie private devono trasmettere le segnalazioni di sospette
reazioni
avverse,
sempre
tramite
l'apposita
scheda,
tempestivamente al Responsabile di Farmacovigilanza
dell'Azienda USL n.6 , nel caso di cliniche o case di cura, tramite
la Direzione Sanitaria, anche mezzo fax al seguente numero : 091
7033019.
Regione
La Regione può avvalersi, per lo svolgimento degli adempimenti
già previsti nel D.Lvo n. 44/97 come modificato dal D.Lvo n. 95/03,
di Centri Regionali di Riferimento.
In materia l'ufficio istituzionalmente competente presso il
Dipartimento IRS si avvale già per le funzioni di centro di
raccolta, archiviazione ed elaborazione delle schede di
segnalazione, del Centro per la Segnalazione Spontanea
Organizzata presso il Policlinico Universitario di Messina cui
vanno inoltrate tutte le segnalazioni di reazioni avverse
provenienti dal territorio regionale.
I compiti del suddetto Centro Regionale e dei Centri di
Riferimento Qualificati per gli effetti tossici da farmaci in gravide
e neonati e da erbe medicinali, per gli effetti tossici da farmaci in
pazienti neoplastici e per vaccini, sono definiti in dettaglio nel
progetto regionale approvato con D.A. n. 538/02, GURS n. 42 del
06.09.02.
Responsabile di farmacovigilanza della struttura sanitaria
19
REGIONE SICILIANA
AZIENDA U.S.L. N. 6
DIPARTIMENTO DEL FARMACO
Il responsabile di farmacovigilanza della struttura sanitaria,
entro e non oltre 7 giorni solari dal ricevimento della
segnalazione, provvede, previa verifica della completezza e della
congruità dei dati contenuti nella scheda, ad inserire la stessa
nella banca dati della rete di farmacovigilanza nazionale e a
verificarne l'effettiva registrazione.
Al termine dell'operazione il suddetto Responsabile avrà cura di
apporre, sull'originale della scheda, il codice di registrazione
assegnato dal sistema e ad inoltrare copia al Ministero della
Salute, alla Regione e all'Azienda farmaceutica titolare oscurando,
per quest'ultima, i dati relativi al segnalatore.
Solo il Responsabile di Farmacovigilanza o suo delegato o
personale del Ministero della salute può richiedere eventuali
chiarimenti, integrazioni di dati relativamente alle sospette
reazioni avverse o il follow-up dei pazienti direttamente al
segnalatore.
Il Responsabile di farmacovigilanza è comunque tenuto ad
acquisire dal segnalatore una relazione clinica dettagliata, da
trasmettere entro 15 giorni solari al Ministero della Salute, per
tutti i casi di reazioni avverse da esito fatale.
E' opportuno, per l'efficacia del sistema, che il
Responsabile di Farmacovigilanza referente per ciascuna
struttura sanitaria, assicuri un accurato feed-back al
singolo segnalatore anche avvalendosi del supporto
tecnico scientifico dei Centri Qualificati di riferimento
Regionali.
Sanzioni
L'art.11 del D.Lvo n. 44/97 che prevedeva sanzioni penali ed
amministrative per i medici, i farmacisti, i sanitari, i responsabili
di farmacovigilanza e i responsabili dell'immissione in commercio
di specialità medicinali è stato sostituito dall'art.1 punto d) che ha
abolito le sanzioni penali e ha previsto sanzioni pecuniarie a carico
del responsabile dell'immissione in commercio e del suo
responsabile di farmacovigilanza.
Per i responsabili di farmacovigilanza delle strutture sanitarie è
invece prevista l'eventuale instaurazione di procedimenti
disciplinari secondo le norme legislative e convenzionali.
20
REGIONE SICILIANA
AZIENDA U.S.L. N. 6
DIPARTIMENTO DEL FARMACO
SPECIALITA’
MEDICINALI
FORMA
FARMACEUTICA
* GRANULOKINE
* NEUPOGEN
DICLOFENAC IBI
EUROCINA
30 MU 1 SIR. PRERIEMPITA DA O,5 ML
30 MU 1 SIR. PRERIEMPITA DA O,5 ML
75 MG/3 ML SOL. INIET. 6 FIALE
1200 MG 12 CPR RIVESTITE
1 SIR PRERIEM.da 172 mg POLV +
1 SIR.PRERIEM. da 1ML di SOLV da
3,75 mg
3 SIR PRERIEM.da 172 mg di POLV +
3 SIR.PRERIEM. da 1ML di SOLV da
3,75 mg
1G 8 CPR
15 MG/1,5 ML 3 FL SOL. INIET.
15 MG/1,5 ML 5 FL SOL. INIET.
1,5 MG GEL 28 BUSTINE DA 2,5 MG
15 MG/1,5 ML 3 FL SOL. INIET.
15 MG/1,5 ML 5 FL SOL. INIET.
GONAPEPTYL
DEPOT
GONAPEPTYL
DEPOT
IBIDROXIL
LEUTROL
LEUTROL
LEVELYN
MOBIC
MOBIC
NIFEDIPINA
EUDERMA
NIFEDIPINA
EUDERMA
REOEPARIN
REOEPARIN
REOEPARIN
VANEVOR
VANEVOR
CLASSE PRESCRIVIBILE
DAL
A 30
A 30
A
A
19/05/03
19/05/03
A 51
A 51
A
A
A
A
A
A
30 MG 14 CPR RIL. PROL.
A
60 MG 14 CPR RIL. PROL.
A
5.000 U.I / 0,2 ML 10 SIR PRERIEMP.
12.500 U.I / 0,5 ML 10 SIR PRERIEMP.
20.000 U.I / 0, 8ML 10 SIR PRERIEMP.
500 MG POLV. INF.END.e SOL.OR 1FL
1 G POLV.per INF.END.e SOL.OR 1 FL
A
A
H
H
H
* Con possibilità di distribuzione diretta da parte delle strutture pubbliche,previa
prescrizione su diagnosi e piano terapeutico di centri specializzati universitari o delle
aziende sanitarie individuate dalle regioni e da province autonome di Trento e Bolzano.
21
REGIONE SICILIANA
AZIENDA U.S.L. N. 6
DIPARTIMENTO DEL FARMACO
MEDICINALE
GENERICO
FORMA
FARMACEUTICA
CLASSE
PRESCRIVIBILE
DAL
TITOLARE A.I.C.:BIOINDUSTRIA LABORATORIO ITALIANO MEDICINALI S.P.A.
500 MG/100 ML INFUSIONE
METRONIDAZOLO
H
ENDOV. 25 FL 100 ML
TITOLARE A.I.C.: PLIVA PHARMA S.p.a.
CEFONICID
1G POLV.+FL SOLV 2,5ML IM
21/06/03
A 55
TITOLARE A.I.C.:ANTIBIOTICOS ERBA BIOCHIMICA S.P.A.
CEFONICID
1G POLV.+FL SOLV 2,5ML IM
A 55
500 MG POLV.+ FL SOLV
CEFONICID
A 55
2 ML IM
1G POLV.+FL SOLV 2,5ML
CEFONICID
H
EV
TITOLARE A.I.C.:EG S.p.a.
20 MG 12 CPR RIV
19/05/03
PAROXETINA
A
20 MG 28 CPR RIV
190503
PAROXETINA
A
TITOLARE A.I.C.:DOROM S.r.l.
19/05/03
300 MG 20 CPR DIVIS.
RANITIDINA
A 48
TITOLARE A.I.C: RATHIOPHARM GMBH
19/05/03
300 MG 20 CPR EFFERV.
RANITIDINA
A 48
19/05/03
300 MG 10 CPR EFFERV.
RANITIDINA
A 48
19/05/03
150 MG 20 CPR EFFERV.
RANITIDINA
A 48
TITOLARE A.I.C.:ORION CORPORATION
19/05/03
CLOZAPINA
100 MG 28 CPR
A
19/05/03
CLOZAPINA
25 MG 28 CPR
A
TITOLARE A.I.C.:GNR S.p.a.
150 MG 20 CPR RIV
A 48
19/05/03
RANITIDINA
300 MG 20 CPR RIV
A 48
19/05/03
RANITIDINA
400 MG 14 CPR RIV
A
20/05/03
NORFLOXACINA
TITOLARE A.I.C.:I.BIR.N.
150 MG 20 CPR RIV
A 48
20/05/03
RANITIDINA
300 MG 10 CPR RIV
A 48
19/05/03
RANITIDINA
22
REGIONE SICILIANA
AZIENDA U.S.L. N. 6
DIPARTIMENTO DEL FARMACO
MEDICINALE
GENERICO
FORMA
FARMACEUTICA
CLASSE
PRESCRIVIBILE
DAL
TITOLARE A.I.C.:LAB. PROD. FARMACEUTICI BONISCONTRO E GAZZONE S.r.l.
150 MG 20 CPR RIV
A 48
20/05/03
RANITIDINA
300 MG 10 CPR RIV
A 48
20/05/03
RANITIDINA
TITOLARE A.I.C.:NEW RESEARCH S.r.l.
150 MG 20 CPR RIV
A 48
RANITIDINA
300 MG 10 CPR RIV
A 48
RANITIDINA
23
REGIONE SICILIANA
AZIENDA U.S.L. N. 6
DIPARTIMENTO DEL FARMACO
SPECIALITA’
MEDICINALE
LACTOGER
PEPTAZOL
LUVION MITE
NEO LOTAN
LORTAAN
LOSAPREX
FORMA
CLASSE
FARMACEUTICA
10 G GRAN PER SOL
ORALE 20 BUSTE
SCIROPPO FL 180 ML
40 MG 14 CPR
20 CPS DA 50 MG
A 59
A 59
A 48
A
50 MG 28 CPR RIV
A
CARDIOSTART
12,5 MG 21 CPR RIV
A
CARDIOSTART
12,5 MG 7 CPR RIV
A
MODIFICA
TRASFERIMENTO TITOLARIETA’
ALLA RATHIOPHARM GMBH E
CONVERSIONE A MEDICINALE
GENERICO CON CONSEGUENTE
VARIAZIONE DELLA
DENOMINAZIONE IN LATTULOSIO
IL TRATTAMENTO CON PEPTAZOL
PUO’ OCCASIONALMENTE PROVOCARE CEFALEA,DISTURBI GASTROINTESTINALI QUALI DOLORE DELL’ADDOME SUPERIORE,DIARREA,COSTIPAZIONE O FLATULENZA, E REAZIONI
ALLERGICHE QUALI PRURITO,RASH
CUTANEO (IN CASI ISOLATI ANCHE
ORTICARIA,EDEMA ANGIONEUROTICO O REAZIONI ANAFILATTICHE,
I NCLUSO SHOCK ANAFILATTICO.
IN SOSTITUZIONE DELLA
CONFEZIONE DI LUVION MITE
VIENE AUTORIZZATA LA
CONFEZIONE :50 MG 20 CPR
ESTENSIONE INDICAZIONE
TERAPEUTICA
LE NUOVE INDICAZIONI TERAPEUTICHE ORA AUTORIZZATE SONO:
IPERTENSIONE ARTERIOSA
INDICATO IN PAZIENTI IPERTESI CON
IPERTROFIA VENTRICOLARE SINISTRA
PER RIDURRE IL RISCHIO DI MORTALITA’ E MORBILITA’ CARDIOVASCOLARE,RAPPRESENTATO PREVALENTE
MENTE DAL RISCHIO DI ICTUS.
INSUFFICIENZA CARDIACA
QUANDOIL TRATTAMENTO CON UN
ACE INIBITORE NON E’ TOLLERATO O
E’ CONTROINDICATO. NON SONO DA
TRASFERIRE AD UNA TERAPIA CON
NEOLOTAN I PAZIENTI CON
INSUFFICIENZA CARDIACA CHE SONO
STATI STABILIZZATI CON UN ACE
INIBITORE.
24
REGIONE SICILIANA
AZIENDA U.S.L. N. 6
DIPARTIMENTO DEL FARMACO
SPECIALITA’
MEDICINALE
TROZOCINA
FORMA
CLASSE
FARMACEUTICA
200 MG/5 ML
SOSP.ORALE
1 FL DA 38 ML
A
1 G POLV + FL SOLV
DA 2.5 ML USO IM
A 55
1G POLV + FL SOLV
DA 2,5 ML USO EV
H
CEFOSPORIN
ENANTONE
11,25 MG POLV + SIR.
PRERIEMPITA DA 2
ML SOLV PER
SOSP.INIETTABILE
ARTROFENAC
75MG/3 ML 5 FL
A 51
A
MODIFICA
AUMENTO POSOLOGIA:NEL
TRATTAMENTO DELLA FARINGITE
STREPTOCOCCICA DEI BAMBINI
VIENE AUMENTATA LA DOSE
DA 10 MG/KG A 20 MG/KG IN UNICA
SOMMINISTRAZIONE GIORNALIERA
PER LA DURATA DI TRE GIORNI
TRASFERIMENTO TITOLARIETA’
ALLA BENEDETTI S.P.A. E
CONVERSIONE A MEDICINALE
GENERICO CON CONSEGUENTE
VARIAZIONE DELLA
DENOMINAZIONE IN CEFONICID
AGGIUNTA DI UNA NUOVA
INDICAZIONE TERAPEUTICA
NELL’UOMO:CARCINOMA DELLA
PROSTATA E SUOI SECONDARISMI.
NELLA DONNA:ENDOMETRIOSI A
LOCALIZZAZIONE GENITALE ED
EXTRAGENITALE(STADI I- IV).
CARCINOMA DELLA MAMMELLA IN
DONNE IN PRE E PERIMENOPAUSA
OVE SIA INDICATO IL TRATTAMENTO ORMONALE. FIBROMI UTERINI
NELL’INFANZIA:PUBERTA’
PRECOCE(PRIMA DEGLI 8 ANNI
NELLA BAMBINA E PRIMA DEI 10
ANNI NEL BAMBINO).
TRASFERIMENTO TITOLARIETA’
ALLA PLIVA PHARMA S.P.A. E
CONVERSIONE A MEDICINALE
GENERICO CON CONSEGUENTE
VARIAZIONE DELLA
DENOMINAZIONE IN DICLOFENAC
25
REGIONE SICILIANA
AZIENDA U.S.L. N. 6
DIPARTIMENTO DEL FARMACO
SPECIALITA’
FORMA
CLASSE
MEDICINALE FARMACEUTICA
MOTIVO
GURI N°135 DEL 13 giugno 2003 DECRETO 24 marzo 2003
PEGASYS
CLASSIFICATA IN CLASSE A CON
NOTA 32
PRESCRIVIBILE DAL 13/06/03
PEGASYS
CLASSIFICATA IN CLASSE A CON
180 MCG SOL INIET
NOTA 32
1FL 1 ML USO SC
PRESCRIVIBILE DAL 13/06/02
PEGASYS
135 MCG SOL INIET
CLASSIFICATA IN CLASSE A CON
1SIR.PRERIEMPITA
NOTA 32
DA 0,5 ML USO SC
PRESCRIVIBILE DAL 13/06/03
PEGASYS
180 MCG SOL INIET
CLASSIFICATA IN CLASSE A CON
1 SIR. PRERIEMPITA
NOTA 32
DA 0,5 ML USO SC
PRESCRIVIBILE DAL 13/06/03
GURI N° 137 DEL 16 giugno 2003 DECRETO 24 marzo 0032
PEGINTRON
PEGINTRON
PEGINTRON
135 MCG SOL INIET
1FL 1 ML USO SC
100 MCG POLV.+
SOLV 1 FL USO SC
120 MCG POLV.+
SOLV 1 FL USO SC
150 MCG POLV.+
SOLV 1 FL USO SC
C
C
C
RICLASSIFICATA IN CLASSE A
CON NOTA 32
PRESCRIVIBILE DAL 16/06/03
RICLASSIFICATA IN CLASSE A
CON NOTA 32
PRESCRIVIBILE DAL 16/06/03
RICLASSIFICATA IN CLASSE A
CON NOTA 32
PRESCRIVIBILE DAL 13/06/03
GURI N°139 DEL 18 giugno DECRETO 24 marzo 2003
ACTIVELLE
CLIMOSTON
CLIMOSTON
FEMOSTON
FEMOSTON
FEMOSTON
28 CPR RIVESTITE
C
“L 1/10” 28 CPR RIV
C
“ 1,5 CONTI”
28 CPR RIV
“L 1/10” 28 CPR RIV
C
C
“ 1,5 CONTI”
C
28 CPR RIV
“10” 14 CPR +14 CPR C
RICLASSIFICATA IN CLASSE A
PRESCRIVIBILE DAL
RICLASSIFICATA IN CLASSE A
PRESCRIVIBILE DAL
RICLASSIFICATA IN CLASSE A
PRESCRIVIBILE DAL
RICLASSIFICATA IN CLASSE A
PRESCRIVIBILE DAL
RICLASSIFICATA IN CLASSE A
PRESCRIVIBILE DAL
RICLASSIFICATA IN CLASSE A
PRESCRIVIBILE DAL
26
REGIONE SICILIANA
AZIENDA U.S.L. N. 6
DIPARTIMENTO DEL FARMACO
SPECIALITA’
FORMA
CLASSE
MEDICINALE FARMACEUTICA
GURI N°151 DEL 02 luglio
MOTIVO
DECRETO 30 maggio 2003
300 MCG SOL.INIET.
CLASSIFICATA IN CLASSE H
1 SIR PRERIEMPITA
NESPO
DA 0,6 ML
USO SC e EV
500 MCG SOL INIET
CLASSIFICATA IN CLASSE H
1 SIR PRERIEMPITA
NESPO
DA 1 ML
USO SC e EV
100 MCG SOL INIET
CLASSIFICATA IN CLASSE A CON
1 SIR PRERIEMPITA
NOTA 12
NESPO
DA 0,5 ML
PRESCRIVIBILE DAL 02/07/03
USO SC e EV
PER LA SPECIALITA’ MEDICINALE NESPO L A COMMISSIONE EUROPEA HA DECISO
L’ESTENSIONE DELLE INDICAZIONI TERAPEUTICHE AL TRATTAMENTO
DELL’ANEMIA IN PAZIENTI ADULTI AFFETTI DA TUMORI SOLIDI(NEOPLASIE
NON EMATOLOGICHE) CHE RICEVONO CHEMIOTERAPIA.
27
REGIONE SICILIANA
AZIENDA U.S.L. N. 6
DIPARTIMENTO DEL FARMACO
SPECIALITA’
FORMA
CLASSE
MEDICINALE FARMACEUTICA
ZANIZAL
ZANIZAL
CLENIL JET
CALCIO
CHIESI
FARMACEUTICI
150 MG 20 CPS
300 MG 10 CPS
50 MCG SOL
PRESSURIZZATA
PER INALAZIONE
A 48
A 48
1G 30 CPR EFFERV
A
MOTIVO
A
28
REGIONE SICILIANA
AZIENDA U.S.L. N. 6
DIPARTIMENTO DEL FARMACO
SPECIALITA’
FORMA
CLASSE
MEDICINALE FARMACEUTICA
MOTIVO
GURI N°95 DEL 24 aprile 2003
NIMESULIDE
DOROM
100 MG 30 CPR
500 MG 8 CPS
5% 1 FL GRAN PER
CETRAZIL
SOSP ESTEMP. 100
ML
GURI N° 87 DEL 14 aprile 2003
A 66
RINUNCIA DELLA DITTA
TITOLARE A.I.C.
A
A
RINUNCIA DELLA DITTA
TITOLARE A.I.C.
GARDENALE
100 MG SOL INIET 6 FL
A
NIMEXAN
100 MG 30 CPR
A
RINUNCIA DELLA DITTA
TITOLARE A.I.C. CHE E’ STATA
AUTORIZZATA A SMALTIRE LE
SCORTE FINO AL31 /12/2003
(GURI 139 DEL 18 giugno 2003)
RINUNCIA DELLA DITTA
TITOLARE A.I.C.
Non si assumono responsabilità per eventuali inesattezze in cui si potesse casualmente incorrere
29