GRADING DEGLI EMBRIONI
Medicina e Biologia della Riproduzione CARAN srl
Dr. A. Di Filippo
Dr.ssa C. Concas
Sommario
Scopo del lavoro è quello di fornire una classificazione aggiornata, approfondita e
revisionata del grading embrionale. Partendo dalla classificazione degli ovociti proseguendo con
l’osservazione della morfologia e della fertilizzazione degli zigoti, formuliamo uno score degli
stessi, evidenziando quelli che poi verranno presi in considerazione per le caratteristiche
morfologiche e qualitative embrionali, identificati da uno score che evidenzia la migliore qualità per
i differenti parametri considerati.
Introduzione
Nella fertilizzazione in vitro (IVF), l’obiettivo è di prelevare diversi ovociti maturi per la
fecondazione poiché esiste una diretta correlazione tra il numero di embrioni nell’utero e
l’incidenza di gravidanza.
Il recupero delle cellule uovo e la loro identificazione viene fatta, in seguito al Pick-up; gli
ovociti si lavano, e si trasferiscono immediatamente nel sistema di coltura, in incubatore a C02.
Dopo 17-20 ore dall’inseminazione le cellule sono osservate al microscopio invertito, per un
accurato score della fertilizzazione.
Le uova fecondate hanno normalmente due pronuclei, due globuli polari, forma regolare,
con zona pellucida intatta ed un nitido e sano citoplasma.
Dopo il controllo della fertilizzazione gli ovociti con chiari segni di fecondazione sono
trasferiti in una nuova embriocoltura, e posti di nuovo in incubatore a C02 da 24 a 48 ore per
selezionare gli embrioni per il transfer. L’osservazione per lo sviluppo degli embrioni si attua ogni
24 ore. Al secondo giorno di divisione l’embrione può avere da 2 a 8 cellule, ed è possibile
effettuare un grading.
La normale morfologia dello sviluppo dell’embrione ha suscitato negli ultimi tempi un
notevole interesse da parte dei ricercatori operanti nei centri FIVET, in particolar modo si è cercato
di correlare le caratteristiche e gli aspetti particolari delle cellule embrionali all’osservazione
microscopica, con i tassi di gravidanza. Al contempo si è cercato di uniformare i criteri di
valutazione degli embrioni al fine di creare un grading embrionale condivisibile.
Lo standard corrente dei criteri morfologici usati nella valutazione della qualità embrionale
prima del transfer, include:
• Numero e grandezza (volume) dei blastomeri
• % di frammentazioni
• Blastomeri Multinucleati ed citoplasma
• Aspetto della zona pellucida
• Simmetria delle cellule.
Dr. A. Di Filippo – Dr.ssa C. Concas
CARAN srl - Caserta
Discussione ed osservazione
Gli ovociti recuperati a seguito del pick up vengono osservati per determinarne la qualità, la
maturità ed il tempo ottimale per l’inseminazione.
La maturità ovocitaria viene valutata in base ai seguenti parametri:
• Volume
• Densità
• Maturità nucleare
• Maturità citoplasmatica
• Struttura e disposizione delle cellule della corona radiata, del cumulo ooforo e della
granulosa.
Il criterio utilizzato per classificare gli ovociti è il seguente:
1. VESCICHETTE GERMINALI: l’ovocita è molto immaturo. Non c’è espansione delle
cellule radiali che sono strettamente compatte intorno all’uovo. All’interno del citoplasma è
evidente un grande nucleo (vescicola germinale), osservato mediante l’inverto-microscopio.
L’ovocita è allo stadio maturativo della profase della 1° divisione meiotica. Si lascia in incubazione
per 24 ore per attendere la maturità nucleare; solo dopo l’estrusione del 1° globulo polare si può
procedere all’inseminazione. Nonostante tale modalità, la percentuale di fertilizzazione è molto
bassa.
2. METAFASE I: l’ovocita è immaturo, è circondato dalle cellule della corona e da quelle
del cumulo strettamente impacchettate le une sulle altre. Non presenta più la vescichetta germinale,
ma non ha ancora estruso il 1°globulo polare; ciò sta ad indicare che l’uovo si trova in metafase I.
Deve essere pre-incubato per 12-24 ore prima dell’inseminazione.
3. METAFASE II:
a) Preovulatorio: è il livello ottimale di maturazione per un successo di fertilizzazione. Le
cellule della corona sono fissate all’uovo ma in maniera radiale; il globulo polare è estruso, le
cellule del cumulo ooforo sono espanse.
b) Molto maturo: l’uovo è chiaro come una pallida sfera, le cellule della corona radiale sono
ridotte e dissociate dall’uovo. Il cumulo è abbondante e scuro. L’ultimo stadio di questa fase
maturativa è una condensazione del cumulo in piccole gocce nere.
c) Luteinizzato: l’uovo è molto pallido ed è difficile da trovare, le cellule della granulosa e
del cumulo, sono scure ed ammassate in modo non uniforme tra loro; le cellule della corona sono
molto espanse. Si devono inseminare subito anche se hanno bassa probabilità di fertilizzazione.
d) Degenerato: le cellule della granulosa sono frammentate, hanno l’aspetto di un merletto.
L’ovocita è molto scuro e può essere difficile da identificare.
Gli ovociti fecondati sono osservati dopo 17- 20 ore.
Una varietà di differenti caratteristiche possono essere osservate; il citoplasma di uova
normalmente fertilizzate è debolmente granulare, mentre il citoplasma di uova non fertilizzate tende
ad essere completamente trasparente ed informe. Il citoplasma può variare da trasparente,
debolmente granulare a marrone, o nero o degenerato.
L’aspetto dell’uovo può anche variare da perfettamente sferico ad irregolare. Un alone
trasparente alla periferia del citoplasma spesso 5-10 mm indica una buona attivazione e inizio della
meiosi.
I dettagli della morfologia e della fertilizzazione dovrebbero essere registrati per ogni zigote
come referenza per la scelta degli embrioni per il transfer in seconda giornata.
Gli zigoti, vengono osservati individualmente per dargli un punteggio, lo score da noi usato
tiene conto di tre fattori:
• La posizione dei pronuclei
• La morfologia dei nucleoli
• L’aspetto del citoplasma
Dr. A. Di Filippo – Dr.ssa C. Concas
CARAN srl - Caserta
1. posizione pronuclei
a) opposti in centro
b) opposti non centrali
c) non opposti
d) grandezza diversa
e) split
2. morfologia nucleare
a) allineati in numero pari
b) non allineati in ugual numero
c) non allineati in disuguale numero
d) piccoli
e) miscelati
3.aspetto del citoplasma
a) area granulare definita
b) area granulare definita con vesciche
c) area granulare meno definita
d) assenza di area granulare
e) assenza di area granulare più vesciche
score
5
4
3
2
1
score
5
4
3
2
1
score
5
4
3
2
1
Gli ovociti che non mostrano segni di fecondazione, potrebbero avere ritardati uno o più
degli eventi coinvolti nella fertilizzazione.
In questi ovociti con fertilizzazione ritardata nei quali i pronuclei appaiono in seconda
giornata, gli embrioni che si formeranno tendono ad avere uno sviluppo potenziale dispari.
Questi sono messi in coltura separatamente ed usati nei caso di un basso numero di embrioni
normalmente fertilizzati.
Le caratteristiche di una incompleta o ritardata fertilizzazione sono le seguenti:
• Non fertilizzato: a) un singolo globulo polare e nessun nucleo nel citoplasma.
• Fertilizzato: a) nessun pronucleo , due globuli polari: l’ovocita è attivato, ma la visione dei
pronuclei è ritardata.
• Singolo pronucleo 2 globuli polari: l’ovocita è attivato ma l’osservazione del pronucleo
dello sperma è ritardata o soppressa.
• Singolo pronucleo 1 globulo polare: il pronucleo contiene il genoma femminile mentre è
assente il genoma maschile.
Tra gli ovociti con fertilizzazione anormale ci sono gli zigoti multinucleati; questi devono
essere messi in coltura separatamente in modo da non essere selezionati per il trasferimento, poiché
dopo la divisione cellulare non sono più distinguibili dagli ovociti a 2 PN.
Questi ovociti contengono una copia del genoma maschile e due copie del genoma
femminile (triploidi).
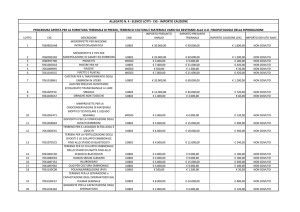
A conferma dell’importanza di quanto sopra esposto, sulla necessità di formulare un score
degli zigoti, riportiamo in tale tabella i nostri risultati comparativi, nei confronti di quegli zigoti per
i quali non è stato formulato tale score.
GRAVIDANZE cl. e % di impianto in relazione al PN score (tabella)
Dr. A. Di Filippo – Dr.ssa C. Concas
CARAN srl - Caserta
Transfer 3º giorno
Grav. cl. / ET
% impianto
Transfer 5º giorno
Grav. cl. / ET
% impianto
PN score
No PN score
57% a
31% a
32.8%
19%
72.6% a
52.3% a
57.5%
38.7%
a P < 0.01
L’embrione trasferito in 5° giornata non compromette la gravidanza, anzi si attua una
maggiore selezione poiché si eliminano quelli che mostrano un precoce arresto della divisione in
vitro.
Gli embrioni con divisione veloce hanno il più alto numero di cellule al momento del
transfer, si pensa abbiano maggior probabilità d’ impianto.
La maggior parte degli embrioni presentano frammentazioni, e non è chiaro se queste
frammentazioni sono effetto delle condizioni di coltura, della stimolazione follicolare o è una
caratteristica dello sviluppo umano.
In 15 anni di embriologia clinica non ci sono lavori sulle cause delle frammentazione. Il
grado di frammentazione varia da 5-10% al 100% è possono essere sia localizzate che sparse. Dal
3° giorno sono osservati 5 distinti campioni di frammentazioni:
1. <5% del volume dello spazio perivitellino è occupato dai frammenti.
2. Tutti o la maggior parte dei frammenti localizzati perifericalmente allo spazio
perivitellino (con 5 o più cellule normali visibili)
3. Piccoli frammenti sparsi tra le cellule o in tutto lo spazio perivitellino di dimensioni
simili.
4. Grandi frammenti indistinguibili dai blastomeri e sparsi dappertutto nello spazio
perivitellino (PVS) di solito associato con poche cellule di differente misura.
5. Frammenti sparsi dappertutto nello spazio PVS, appaiono degenerati.
Il potenziale di impianto è maggiore nei tipi 1 e 2 e diminuisce nei tipi 3 e 4.
FRAMMENTAZIONE % di gravidanza e di impianto in relazione alla presenza ed al tipo di
frammenti (tabella).
Range di framm. %
0-5
6-15
16-25
26-35
> 35
Tipo di framm. %
TI
T II
T III
T IV
N di embrioni
1062
533
64
41
27
Grav. Clin. %
63
57.8
51.6
46.3
14.8
Impl. Rate %
31.8
28.2
23.4
23.4
6.4
63
62
335
104
65.1
67.7
59.4
40.4*
37.9
33.8
30.5
18.2**
*,** P<0.001
Dr. A. Di Filippo – Dr.ssa C. Concas
CARAN srl - Caserta
Gli embrioni vengono osservati all’inverto- microscopio per selezionare i migliori per
transfer. Comunemente vengono classificati attribuendo il grado più alto al gruppo di embrioni
trasferiti che hanno dato luogo al concepimento, secondo questi criteri:
GRADO 1 :Gli embrioni hanno sempre blastomeri regolari, circolari di uguale grandezza,
simmetrici, con zona pellucida intatta, ed hanno pochissime frammentazioni meno del 10%. Tutti
blastomeri hanno un nucleo.
GRADO 2 :Copre una grossa parte di stadi morfologici. Hanno blastomeri di grandezza
simile,ma con una differenza non superiore al 20% tra l’uno e l’altro. Divisione asimmetrica con
blastomeri di ugual misura , frammentazioni<10% ; <25% blastomeri multinucleati.
GRADO 3:Divisione simmetrica, diversa misura dei blastomeri, frammentazione non
superiore al 50%; i restanti blastomeri devono essere almeno in condizioni ragionevoli come quelli
del grado 2. La zona pellucida è intatta < 50 % blastomeri multinucleati.
GRADO 4: Divisione asimmetrica, blastomeri di diversa misura, frammentazione> 50%
>75% blastomeri multinucleati.
GRADO 5:Nessuna divisione, > 50% di frammentazione, tutti i blastomeri multinucleati.
Nel nostro centro usiamo un sistema di score; per determinare i parametri che influiscono
sullo sviluppo potenziale degli embrioni; che sono:
•
Volume dei blastomeri
•
Multinucleazione
•
Livelli di frammentazione
1) Volume dei blastomeri
a) divisione simultanea simmetrica, egual misura
b) divisione simultanea, egual misura
c) divisione simultanea, diverse misure
d) divisione non simultanea, diverse misure
e) non diviso
score
5
4
3
2
1
2) Multinucleazione
a) un nucleo in ogni blastomero
b) < 25% blastomeri multinucleati
c) < 50% blastomeri multinucleati
d) <75% blastomeri multinucleati
e) tutti i blastomeri multinucleati
I
3) Livelli di frammentazione
a) nessun frammento
b) < 10% frammentazioni
c) < 25% frammentazioni
d) <40% frammentazioni
e) > 40% frammentazioni
score
5
4
3
2
1
score
5
4
3
2
1
Per descrivere la morfologia degli embrioni usiamo una formula riassuntiva aggiornata
seguendo la letteratura mondiale. Sembra difficile ma in realtà una volta assimilata è molto veloce
ed immediata. Offre il grande vantaggio di descrivere con una semplice formula tutte le
caratteristiche embrionali. Si divide in due parti: descrizione morfologica dell’embrione, e analisi
qualitativa.
Analisi morfologica:
N (X,Y)Z
N: rappresenta il numero di blastomeri
Dr. A. Di Filippo – Dr.ssa C. Concas
CARAN srl - Caserta
X: rappresenta la dimensione dei blastomeri
1. blastomeri di ugual dimensione
2. se i blastomeri sono asimmetrici
Y: rappresenta la percentuale di frammentazioni enucleate
1: 0-10%
2: 10-30%
3: 30-50%
4: >50%
Z: rappresenta la qualità del citoplasma
A. buona qualità del citoplasma
B. scarsa qualità citoplasmatica (granulosa e/o vacuoli)
Nn: numero di cellule che presentano un singolo nucleo visibile
MN: indica la presenza di almeno un blastomero multinucleato
X: numero di nuclei presenti nel blastomero
Y: 0 se i nuclei presenti sono di ugual dimensione
1 se i nuclei presenti sono di diversa dimensione
Classificazione qualitativa degli embrioni
1. velocità di crescita
Score 0
+2
+3
2. dimensione blastomeri
Score 0
+1
3. frammentazioni
Score 0
+1
+2
+3
4. qualità citoplasmatica
Score 0
+1
5. status nucleare
Score 0
+1
Day 2 (44-48h)
4 cellule
2-3 cellule
< 2 cellule
Day 3 (66-70 h)
6 cellule
4-5 cellule
< 4 cellule
uguali
Moderatamente disuguali
disuguali
0-10%
10-30%
30-50%
>50%
Citoplasma A
Citoplasma lievemente B
Citoplasma B
Nessun blastomero multinucleato
Blastomeri multinucleati
La somma ditali score ci permette di classificare gli embrioni:
Embrione tipo A
ottima qualità
score 0-1
Embrione tipo B
buona qualità
score 2-3
Embrione tipo C
scarsa qualità
score 4-5
Embrione tipo D
pessima qualità
score >5
Gravidanze cl e % d’impianto in relazione allo score embrionale:
Gravidanze ciclo
% d’impianto
61%
32%
Emb. Tipo A
36%
18%
Dr. A. Di Filippo – Dr.ssa C. Concas
Emb. Tipo B
17%
10%
Emb. Tipo C
5%
3%
Emb. Tipo D
3%
1%
CARAN srl - Caserta
Conclusione
La classificazione da noi usata, permette di determinare un esatto grading dell’embrione,
perché tiene conto di tutti gli aspetti morfologici e qualitativi, e di predirne la potenzialità di
sviluppo in vitro e quindi in vivo di quel determinato embrione.
Bibliografia
Alikani, M. & Cohen, J. (1995) Patterns of cell fragmentation in the human embryo in vitro.
Journal of Assisted Reproduction and Genetics 12, Suppl.:28s.
Gregory, L.& Leese, H.J. (1996)Determinants of oocyte and pre-implantation embryo quality
metabolic requirements and the potential role of cumulus cells. Journal of the British Fertility
Society 1(2), Human Reproduction 11, Natl Suppl.: 96-102.
Homburg, R.& Shelef, M.(1995)Factor affecting oocyte quality. In: (Grudzinskao, J.G. &Yorich,
J.L., eds.), Gamets: the Oocyte.Cambrige University Press, pp. 227-91.
Marrs, R.P., Saito, H., Yee, B., Sato, F. And Brown, J. (1984) Effect of variation of in vitro culture
techniques upon oocyte fertilization and embryo development in human in vitro fertilization
procedures. Fertility and sterility 41:519-23.
Munné, S., Alikani, M. Tomkin, G., Grifo, J. & Cohen, J. (1995) Embryo morphology,
developmental rates, and material age are correlated with chomosomal abnormalities. Fertility and
sterility 64:382-91.
Plachot, M. & Mandelbaum, J. (1990) Oocyte maturation, fertilization and embryonic growth in
vitro. British Medical Bulletin 46: 675-94.
Salha, O., Nugent, D., Dada, T., Kaufmann, S., Levett, S., Jenner, L., Lui, S. & sharman, V. (1998)
The relationship between follicular fluid aspirate volume and oocyte maturity in vitro fertilization
cycles, Human Reproduction l3(7): 190 1-6.
Dr. A. Di Filippo – Dr.ssa C. Concas
CARAN srl - Caserta