Prof. Giorgio Sartor
Metabolismo dell’azoto
Copyright © 2001-2012 by Giorgio Sartor.
Versione 1.4.2 – may 2012
All rights reserved.
PROTEINE
POLISACCARIDI
ADP + Pi
ADP + Pi
LIPIDI
ATP
ATP
ATP
Aminoacidi
I
FASE IDROLITICA
ADP + Pi
Esosi; Pentosi
Ac. Grassi; Glicerolo
ADP + Pi
ADP + Pi
ADP + Pi
ATP
α-chetoacidi
ADP + Pi
ATP
ATP
ATP
Piruvato
II
FASE OSSIDATIVA
AcetilCoA
Metabolismo
dei glucidi
III
O2
ADP + Pi
ATP
NH3
v. 1.4.2 © gsartor 2001-2012
H2O
Metabolismo dell'azoto
CO2
-2-
1
PROTEINE
POLISACCARIDI
ADP + Pi
ADP + Pi
LIPIDI
ATP
ATP
ATP
Aminoacidi
I
FASE IDROLITICA
ADP + Pi
Esosi; Pentosi
Ac. Grassi; Glicerolo
ADP + Pi
ADP + Pi
ADP + Pi
ATP
ADP + Pi
ATP
ATP
ATP
α-chetoacidi
Piruvato
II
FASE OSSIDATIVA
AcetilCoA
Metabolismo
dei grassi
III
O2
ADP + Pi
ATP
NH3
H2O
v. 1.4.2 © gsartor 2001-2012
CO2
Metabolismo dell'azoto
PROTEINE
POLISACCARIDI
ADP + Pi
ADP + Pi
LIPIDI
I
FASE IDROLITICA
ADP + Pi
ATP
ATP
ATP
Aminoacidi
-3-
Esosi; Pentosi
Ac. Grassi; Glicerolo
ADP + Pi
ADP + Pi
ADP + Pi
ATP
α-chetoacidi
ADP + Pi
ATP
ATP
ATP
Piruvato
II
FASE OSSIDATIVA
AcetilCoA
Metabolismo
dell’azoto
III
O2
ADP + Pi
ATP
NH3
v. 1.4.2 © gsartor 2001-2012
H2O
Metabolismo dell'azoto
CO2
-4-
2
Metabolismo dell’azoto
Aminoacidi
Animali
superiori
Piante
superiori
Batteri fissatori
dell’azoto
Nitrati
NH3, Urea
Batteri
N2 atmosferico
Batteri
nitrificanti
Nitriti
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
-5-
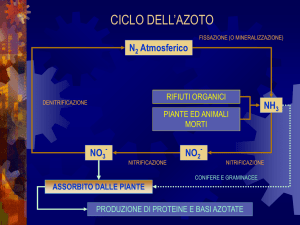
Ciclo dell’azoto
AEROBIOSI
Assimilazione del nitrato
NO2NITRIFICAZIONE
(Batteri nitrificanti)
NO3FISSAZIONE
DELL'AZOTO
(Procarioti)
NO2-
NH4+
Azoto
organico
DENITRIFICAZIONE
(Batteri)
NO
ANAEROBIOSI
N2O
N2
Respirazione del nitrato
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
-6-
3
Metabolismo dell’azoto
• L’azoto è presente nei composti organici in
forma ridotta.
NH4+
• Nell’ambiente l’azoto è presente in forma
ossidata
N2
v. 1.4.2 © gsartor 2001-2012
NO3-
Metabolismo dell'azoto
-7-
Metabolismo dell’azoto
• Le specie ossidate vengono convertite
nella specie ridotta da due diversi
processi:
– Assimilazione del nitrato (avviene negli
eucarioti fototrofi, piante verdi)
NO3- → NH4+
– Fissazione dell’azoto (avviene nei procarioti
sia autonomi che simbionti di eucarioti)
N2 → NH4+
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
-8-
4
Assimilazione del nitrato
• Nelle piante verdi (eucarioti) l’assimilazione
del nitrato avviene in due successivi passaggi:
O
O
N
O
N
+ 2H+ + 2eO
Nitrato reduttasi
Respiratoria - EC 1.7.99.4
NADH - EC 1.7.1.1
NAD(P)H - EC 1.7.1.2
NADPH - EC 1.7.1.3
Ferredossina - EC 1.7.7.2
Cyt - EC 1.9.6.1
O
H
+
H N H
H
+ 8H+ + 6eO
O
N
+ H2O
+ 2H2O
Nitrito reduttasi
NAD(P)H - EC 1.7.1.4
Ferredossina - EC 1.7.7.1
Cyt c- EC 1.7.2.2
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
-9-
Nitrato reduttasi
• La nitrato reduttasi citosolica trasferisce due
elettroni dal NADH al nitrato.
• Contiene come cofattori:
O
– FAD
H
H
N
– Cofattore molibdeno
– Citocromo b577
N
H2N
S
O
Mo
O
S
N
N
H
O
O
N
O
N
+ 2H+ + 2eO
2NADH
v. 1.4.2 © gsartor 2001-2012
O
+ H2O
2NAD+
Metabolismo dell'azoto
- 10 -
5
Nitrato reduttasi
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 11 -
Nitrato reduttasi
Cofattore molibdeno
Dominio catalitico
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 12 -
6
Nitrato reduttasi
• La nitrato reduttasi citosolica trasferisce due
elettroni dal NADH al nitrato.
• La catena di trasferimento elettronico:
CH3
S
NADH
FADH2
S
2Cyt b577
(Fe+++)
Mo4+
O
O
N
O
CH3
H
NAD+
2
FAD
S
2Cyt b577
(Fe++)
Mo6+
CH3
v. 1.4.2 © gsartor 2001-2012
O
N
O
Metabolismo dell'azoto
- 13 -
Nitrito reduttasi
O
N
H
+
+ 2H2O
H N H
H
+ 8H+ + 6eO
v. 1.4.2 © gsartor 2001-2012
Nitrito reduttasi
NAD(P)H - EC 1.7.1.4
Ferredossina - EC 1.7.7.1
Cyt c- EC 1.7.2.2
Metabolismo dell'azoto
- 14 -
7
Nitrito reduttasi EC 1.7.1.4
O
• La nitrito reduttasi
presente nei cloroplasti
agisce attraverso la
ferredossina ridotta
dalla fotosintesi,
• Il trasferimento di
elettroni coinvolge un
gruppo siroeme nel
quale il ferro complessa
lo ione nitrito che viene
ridotto a ione
ammonio.
O
O
NO2-
O
O
O
H3C
H3C
O
O
N
N
Fe
N
N
O
O
O
O
O
O
O
NO2-
O
N
hυ
N
Fe
N
N
Ferredossina
(Fe+++)
Ferredossina
(Fe++)
Fe4S4
(Fe++)
Fe4S4
(Fe+++)
NH4+
N
N
Fe
N
v. 1.4.2 © gsartor 2001-2012
N
Metabolismo dell'azoto
- 15 -
Fissazione dell’azoto
• Avviene nei procarioti che possono
essere sia simbionti di piante superiori
che avere vita autonoma
• Requisiti essenziali per la fissazione
dell’azoto:
– Un riducente
• ferredossina, EC 1.18.6.1
• flavodossina, EC 1.19.6.1
– ATP
– Anaerobiosi
– Meccanismi di regolazione
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 16 -
8
Il complesso enzimatico della nitrogenasi
• Il complesso enzimatico della nitrogenasi è
composta di due proteine entrambe richieste
per l’attività:
– La nitrogenasi reduttasi e
– La nitrogenasi
• La nitrogenasi reduttasi è una proteina 4Fe-4S
che, legando due molecole di ATP e una
ferredossina, genera un elettrone che viene
trasferito alla nitrogenasi.
• La nitrogenasi, catalizza la reazione:
N2 → 2NH4+
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 17 -
Il complesso enzimatico della nitrogenasi
• La nitrogenasi riduce l’azoto a ione ammonio attraverso
tre riduzioni successive nella quale utilizza due elettroni
per volta.
• La riduzione avviene come:
N2 + 2e- + 2H+ → NH=NH + 2e- + 2H+ →
→ NH2-NH2 + 2e- + 2H+ → 2NH4+ + H2
• La riduzione porta alla formazione di H2.
• Lo stesso enzima porta alla produzione di etilene (e
etano) da acetilene, di azoto e ammonio da azide e
metano e ammonio dal cianuro. In assenza di un
substrato disponibile si ha la lenta produzione di H2.
• La ferredossina può essere rimpiazzata dalla flavodossina
(EC 1.19.6.1).
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 18 -
9
Il complesso enzimatico della nitrogenasi
• Richiede la presenza di Mg++
• Richiede ATP nonostante che la reazione:
N2 + 8e- + 10H+ → 2NH4++ H2
• sia termodinamicamente favorita, (∆G << 0), è
invece elevata l’energia di attivazione (∆G* > 0)
• Il sistema è fortemente inibito dall’O2, ma
richiede ATP, formato da O2,
• gli organismi simbionti che usano la nitrogenasi
operano al limite tra il poco ossigeno per evitare
l’inibizione e l’ossigeno necessario a formare
ATP, sfruttando l’emoglobina dell’ospite.
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 19 -
Il complesso enzimatico della nitrogenasi
• Nitrogenasi reduttasi: un enzima che opera in
anaerobiosi (sensibile all O2), peso molecolare 60KD,
contiene un centro Fe4S4.
hυ
v. 1.4.2 © gsartor 2001-2012
NADH
piruvato
Ferredossina
(Fe+++)
Nitrogenasi
reduttasi
(Fe++)
Ferredossina
(Fe++)
Nitrogenasi
reduttasi
(Fe+++)
Metabolismo dell'azoto
e-
- 20 -
10
Il complesso enzimatico della nitrogenasi
• Nitrogenasi EC 1.18.6.1 : un enzima Fe Mo
H
2H+ + 2e-
H
OH
O
O
H
O
Fe
H H
O
S
Fe
O
H
S
O
Mo
Fe
N N
S
S
S
Fe
Fe
S
Fe
S
H
S
Fe
N N
H
2e-
2H+
H
H
4e-
H
2H+
N N
H
v. 1.4.2 © gsartor 2001-2012
H
2 H N
H
2H+
H +
2 H N H + H2
H
Metabolismo dell'azoto
Nitrogenasi
- 21 -
Fe++
His
Mo++
Fe++
Cys
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 22 -
11
Regolazione della nitrogenasi
• I geni per la nitrogenasi e la nitrogenasi
reduttasi fanno parte di un complesso
genico chiamato regulone nif.
• Il regulone nif comprende:
– i geni strutturali per il complesso della
nitrogenasi,
– i geni per il complesso FeMo,
– i geni che controllano le proteine implicate
nel trasporto di elettroni,
– diversi geni regolatori.
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 23 -
Regolazione della nitrogenasi
• La nitrogenasi è sottoposta a una
regolazione molto rigorosa.
– La fissazione dell'azoto è inibita da 02
– dalla presenza di azoto combinato, NH3, N03
e alcuni aminoacidi.
• La regolazione avviene soprattutto a
livello della trascrizione:
– La trascrizione dei geni nif strutturali è
• attivata dalla proteina NifA (regolazione positiva)
e
• repressa dalla proteina NifL, (regolazione
negativa)
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 24 -
12
Regolazione della nitrogenasi
• Il sistema della nitrogenasi è regolato sia a livello
dell’attività enzimatica (feedback negativo da prodotto)
che a livello dell’espressione genica della nitrogenasi:
Espressione di
nif
Nitrogenasi
N2 + 10H+ + 8e-
16 ATP
v. 1.4.2 © gsartor 2001-2012
2NH4+ + H2
16 Pi + 16 ADP
Metabolismo dell'azoto
- 25 -
Nitrogenasi reduttasi
• Il sistema della nitrogenasi è regolato anche a livello
della reduttasi attraverso la formazione di un derivato
ADP-ribosilato:
Nicotinamide
Nitrogenasi
reduttasi
ATTIVA
NH2
N
NAD+
NAD+-dinitrogenoreduttasi ADP-D-ribosil
transferasi
EC 2.4.2.37
*
H
N
*
Nitrogenasi
reduttasi
INATTIVA
O
O
*
H
N
*
O
Arg101
Arg101
NH
NH
ADP-ribosil-[dinitrogeno
reduttasi] idrolasi
EC 3.2.2.24
HN
NH2
N
N
H2 N
N
N
O
HO
OH
NH
H2O
O
Gruppo
ADP-ribosile
N
N
OH
OH
N
N
OH
H2N
ADP-ribosio
v. 1.4.2 © gsartor 2001-2012
HN
Metabolismo dell'azoto
- 26 -
13
AMMONIO
NH3 + H+ → NH4+
Destino di NH4+
NH4+
Carbamilfosfato
sintasi I
EC 6.3.4.16
2ATP + HCO3-
O
2ADP + Pi + 2H+
O
O
H2 N
O
O
O
P
O
O
Glutamato
deidrogenasi
EC 1.4.1.2
EC 1.4.1.3
EC 1.4.1.4
(GDH)
O
O
α-chetoglutarato
NADH
NAD(P)H
NADPH
NAD+
NAD(P)+
NADP+
H2O
Carbamilfosfato
O
O
O
Glutamina
sintasi
EC 6.3.1.2
(GS)
ATP
O
NH3+
ADP + Pi
Glutamato
O
2
HN
O
O
NH3+
Glutamina
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 28 -
14
Tre enzimi
NH4+
Carbamilfosfato
sintasi I
EC 6.3.4.16
1
2ATP + HCO3O
2ADP + Pi + 2H+
O
O
H2 N
O
O
Glutamato
deidrogenasi
EC 1.4.1.2
EC 1.4.1.3
EC 1.4.1.4
(GDH)
O
P
O
O
O
O
α-chetoglutarato
2
NADH
NAD(P)H
NADPH
NAD+
NAD(P)+
NADP+
H2O
Carbamilfosfato
O
Glutamina
sintasi
EC 6.3.1.2
(GS)
O
O
3
ATP
O
NH3+
ADP + Pi
Glutamato
O
2
HN
O
O
NH3+
Glutamina
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 29 -
Carbamilfosfato sintasi I (EC 6.3.4.16)
NH4+
Carbamilfosfato
sintasi I
EC 6.3.4.16
2ATP + HCO3-
O
2ADP + Pi + 2H+
O
O
O
O
• Catalizza
una delle
tappe del ciclo dell’urea
Glutamato
H2N
O
O
O
P
O
O
α-chetoglutarato
deidrogenasi
EC 1.4.1.2
EC 1.4.1.3
EC 1.4.1.4
(GDH)
– Una molecola
NADH di ATP attiva il bicarbonato
NAD(P)H
– Una molecola
NADPH di ATP fosforila il carbammato
NAD+
NAD(P)+
NADP+
H2 O
Carbamilfosfato
O
O
H2N
Glutamina
sintasi
EC 6.3.1.2
(GS)
O
O
ATP
O
O
• N-acetiglutamato
è un attivatore allosterico
NH +
essenziale
O
O
ADP + Pi
Glutamato
3
O
2HN
O
O
NH3+
Glutamina
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
O
O
H
O
CH3
- 30 -
15
Carbamilfosfato sintasi I (EC 6.3.4.16)
ADP
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 31 -
Glutamato deidrogenasi (GDH) (EC 1.4.1.X)
NH4+
Carbamilfosfato
sintasi I
EC 6.3.4.16
• È un esamero
2ATP + HCO3-
• Tre diversi enzimi
2ADP + Pi + 2H
che usano NADH o
NADPH o uno dei
Glutamato
deidrogenasi
due.
EC 1.4.1.2
O
+
H 2N
• EC 1.4.1.2
→ NADH
O
• EC 1.4.1.3O→
O
P
O
NAD(P)H
O
• EC 1.4.1.4
→ NADPH
Carbamilfosfato
EC 1.4.1.3
EC 1.4.1.4
(GDH)
O
O
α-chetoglutarato
NAD+
NAD(P)+
NADP+
O
O
Ciclo di
Krebs
Acetil-CoA
NADH
NAD(P)H
NADPH
H 2O
• Può operare sia nella
via biosintetica che
degradativa.
O
O
O
Glutamina
sintasi
EC 6.3.1.2
(GS)
ATP
O
NH3+
ADP + Pi
Glutamato
NADPH
α-chetoglutarato
NADP+
Glutamato
O
•
O
Nel secondo caso
O
HN è attivata
NH +
allostericamente da ADP
e inibita da
Glutamina
GTP.
2
3
NADH
GTP
v. 1.4.2 © gsartor 2001-2012
NAD+
ADP
Metabolismo dell'azoto
- 32 -
16
Glutamato deidrogenasi (GDH) (EC 1.4.1.X)
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 33 -
Destino di NH4+
NH4+
Carbamilfosfato
sintasi I
EC 6.3.4.16
2ATP + HCO3-
O
2ADP + Pi + 2H+
O
O
H2 N
O
O
O
P
O
O
Glutamato
deidrogenasi
EC 1.4.1.2
EC 1.4.1.3
EC 1.4.1.4
(GDH)
O
O
α-chetoglutarato
NADH
NAD(P)H
NADPH
NAD+
NAD(P)+
NADP+
H2O
Carbamilfosfato
O
O
O
Glutamina
sintasi
EC 6.3.1.2
(GS)
ATP
O
NH3+
ADP + Pi
Glutamato
O
2
HN
O
O
NH3+
Glutamina
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 34 -
17
Glutamina sintasi (GS) (EC 6.3.1.2)
• Dodecamero
• Meccanismo:
H
H
N
H
+
H
H
H
N
H
O
O
O
H
NH3+
O
ATP
ADP
O
H
O
NH2
H
NH3+
O
O
O
Glutamato
v. 1.4.2 © gsartor 2001-2012
Pi
O
NH3+
O
O
O
P
O
Glutamina
Metabolismo dell'azoto
- 35 -
Glutamina sintasi (GS) (EC 6.3.1.2)
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 36 -
18
Correlazione e competizione tra GDH e GS
NH4+
Carbamilfosfato
sintasi I
• La Km per lo ione
EC 6.3.4.16
ammonio è diversa:
Km (GDH) > Km (GS)
2ATP + HCO3-
GDH
O
2ADP + Pi + 2H+
• la conseguenza è che
ci si trova in carenza
di glutamato che
H N
viene consumato
O più
O
P
O
in fretta diO quanto
la
O
GDH riesca
a
Carbamilfosfato
produrlo.
2
O
O
O
O
α-chetoglutarato
Glutamato
deidrogenasi
EC 1.4.1.2
EC 1.4.1.3
EC 1.4.1.4
(GDH)
NAD+
NAD(P)+
NADP+
H2O
O
• Vi è un sistema di
ripristino del
glutamato a spese
dell’α-chetoglutarato
e della glutamina.
O
GS
NADH
NAD(P)H
NADPH
Glutamina
sintasi
EC 6.3.1.2
(GS)
O
ATP
O
NH3+
ADP + Pi
Glutamato
O
2HN
O
O
NH3+
Glutamina
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
• L’enzima coinvolto è
la Glutamato
Ossoglutarato
Amino Trasnsferasi
Carbamilfosfato
sintasi I
(GOGAT).
EC 6.3.4.16
• Gli equivalanti
riducenti sono
diversi:
GOGAT
NH4+
2ATP + HCO3O
2ADP + Pi + 2H+
O
O
O
O
α-chetoglutarato
NADH
NAD(P)H
Ferredossina
ridotta
• NADH nel lievito
• NADPH
H2N nei batteri
O
- 37 -
O
P
• Ferredossina
O
O
ridotta nelleO
Carbamilfosfato
piante.
Riducente
ossidato
O
Glutamato Ossoglutarato
Amino Transferasi
EC 1.4.7.1
(GOGAT)
2
O
O
Glutamina
sintasi
EC 6.3.1.2
(GS)
ATP
O
NH3+
ADP + Pi
Glutamato
O
HN
2
O
O
NH3+
Glutamina
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 38 -
19
GOGAT
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 39 -
Regolazione allosterica della GS
• La glutamina è un componente centrale nella
biosintesi degli aminoacidi e dei nucleotidi,
• La sua sintesi è estremamente regolata:
– In modo allosterico, da prodotti che provengono
dalla glutamina,
– In modo covalente,
– Attraverso la regolazione genica.
• L’inibizione allosterica, da prodotti, è
cumulativa,
– mediamente ogni inibitore presente a concentrazione
saturante satura l’11% dell’attività.
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 40 -
20
Regolazione allosterica della GS
O
H
H
Glicina
Glutamato
O
O
O
NH3+
O
H3 C
Alanina
Carbamilfosfato
O
O
O
NH2
O
P
NH3+
O
O
O
NH2
O
Serina
AMP
P
O
O
HO
O
O
N
O
NH2
N
O
NH2
N
N
HO
OH
O
Istidina
O
N
O
ATP + NH4+
O
CTP
O
P
O
H
Triptofano
O
P
NH2
N
P
O
O
O
O
N
N
O
O
HO
Nh2
P
O
O
H
O
O
O
O
HO
2HN
Glutamina
v. 1.4.2 © gsartor 2001-2012
OH
O
ADP + Pi
O
N
NH2
O
O
O
NH3+
OH
HO
NH2
Glucosamina-6-fosfato
Metabolismo dell'azoto
- 41 -
Regolazione covalente della GS
• Ognuna delle dodici subunità della glutamina sintasi può
essere adenilata in Tyr397
• La GS adenilata è più sensibile all’inibizione cumulativa e al
feeback.
• È un meccanismo finemente regolato, non on-off.
*
*
O
Tyr397
O
P
N
O O
O
O
H
12
12 ATP
N
NH2
N
N
12 PPi
OH
OH
12
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 42 -
21
Regolazione covalente della GS
• Nella regolazione covalente
sono coinvolti due enzimi:
– Il complesso adenililtransferasi,
un tetramero di 11kD che
viene regolato covalentemente
attraverso il legame con il
gruppo uridile:
α -KG Gln
Adenilil
transferasi:PIIA
Gln
Uridil
transferasi
GS ATTIVA
Tyr397 deadenilata
GS meno ATTIVA
Tyr397-O-AMP
α-KG Gln
4 PPi
• Lo stato di PII controlla la
direzione in cui
l’adenilitransferasi agisce.
Adenilil
transferasi:uridil-PIID
4 H2O
12 Pi
12 ADP
• L’adenililtransferasi (nelle due
forme) e l’uridiltransferasi sono
regolate in modo allosterico da
α-chetoglutarato e glutamina.
v. 1.4.2 © gsartor 2001-2012
4 UMP
4 UTP
PIIA → Uridil-PIID
– L’uridiltransferasi che catalizza
la formazione di Uridil-PIID
12 PPi
12 ATP
Gln α-KG
Metabolismo dell'azoto
- 43 -
Regolazione genica della GS
• Il gene che codifica per GS (GlnA) è attivato solo se uno
specifico attivatore della trascrizione NRI è fosforilato
(NRI-PO3--)
NRI
ATP
NRII
ADP
Pi
NRII-PIIA
NRI-PO3--
GluA
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
H 2O
Glutamina
sintasi
- 44 -
22
Biosintesi degli aminoacidi
• Non tutti gli organismi viventi riescono a
sintetizzare gli aminoacidi a partire dallo ione
NH4+:
• Piante, batteri e lieviti:
NO3- → NH4+ → glutamato → Aminoacidi
• Nei mammiferi:
• Aminoacidi essenziali:
– Arg, His, Ile, Leu, Lys, Met, Phe, Thr, Trp, Val.
• Aminoacidi non essenziali:
– Ala, Asp, Asn, Cys, Glu, Gln, Gly, Pro, Ser, Tyr.
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 45 -
Biosintesi degli aminoacidi
• Gli aminoacidi vengono, nella maggior parte dei
casi, sintetizzati a partire dall’α-chetoacido
corrispondente attraverso una specifica
aminotransferasi (transaminasi):
AA1 + α-chetoacido2 → α-chetoacido1 + AA2
• Le transaminasi trasferiscono un gruppo aminico
da un AA ad un α-chetoacido
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 46 -
23
Transaminazione
• Le reazione di transaminazione usano come coenzima il
piridossal fosfato.
• Il piridossal fosfato forma una base di Shiff con un
residuo di Lys della transaminasi
O
H
OH
O
OH
HO
O
+
N
NH3+
O
OH
P
O
O
+
N
CH3
+
N
CH3
H
H
Piridossina
(Vit B6)
Piridossal fosfato
(PLP)
v. 1.4.2 © gsartor 2001-2012
OH
P
O
O
O
CH3
H
Piridossamina fosfato
(PMP)
Metabolismo dell'azoto
- 47 -
Meccanismo della transaminazione
H
(CH2)4
O
O
N
H
R
NH3+
O
(CH2)4
Aminoacido
O
OH
P
O
O
+
N
RH
CH3
NH3+
+
O
O
R
N
+
O
O
H
N
O
OH
P
O
O
O
H
N
H
O
H
Base di Shiff con
l'enzima
(CH2)4
NH3+
O
Base di Shiff con
l'aminoacido
OH
P
O
O
N
CH3
CH3
H
H
H
+
(CH2)4
(CH2)4
NH3+
NH3+
O
H
H
O
O
OH
P
O
O
+
N
H
O
O
CH3
H
H
O
OH
P
O
O
N
O
R
Metabolismo dell'azoto
O
N
+
α-chetoacido
v. 1.4.2 © gsartor 2001-2012
R
H2O
NH3+
CH3
H
O
- 48 -
24
Meccanismo della transaminazione
R' H
O
O
O
N
H
R'
H
R'
NH 3+
Aminoacido1
O
O
H
O
N
N
+
H
Aldimina
N
(CH2 )4
H
N
H
O
R'
N
N
+
H
H
R''
NH3 +
O
H
H
PLP-enzima
Chetimina
N
O
+
H
O
Aminoacido2
α-chetoacido
O
O
R'' H
O
R'
H
H
N
H
O
O
NH3 +
+
N
N
H
O
Aldimina
O
R''
H
O
R''
H
H
N
+
H
Chetimina
O
O
N
O
O
R''
N
N
α-chetoacido
+
H
H
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 49 -
Meccanismo della transaminazione
R' H
AA1
O
O
O
N
H
R'
H
R'
NH3 +
Aminoacido1
O
O
H
O
N
N
+
H
N
PLP legato
alla Lys
(CH2)4
H
N
H
O
R'
O
H
H
N
N
+
H
H
R''
NH3 +
AA2
+
O
N
O
H
Aminoacido2
α-chetoacido1
R'' H
O
O
O
R'
H
H
N
H
N
αKA1
O
NH3 +
PLP legato allo
ione ammonio
+
N
H
O
+
H
O
O
R''
H
R''
O
N
H
H
O
N
O
R''
N
N
H
H
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
+
O
O
α-chetoacido2
αKA2
- 50 -
25
Biosintesi degli aminoacidi
• Gli aminoacidi possono essere raggruppati in base agli
intermedi dai quali provengono:
– Famiglia dell’α-chetoglutarato:
• Glu, Gln, Pro, Arg, Lys.
– Famiglia dell’aspartato:
• Asp, Asn, Met, Thr, Ile, Lys.
– Famiglia del fosfoenolpiruvato e dell’eritrosio-4-fosfato:
• Phe, Tyr, Trp
– Famiglia del piruvato:
• Ala, Val, Leu
– Famiglia del 3-fosfoglicerato:
• Ser, Gly, Cys
– Dal fosforibosilpirofosfato:
• His
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 51 -
Degradazione degli aminoacidi
• A differenza degli acidi e grassi e dei glucidi gli
aminoacidi in eccesso non possono né essere
immagazzinati in macromolecole di deposito
né essere escreti come tali, vengono quindi
demoliti.
Proteine
Proteolisi
Aminoacidi
Liasi
Catena (deaminasi)
carboniosa
• Acetil-CoA
• AcetoacetilCoA
• Piruvato
• Intermedi ciclo
di Krebs
v. 1.4.2 © gsartor 2001-2012
Acidi grassi
Corpi chetonici
Glucoso
…
Metabolismo dell'azoto
NH4+
• Urea
• NH3
• Altri
composti
azotati
semplici
- 52 -
26
Proteolisi
• Idrolisi del legame peptidico
– Nell’intestino dell’uomo sono presenti
diverse proteasi secrete da diversi organi
digestivi:
• Dallo stomaco: pepsina
• Dal pancreas: chimotripsina e tripsina
• Dall’intestino tenue: peptidasi intestinali (leucina
aminopeptidasi.
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 53 -
Pepsina
• Secreta dalle cellule della mucosa gastrica (che
secernono anche HCl) come pepsinogeno inattivo (40
kD):
Pepsinogeno
pH acido
Pepsina
…-AA-AA-AA-AA-…
-42AA
AA + AA-AA + AA-AA-AA
• Taglia con maggior frequenza legami tra aminoacidi
aromatici, Met, Leu e produce peptidi e pochi aminoacidi
liberi.
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 54 -
27
Chimotripsina e tripsina
Chimotripsinogeno
Tripsinogeno
Enterochinasi
Tripsina + peptide 6 AA N-terminale
Chimotripsina + 2 peptidi
Arg
Lys
Trp
Tyr
Phe
H
N
N
*
H
*
*
*
O
H
R
O
v. 1.4.2 © gsartor 2001-2012
H
R
Metabolismo dell'azoto
- 55 -
Peptidasi intestinali
Procarbossipeptidasi A e B
Leucina aminopetidasi
Carbossipeptidasi
A
B
Lys
Arg
O
H
Leu
N
O
H
v. 1.4.2 © gsartor 2001-2012
R
O
*
O
H
R
Metabolismo dell'azoto
H
N
N
O
*
O
H
*
NH3+
O
H
R
- 56 -
28
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 57 -
Ossidazione degli aminoacidi
• La degradazione degli
aminoacidi è un processo
complesso che coinvolge
un numero molto grande
di intermedi:
Ala
Ser
Cys
Gly
Thr
Trp
Piruvato
Ile
Leu
Thr
Trp
CO2
• Catena Carboniosa
• Azoto ammoniacale:
– Urea
– NH3
• Azoto basi azotate:
– Acido urico
– Urea
– NH3
v. 1.4.2 © gsartor 2001-2012
Acetil-CoA
Glucoso
Asn
Asp
Ossalacetato
Fumarato
Asp
Phe
Tyr
Ile
Met
Val
CO2
Metabolismo dell'azoto
Citrato
KREBS
Succinil-CoA
Acetoacetato
Leu
Lys
Phe
Tyr
Isocitrato
CO2
α-chetoglutarato
Arg
Gln
Glu
Pro
His
- 58 -
29
Azoto
• Il primo stadio della degradazione degli
aminoacidi è la rimozione del gruppo
amminico attraverso le aminotransferasi:
AA1 + α-chetoacido2 → α-chetoacido1 + AA2
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 59 -
Azoto
O
O
O
O
Asp
Ossalacetato
NH3+
O
O
O
O
O
H3C
NH3+
Ala
H3C
O
O
O
O
O
CH3
NH3+
O
O
H3C
NH3+
O
CH3
O
O
Leu
O
+
+
H3C
Piruvato
O
O
O
O
O
α-chetoglutarato
Glu
α-chetoisocaproato
O
O
O
OH
OH
Tyr
p-idrossifenilpiruvato
NH3+
O
O
O
O
O
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 60 -
30
Azoto
O
O
O
O
Asp
Ossalacetato
NH3+
O
O
O
O
O
H3C
NH3+
Ala
H3C
O
O
O
O
O
O
CH3
O
CH3
O
O
O
α-chetoglutarato
Glu
NH3+
O
H3C
NH3+
O
O
Leu
O
+
+
H3C
Piruvato
O
O
α-chetoisocaproato
O
O
O
OH
OH
Tyr
p-idrossifenilpiruvato
NH3+
O
O
O
O
O
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 61 -
Transaminazione
• Le reazione di transaminazione usano come coenzima il
piridossal fosfato.
• Il piridossal fosfato forma una base di Shiff con un
residuo di Lys della transaminasi (EC 2.6.1.X, uno per
ogni aminoacido).
O
H
OH
O
OH
HO
O
N
+
CH3
OH
P
O
O
O
N
+
CH3
H
H
Piridossina
(Vit B6)
Piridossal fosfato
(PLP)
v. 1.4.2 © gsartor 2001-2012
NH3+
O
Metabolismo dell'azoto
OH
P
O
O
N
+
CH3
H
Piridossamina fosfato
(PMP)
- 62 -
31
Meccanismo della transaminazione
H
(CH2)4
O
O
O
(CH2)4
Aminoacido
R
NH3+
N
H
O
OH
P
O
O
+
N
(CH2)4
NH3+
H
Base di Shiff con
l'enzima
H
OH
N
O
N
O
P
O
O
O
O
R
O
N
H
O
NH3+
+
O
RH
CH3
H
+
OH
P
O
O
O
Base di Shiff con
l'aminoacido
N
CH3
CH3
H
H
H
+
(CH2)4
(CH2)4
NH3+
NH3+
O
H
H
O
OH
P
O
O
O
R
H2O
NH3+
+
N
H
H
H
O
+
O
N
O
α-chetoacido
CH3
H
O
R
v. 1.4.2 © gsartor 2001-2012
OH
P
O
O
O
CH3
O
N
Metabolismo dell'azoto
- 63 -
Meccanismo della transaminazione
R' H
O
O
O
N
H
R'
H
R'
NH 3+
Aminoacido1
O
O
H
O
N
N
+
H
Aldimina
N
(CH2 )4
H
N
H
O
R'
PLP-enzima
N
N
+
H
H
R''
NH3 +
O
H
H
Chetimina
N
O
+
H
O
Aminoacido2
α-chetoacido
R'' H
O
O
O
R'
H
H
N
H
O
O
NH3 +
+
N
N
H
H
O
N
O
Aldimina
O
R''
+
H
Chetimina
R''
H
H
O
N
O
R''
N
N
+
O
O
α-chetoacido
H
H
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 64 -
32
Meccanismo della transaminazione
R' H
AA1
O
O
O
N
H
R'
H
R'
NH3 +
Aminoacido1
O
O
H
O
N
N
+
H
N
PLP legato
alla Lys
(CH2)4
H
N
H
O
R'
O
H
H
N
N
+
H
H
R''
NH3 +
AA2
+
O
N
O
H
Aminoacido2
α-chetoacido1
R'' H
O
O
O
H
H
N
H
N
O
NH3 +
PLP legato allo
ione ammonio
+
N
H
αKG1
O
R'
+
H
O
O
R''
H
R''
O
H
H
N
O
O
N
R''
N
N
O
α-chetoacido2
αKG2
+
H
H
v. 1.4.2 © gsartor 2001-2012
O
Metabolismo dell'azoto
- 65 -
Meccanismo della transaminazione
Lys258
*
H
N
O
O
NH2+
HN
NH2
H
P
O
O
Tyr225
H
*
O
δ+
+
N
CH3
Tasca
idrofobica
H
Arg266
*
O
O
δ−
α-elica
dipolo
O
Asp222
*
• Il PLP è legato alla Lys come base di Shiff
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 66 -
33
Meccanismo della transaminazione
H
N
H2N
O
O
O
H
N
NH2+
*
O
NH
H
O
Arg
O P
NH2+ O
HN
Lys258
H
NH2
*
*
Arg
NH2+
Intermedio
tetraedrico
NH
H
Tyr225
O
O
H
O
*
δ+
NH2
+
N
CH3
Tasca
idrofobica
H
Arg266
O
*
O
δ−
α-elica
dipolo
*
Asp222
• Si lega l’AA, la molecola è tenuta in sede da due Arg che
danno la specificità
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 67 -
Meccanismo della transaminazione
H
N
O
α-chetoacido
O H2N
O
O
O
H
N
Lys258
NH3+
NH2+
*
NH3+
H
NH2
O
Arg
*
O P
NH2+ O
HN
*
Arg
NH2+
NH2
Piridossamina
H
H
O
O
Tyr225
H
O
*
δ+
+
N
CH3
Tasca
idrofobica
H
Arg266
O
*
O
α-elica
dipolo
δ−
Asp222
*
• Si forma l’α-chetoacido e la piridossamina.
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 68 -
34
Meccanismo della transaminazione
Lys258
Arg266
Asp222
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 69 -
PLP
• Il PLP è un sistema molto
versatile per trasformare
aminoacidi:
– Il legame C-H (A) è
reso più labile nelle
transaminasi
– Il legame C-COO- (B) è
reso più labile nelle
decarbossilasi
– Il legame C-R (C) è reso
più labile nelle aldolasi
– Gli enzimi con PLP
catalizzano anche
reazioni al Cβ e Cγ.
(C) R
O
H
O
(B)
(A)
H
N
O
O
P
O
O
O
N
+
H
CH3
H
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 70 -
35
Metabolismo dell’azoto
Ciclo dell’urea
Eliminazione dell’azoto
NH4+
Ammonio
• La forma molecolare con la quale
viene eliminato da un organismo
dipende dalla disponibilità di acqua:
NH2
H2 N
Urea
O
• Ammonio: Ammoniotelici
– Invertebrati acquatici
O
NH2
O
N
N
H
H
Acido allantoico
• Urea: Ureotelici
O
– Pesci, anfibi, bivalvi di acqua dolce
O
H
• Acido allantoico
– Alcuni teleostei
N
O
N
N
NH2
O
• Allantoina
H
– Molluschi, insetti, mammferi (non
primati)
• Acido Urico: Uricotelici
H
O
H
N
N
H
Disponibilità di acqua
Metabolismo dell'azoto
Allantoina
O
H
N
O
– Insetti, vermi, rettili, uccelli, primati.
v. 1.4.2 © gsartor 2001-2012
NH2
N
Acido urico
O
H
PURINE
- 72 -
36
Eliminazione dell’azoto
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 73 -
Ciclo dell’urea
2ATP
2ADP + Pi
Carbamilfosfato
O
CO2 + NH 3
O
Carbamil-fosfato
sintasi
EC 6.3.4.16
O
P
O
Citrullina
(IN)
NH 2
NH 2
HN
O
O
NH3 +
Ornitina
(IN)
Ornitina
trans carbamilasi
EC 2.1.3.3
NH3 +
Trasportatore
della citrullina
NH3 +
O
O
O
O
NH3 +
O
2 Pi
H2N
N
Argininosuccinato
sintasi
EC 6.3.4.5
Ornitina
(OUT)
NH3+
O
O
NH 2
O
ATP
Trasportatore
dell'ornitina
NH3+
H
N
O
Citrullina
(OUT)
N
PPi
N
O
Aspartato
H2N
O
Urea
O
NH3+
O
H2 N
O
Arginasi
EC 3.5.3.1
H
N
O
OH
OH
P
O
O
NH2+
O
NH3 +
Citrullil-AMP
O
H2O
O
N
O
Fumarato
NH3 +
O
O
O
H
N
NH 2
NH 2+
Arginina
Argininosuccinato
sintasi
EC 6.3.4.5
O
AMP
O
O
O
O
NH3+
Argininosuccinato
liasi
EC 4.3.2.1
O
H
N
O
O
O
NH2+
O
Argininosuccinato
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 74 -
37
Ciclo dell’urea
2ATP
2ADP + Pi
Carbamilfosfato
O
CO2 + NH 3
O
Carbamil-fosfato
sintasi
EC 6.3.4.16
O
P
O
Citrullina
(IN)
NH 2
NH 2
HN
O
O
NH3 +
Ornitina
(IN)
Ornitina
trans carbamilasi
EC 2.1.3.3
NH3 +
Trasportatore
della citrullina
NH3 +
O
O
O
O
NH3 +
O
2 Pi
H2N
ATP
N
Argininosuccinato
sintasi
EC 6.3.4.5
Ossalacetato
Ornitina
(OUT)
NH3+
O
O
NH 2
O
α-chetoacido Aminoacido
Trasportatore
dell'ornitina
NH3+
H
N
O
Citrullina
(OUT)
N
PPi
N
O
Aspartato
H2N
O
Urea
NH3+
O
H2 N
O
Arginasi
EC 3.5.3.1
H
N
O
OH
P
O
O
O
NH2+
O
NH3 +
Citrullil-AMP
O
H2O
OH
O
Malato
N
O
Fumarato
NH3 +
Argininosuccinato
sintasi
EC 6.3.4.5
O
H
N
O
O
NH 2
NH 2+
O
AMP
O
Arginina
O
O
O
NH3+
O
Argininosuccinato
liasi
EC 4.3.2.1
H
N
H
N
O
NH2+
O
O
Argininosuccinato
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 75 -
Ciclo dell’urea
2ATP
2ADP + Pi
Carbamilfosfato
O
CO2 + NH 3
O
Carbamil-fosfato
sintasi
EC 6.3.4.16
O
P
O
Citrullina
(IN)
NH2
NH 2
HN
O
O
NH3 +
Ornitina
(IN)
Ornitina
trans carbamilasi
EC 2.1.3.3
NH3 +
Trasportatore
della citrullina
NH3+
O
O
O
O
• La carbamil-fosfato sintasi catalizza la reazione di
formazione di carbamil-fosfato da CO2 e NH3.
NH3+
• Intervengono due molecole di ATP,
Ornitina
(OUT)
NH3 +
O
O
2 Pi
NH 2
O
H2N
ATP
Trasportatore
dell'ornitina
NH3 +
H
N
O
Citrullina
(OUT)
N
Argininosuccinato
sintasi
EC 6.3.4.5
N
PPi
N
N
• L’enzima deve essere attivato da un effettore allosterico, il
N-Acetilglutamato.
O
O
Aspartato
H2N
O
Urea
O
NH3+
O
H2N
O
Arginasi
EC 3.5.3.1
H
N
O
O
OH
OH
P
O
O
• Questo derivato proviene da acetil-CoA e glutamato
quando la concentrazione dei quest’ultimo è alta, segnale
di un eccesso di aminoacidi liberi.
NH 2+
O
NH3+
Citrullil-AMP
O
H2O
O
Fumarato
NH3+
O
O
O
H
N
NH 2
NH 2+
Arginina
Argininosuccinato
sintasi
EC 6.3.4.5
O
AMP
O
O
O
O
NH3 +
Argininosuccinato
liasi
EC 4.3.2.1
O
H
N
H
N
O
O
NH2+
O
Argininosuccinato
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 76 -
38
Ciclo dell’urea
ATP
H
H
N
H
ADP
O
Pi
ATP
O
HO
O
O
O
P
O
ADP
O
NH2
OH
P
O
O
O
O
Bicarbonato
NH2
O
O
O
Carbonil-fosfato
Carbammato
Carbamilfosfato
• Le due molecole di ATP operano in questo modo:
– la prima attiva in carbonato (CO2) per formare il carbonilfosfato,
– L’ammoniaca si lega e forma il carbammato liberando il
fosfato,
– La seconda molecola di ATP lega il carbammato
attivandolo.
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 77 -
Ciclo dell’urea
2ATP
2ADP + Pi
Carbamilfosfato
O
CO2 + NH 3
O
Carbamil-fosfato
sintasi
EC 6.3.4.16
O
P
O
Citrullina
(IN)
NH2
NH 2
HN
O
O
NH3 +
Ornitina
(IN)
Ornitina
trans carbamilasi
EC 2.1.3.3
NH3 +
Trasportatore
della citrullina
NH3+
O
O
O
O
NH3+
O
N
O
Urea
O
NH3+
O
H2N
O
Arginasi
EC 3.5.3.1
H
N
O
OH
OH
P
O
O
Citrullil-AMP
O
O
Fumarato
O
H
N
NH 2
NH 2+
Arginina
O
N
NH 2+
O
NH3+
H2O
NH3+
N
PPi
Aspartato
O
O
H2N
N
H2N
O
2 Pi
• Il carbamil-fosfato si lega
all’ornitina per formare la
citrullina.
• Queste due reazioni
avvengono nella matrice
mitocondriale dove l’ornitina
è stata trasportata da un
trasportatore specifico
Argininosuccinato
sintasi
EC 6.3.4.5
Ornitina
(OUT)
NH3 +
O
O
NH 2
O
ATP
Trasportatore
dell'ornitina
NH3 +
H
N
O
Citrullina
(OUT)
O
Argininosuccinato
sintasi
EC 6.3.4.5
AMP
O
O
O
O
NH3 +
Argininosuccinato
liasi
EC 4.3.2.1
O
H
N
H
N
O
O
NH2+
O
Argininosuccinato
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 78 -
39
Ciclo dell’urea
2ATP
2ADP + Pi
Citrullina
(IN)
Carbamilfosfato
O
• La citrullina viene
trasportata fuori dalla
matrice mitocondriale da
un trasportatore
specifico e, nel
citoplasma, si combina
con l’aspartato per dare
l’argininosuccinato.
CO2 + NH 3
P
O
Carbamil-fosfato
sintasi
EC 6.3.4.16
O
O
NH 2
NH 2
HN
O
O
NH3 +
Ornitina
(IN)
Ornitina
trans carbamilasi
EC 2.1.3.3
NH3 +
Trasportatore
della citrullina
NH3+
O
O
O
O
NH3 +
N
PPi
N
N
O
Aspartato
H2 N
NH3+
O
H2N
O
Arginasi
EC 3.5.3.1
H
N
O
OH
P
O
O
O
NH2+
O
NH3 +
Citrullil-AMP
O
H2O
OH
O
Urea
O
H2 N
N
• L’enzima responsabile è
l’argininosuccinato
sintasi che catalizza
prima la formazione del
Citrullil-AMP a spese di
ATP e quindi il legame
con l’aspartato.
O
2 Pi
Argininosuccinato
sintasi
EC 6.3.4.5
Ornitina
NH3 +
(OUT)
O
O
NH 2
O
ATP
Trasportatore
dell'ornitina
NH3 +
H
N
O
Citrullina
(OUT)
O
Fumarato
NH3 +
Argininosuccinato
sintasi
EC 6.3.4.5
O
H
N
O
O
NH2
NH2+
O
AMP
O
Arginina
O
O
O
NH3 +
Argininosuccinato
liasi
EC 4.3.2.1
H
N
H
N
O
O
NH 2+
O
O
Argininosuccinato
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 79 -
Ciclo dell’urea
2ATP
2ADP + Pi
Carbamilfosfato
O
CO2 + NH 3
O
Carbamil-fosfato
sintasi
EC 6.3.4.16
O
P
O
Citrullina
(IN)
NH2
NH 2
HN
O
O
NH3 +
Ornitina
(IN)
Ornitina
trans carbamilasi
EC 2.1.3.3
NH3 +
Trasportatore
della citrullina
NH3+
O
O
O
O
NH3+
O
2 Pi
NH 2
O
H2N
ATP
Trasportatore
dell'ornitina
NH3 +
H
N
O
Citrullina
(OUT)
N
Argininosuccinato
sintasi
EC 6.3.4.5
Ornitina
(OUT)
N
PPi
N
N
• Una liasi (Argininosuccinato liasi) promuove la scissione
dell’arginino siccinato in fumarato e arginina.
NH3 +
O
O
O
Aspartato
H2N
O
Urea
O
NH3+
O
H2N
O
H
N
O
O
OH
OH
P
O
O
• L’arginina è anche precursore dell’ossido di azoto (NO).
Arginasi
EC 3.5.3.1
NH 2+
O
NH3+
Citrullil-AMP
O
H2O
O
Fumarato
NH3+
O
O
O
H
N
NH 2
NH 2+
Arginina
Argininosuccinato
sintasi
EC 6.3.4.5
O
AMP
O
O
O
O
NH3 +
Argininosuccinato
liasi
EC 4.3.2.1
O
H
N
H
N
O
O
NH2+
O
Argininosuccinato
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 80 -
40
Ciclo dell’urea
2ATP
2ADP + Pi
Citrullina
Carbamilfosfato
(IN)
• Il fumarato può venire riciclato ad
aspartato attraverso la
Carbamil-fosfato
sintasi
formazione
di
malato
e
ossalacetato,
EC 6.3.4.16
O
CO2 + NH 3
O
O
P
O
NH2
NH 2
HN
O
O
NH3 +
• queste trasformazioni
sono catalizzate da isoenzimi
citosolici
Trasportatore
Ornitina
Ornitina
della citrullina
(IN)
trans carbamilasi
di analoghi enzimi
del
ciclo
di
Krebs
(mitocondriali).
EC 2.1.3.3
NH3+
O
O
NH3 +
O
• Le transaminasi si occupano poi di convertire l’ossalacetato in
aspartato che viene riutilizzato nella Citrullina
tappa
precedente.
(OUT)
O
NH3+
H
N
O
O
α-chetoacido
Ornitina
(OUT)
NH3 +
O
H2N
Aminoacido
N
Argininosuccinato
sintasi
EC 6.3.4.5
Ossalacetato
N
PPi
N
O
H2N
O
2 Pi
ATP
Trasportatore
dell'ornitina
NH3 +
O
NH 2
O
Malato
H2N
NH3+
O
O
Arginasi
EC 3.5.3.1
H
N
O
O
OH
P
O
O
NH 2+
O
NH3+
Citrullil-AMP
O
H2O
OH
O
Aspartato
Urea
N
O
Fumarato
NH3+
Argininosuccinato
sintasi
EC 6.3.4.5
O
H
N
O
O
NH 2
NH 2+
O
AMP
O
Arginina
O
O
O
NH3 +
O
Argininosuccinato
liasi
EC 4.3.2.1
H
N
H
N
O
NH2+
O
O
Argininosuccinato
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 81 -
Ciclo dell’urea
2ATP
2ADP + Pi
Carbamilfosfato
O
CO2 + NH 3
O
Carbamil-fosfato
sintasi
EC 6.3.4.16
O
P
O
Citrullina
(IN)
NH2
NH 2
HN
O
O
NH3 +
Ornitina
(IN)
Ornitina
trans carbamilasi
EC 2.1.3.3
NH3 +
Trasportatore
della citrullina
NH3+
O
O
O
O
NH3+
O
N
N
O
Aspartato
O
Urea
O
NH3+
O
H2N
O
Arginasi
EC 3.5.3.1
H
N
O
NH 2+
Arginina
O
O
Argininosuccinato
sintasi
EC 6.3.4.5
O
NH 2
P
Citrullil-AMP
O
H
N
OH
OH
O
Fumarato
NH3+
O
N
NH 2+
O
NH3+
H2
O
H2N
N
PPi
• L’arginina viene infine
convertita in ornitina (OUT)
e Urea da una arginasi.
H2N
O
2 Pi
Argininosuccinato
sintasi
EC 6.3.4.5
Ornitina
(OUT)
NH3 +
O
O
NH 2
O
ATP
Trasportatore
dell'ornitina
NH3 +
H
N
O
Citrullina
(OUT)
O
AMP
O
O
O
O
NH3 +
Argininosuccinato
liasi
EC 4.3.2.1
O
H
N
H
N
O
O
NH2+
O
Argininosuccinato
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 82 -
41
Ciclo dell’urea
2ATP
2ADP + Pi
Carbamilfosfato
O
CO2 + NH 3
O
Carbamil-fosfato
sintasi
EC 6.3.4.16
O
P
O
Citrullina
(IN)
NH 2
NH 2
HN
O
O
NH3 +
Ornitina
(IN)
Ornitina
trans carbamilasi
EC 2.1.3.3
NH3 +
Trasportatore
della citrullina
NH3 +
O
O
O
O
NH3 +
O
2 Pi
H2N
ATP
N
Argininosuccinato
sintasi
EC 6.3.4.5
Ossalacetato
Ornitina
(OUT)
NH3+
O
O
NH 2
O
α-chetoacido Aminoacido
Trasportatore
dell'ornitina
NH3+
H
N
O
Citrullina
(OUT)
N
PPi
O
Aspartato
H2N
O
N
N
Urea
Malato
H2 N
O
Arginasi
EC 3.5.3.1
H
N
O
OH
P
O
O
O
NH2+
O
NH3 +
Citrullil-AMP
O
H2O
OH
O
NH3+
O
O
Fumarato
NH3 +
Argininosuccinato
sintasi
EC 6.3.4.5
O
H
N
O
O
NH 2
O
AMP
O
NH 2+
Arginina
O
O
O
NH3+
O
Argininosuccinato
liasi
EC 4.3.2.1
H
N
H
N
O
NH2+
O
O
Argininosuccinato
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 83 -
Ciclo dell’urea e NO
2ATP
2ADP + Pi
Carbamilfosfato
O
CO 2 + NH3
O
Carbamil-fosfato
sintasi
EC 6.3.4.16
O
P
O
Citrullina
(IN)
NH 2
NH 2
HN
O
O
NH3+
Ornitina
(IN)
Ornitina
trans carbamilasi
EC 2.1.3.3
NH3+
Trasportatore
della citrullina
NH3+
O
O
Citrullina
(OUT)
O
H2O +
0.5 NADP+
O
NH3+
H
N
O
Trasportatore
dell'ornitina
NH3+
Ornitina
(OUT)
O
NO sintasi
EC 1.14.13.39
NH3+
O
Urea
H2N
H
N
N
Argininosuccinato
sintasi
EC 6.3.4.5
OH
Ossalacetato
O
O
NH3+
O
H2N
Arginasi
EC 3.5.3.1
O
Malato
Fumarato
NH3+
O
NH2
NH2+
Arginina
OH
OH
P
O
O
NH 2+
O
Citrullil-AMP
O
Argininosuccinato
sintasi
EC 6.3.4.5
O
H
N
O
N
O
Aminoacido
H2O
O
H
N
O
NH3+
α-chetoacido
O2 +
NADPH
N
Aspartato
O
H2O +
NADP+
H 2N
N
PPi
N-ϖ
ϖ-idrossi-L-arginina
O
2 Pi
ATP
NO.
NH2
N
O
NH 3+
O2 +
0.5 NADPH
O
NH2
O
O
AMP
O
O
O
O
NH 3+
Argininosuccinato
liasi
EC 4.3.2.1
O
H
N
H
N
O
O
NH2+
O
Argininosuccinato
v. 1.4.2 © gsartor 2001-2012
Metabolismo dell'azoto
- 84 -
42
Catena carboniosa
Ala
Ser
Cys
Gly
Thr
Trp
Piruvato
Ile
Leu
Thr
Trp
CO2
Acetil-CoA
Glucoso
Asn
Asp
Asp
Phe
Tyr
Ossalacetato
Fumarato
Acetoacetato
Citrato
KREBS
Isocitrato
CO2
α-chetoglutarato
Succinil-CoA
Ile
Met
Val
CO2
v. 1.4.2 © gsartor 2001-2012
Leu
Lys
Phe
Tyr
Arg
Gln
Glu
Pro
His
Metabolismo dell'azoto
- 85 -
Crediti e autorizzazioni all’utilizzo
• Questo materiale è stato assemblato da informazioni raccolte dai seguenti testi di Biochimica:
– CHAMPE Pamela , HARVEY Richard , FERRIER Denise R. LE BASI DELLA BIOCHIMICA [ISBN 9788808-17030-9] – Zanichelli
– NELSON David L. , COX Michael M. I PRINCIPI DI BIOCHIMICA DI LEHNINGER - Zanichelli
– GARRETT Reginald H., GRISHAM Charles M. BIOCHIMICA con aspetti molecolari della Biologia
cellulare - Zanichelli
– VOET Donald , VOET Judith G , PRATT Charlotte W FONDAMENTI DI BIOCHIMICA [ISBN 9788808-06879-8] - Zanichelli
• E dalla
–
–
–
–
consultazione di svariate risorse in rete, tra le quali:
Kegg: Kyoto Encyclopedia of Genes and Genomes http://www.genome.ad.jp/kegg/
Brenda: http://www.brenda.uni-koeln.de/
Protein Data Bank: http://www.rcsb.org/pdb/
Rensselaer Polytechnic Institute:
http://www.rpi.edu/dept/bcbp/molbiochem/MBWeb/mb1/MB1index.html
• Il materiale è stato inoltre rivisto e corretto dalla Prof. Giancarla Orlandini dell’Università di Parma alla
quale va il mio sentito ringraziamento.
Questo ed altro materiale può essere reperito a partire da:
http://www.ambra.unibo.it/giorgio.sartor/ oppure da http://www. gsartor.org/
Il materiale di questa presentazione è di libero uso per didattica e ricerca e può essere usato senza
limitazione, purché venga riconosciuto l’autore usando questa frase:
Materiale ottenuto dal Prof. Giorgio Sartor
Università di Bologna a Ravenna
Giorgio Sartor - [email protected]
43