REGIONE SICILIANA
AZIENDA UNITA’ SANITARIA LOCALE N° 6
PALERMO
PERCORSO TERAPEUTICO SULL’UTILIZZO DEGLI
ANTIPSICOTICI ATIPICI
AZIENDA USL N° 6 PALERMO
Commissione Multidisciplinare per la Elaborazione dei percorsi terapeutici e profili farmacoeconomici Aziendali
0
INTRODUZIONE
Sin dagli anni ’50 la scoperta della CLORPROMAZINA (un derivato fenotiazinico) segnò l’inizio di un nuovo trattamento
farmacologico della schizofrenia.
Una serie di composti similari, costituente una nuova classe di antipsicotici (tioxanteni, butirrofenoni,difenilbutilpiperidine,
benzamidi sostituite, ecc.), furono in seguito sviluppati, rappresentando la base del trattamento della schizofrenia, sia
negli stati psicotici acuti, che nella prevenzione delle ricadute.
La principale azione farmacologia dei farmaci antipsicotici cosiddetti “tipici” consiste nel loro effetto antagonista sui
recettori D2 per la dopamina.
Il blocco dei recettori D2 è inoltre responsabile degli effetti collaterali extrapiramidali (EPS -ExtraPyramidal Simptoms )
quali parkinsonismo, distonia e discinesia; essi hanno, inoltre, una forte affinità per altri recettori, come gli istaminergici,
serotoninergici, colinergici ed alfa-adrenergici, responsabili di molteplici altri effetti quali sedazione, aumento ponderale
ed ipotensione e, con l’utilizzo a lungo termine, sono a rischio di determinare EPS ad esordio tardivo e spesso
persistenti (discinesia tardiva) (Kane, 1992).
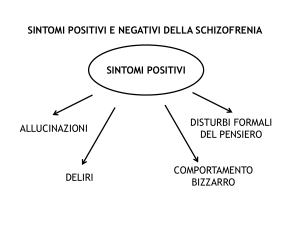
Inoltre sono inefficaci, o lo sono in minima parte, sui sintomi negativi ed una popolazione tra il 15% ed il 30% di pazienti
schizofrenici sono resistenti a questi farmaci.
La CLOZAPINA, sviluppata negli anni ’70, primo degli antipsicotici “atipici”, sfatò il dogma che gli effetti extrapiramidali
fossero una conseguenza inevitabile dell’efficacia antipsicotica. Ritirata dal commercio per un decennio per alcuni casi
fatali di agranulocitosi e reintrodotta sotto costante monitoraggio, si rivelò efficace nella schizofrenia resistente al
trattamento (Kane et al, 1988).
Un nuovo meccanismo d’azione, con un’affinità relativamente bassa per i recettori D2 e molto più elevata per i D4 e per
sottotipi di recettori serotoninergici, ha fatto sì che la clozapina venisse denominata antipsicotico “atipico” per
differenziarla dai vecchi antipsicotici “convenzionali”, che bloccano invece prevalentemente i recettori D2.
Con la scoperta della clozapina si sviluppò la ricerca di altri nuovi farmaci, efficaci e meglio tollerati, per il trattamento
della schizofrenia, in particolare l’AMISULPRIDE , l’OLANZAPINA , la QUETIAPINA , il RISPERIDONE , l’
ARIPIPRAZOLO , in genere conosciuti come “atipici” sulla base delle loro proprietà clozapina-simili.
Attualmente la distinzione tra farmaci antipsicotici convenzionali ed atipici è, tuttavia, in certa misura, poco chiara in
quanto alcuni farmaci convenzionali somigliano ad alcuni dei nuovi atipici, sia per le proprietà farmacologiche che per il
loro meccanismo d’azione.
Il termine “atipico” è attualmente, in pratica, sinonimo di nuovo antipsicotico.
Dal momento che l’efficacia e molti degli effetti collaterali dei farmaci antipsicotici sono comunque in misura elevata
dose-dipendenti, i risultati dei trials che confrontano antipsicotici differenti risultano essere in misura altrettanto elevata
dipendenti dal dosaggio utilizzato.
Gli utilizzi degli antipsicotici
Nel trattamento e nella gestione della schizofrenia gli antipsicotici sono correntemente utilizzati per il trattamento degli
episodi acuti, per la prevenzione delle ricadute, per il trattamento d’emergenza di problemi comportamentali
acuti (sedazione rapida) e per la riduzione dei sintomi. Gli antipsicotici sono disponibili come preparazioni orali,
intramuscolari (IM) ed endovenose (EV), o come preparazioni IM depot medium- o long-acting.
L’uso di clozapina è autorizzato solo per le persone affette da schizofrenia che non rispondono, o che presentano
intolleranza agli antipsicotici convenzionali.
Il dosaggio degli antipsicotici
Viene definito “dosaggio standard” quella dose terapeutica che assicura il migliore equilibrio tra vantaggi terapeutici ed
effetti avversi dose-dipendenti.
In passato, per le persone affette da un disturbo ormai definito, sono stati raccomandati bassi dosaggi e l’utilizzo di
strategie con dosaggi intermittenti (con identificazione di segni precoci di ricaduta) allo scopo di ridurre al minimo gli
effetti collaterali. Quando, tuttavia, tali strategie sono state sottoposte alla verifica sperimentale di trials controllati, i
rischi, specialmente in termini di aumento delle ricadute, superavano ogni eventuale beneficio (Dixon et al, 1995; Hirsch
e Barnes, 1995).
Dovrebbero quindi essere usate strategie di mantenimento con dosaggi costanti invece di dosaggi intermittenti e mirati
per via dell’aumentato rischio di un peggioramento della sintomatologia o di una ricaduta. (Schizophrenia Patient
Outcomes Research Team, 1998).
1
Le prove d’efficacia suggeriscono invece che i pazienti mai precedentemente trattati possono rispondere a dosaggi
relativamente bassi di farmaci antipsicotici (McElroy et al, 1991; Oosthuizen et al, 2001; Tauscher e Kapur, 2001;
Cookson et al, 2002).
Le persone che vivono il proprio primo episodio di schizofrenia dovrebbero essere trattate con una medicazione
antipsicotica al limite inferiore dell’intervallo dei dosaggi raccomandati nel SPC ( Primo Episodio Psicotico ) per almeno
6 settimane. (vedi Flow-chart n.1).
L’Health Evidence Bulletins, citando Barbui et al (1996), ha dichiarato che “bassi dosaggi di terapia antipsicotica
(equivalenti a 50-100 mg di clorpromazina) non sono altrettanto efficaci nella prevenzione delle ricadute rispetto ai
dosaggi standard (equivalenti a 200-500 mg di clorpromazina).
L’odds ratio combinato era di 2.08 a 12 mesi (IC 95% da1.3 a 3.3, P<0.005) e di 1.09 a 24 mesi (IC 95% da 0.55 a 2.1).
La riduzione del rischio relativo, secondo un’analisi “intention-to-treat”, era del -47% a 12 mesi (IC 95% da -15% a -88%)
e del -5% a 24 mesi (IC 95% da 28% a -52%) (Health Evidence Bulletins, 1998).
La prevenzione farmacologica delle ricadute
Non è certo se sia necessario un trattamento farmacologico di mantenimento per tutte le persone affette da schizofrenia.
Circa il 20% dei soggetti andrà incontro soltanto ad un singolo episodio (Möller e van Zerssen, 1995) ed una percentuale
simile incorrerà in una ricaduta nonostante abbia proseguito il trattamento farmacologico antipsicotico. Non è chiaro se i
soggetti in quest’ultimo gruppo traggano beneficio da un aumento del dosaggio antipsicotico durante gli episodi di
esacerbazione psicotica (Steingard et al, 1994).
Studi controllati con placebo hanno però dimostrato che sino al 60% dei soggetti che non ricevono una profilassi con
antipsicotici ricade entro un anno a partire dal primo episodio di psicosi.
Non esistendo, tuttavia, predittori attendibili riguardo alla prognosi o alla risposta farmacologica, la prevenzione
farmacologica delle ricadute deve essere presa in considerazione per ogni paziente che abbia ricevuto una diagnosi di
schizofrenia.
Possibili eccezioni sono rappresentate da quelle persone con episodi psicotici molto brevi senza conseguenze
psicosociali negative e per quei rari pazienti per i quali tutti gli antipsicotici disponibili determinano un significativo rischio
per la salute (Fleischhacker e Hummer, 1997).
Le linee guida realizzate da consensus di esperti (Kissling, 1991) hanno raccomandato 1-2 anni di profilassi per tutti i
soggetti cui è stata posta diagnosi di schizofrenia. (vedi Flow-chart n.2).
Effetti collaterali degli antipsicotici
Tutti i farmaci antipsicotici sono associati ad effetti collaterali, ma il profilo ed il significato clinico di questi variano a
seconda degli individui e dei farmaci.
Tali effetti collaterali possono includere: EPS (quali parkinsonismo, reazioni diatoniche acute, acatisia e discinesia
tardiva), effetti sul sistema nervoso autonomo (quali visione sfocata, aumento della pressione intraoculare, secchezza
delle fauci e della congiuntiva, costipazione e ritenzione urinaria), aumento dei livelli di prolattina, convulsioni, sedazione
ed aumento ponderale. Anche la sicurezza cardiologica rappresenta un tema d’interesse poiché diversi antipsicotici
hanno mostrato di prolungare i tempi di ripolarizzazione ventricolare, il che è associato ad un aumentato rischio d’aritmie
ventricolari.
Le persone affette da schizofrenia ritengono che gli effetti collaterali più problematici siano gli EPS, l’aumento ponderale,
le disfunzioni sessuali e la sedazione ed è verosimile che siano effetti collaterali sottostimati del trattamento
antipsicotico. (NICE 2002).
Gli EPS sono facilmente riconoscibili , la loro comparsa, tuttavia, non è prevedibile in maniera accurata.
L’acatisia è inoltre spesso non rilevata o erroneamente diagnosticata quale agitazione.
La discinesia tardiva (movimenti oro-faciali e del tronco), che può non essere immediatamente evidente, risulta
resistente al trattamento, può essere irreversibile e può peggiorare con la sospensione del trattamento.
Le disfunzioni sessuali possono derivare dall’iperprolattinemia indotta dai farmaci.
Le prove d’efficacia, comunque prese in considerazione, suggeriscono che gli antipsicotici atipici siano efficaci almeno
quanto i farmaci convenzionali in termini di tassi di risposta complessiva.
Esistono inoltre prove d’efficacia che suggeriscono che essi possono differire nell’effetto relativo sui sintomi positivi e
negativi e sui tassi di ricaduta.
2
Esistono forti evidenze che suggeriscono che la classe degli antipsicotici atipici sia associata ad un minor rischio di EPS
rispetto ad antipsicotici convenzionali come l’Aloperidolo; Quetiapina e probabilmente Olanzapina causano EPS simili al
placebo.
Gli antipsicotici atipici sono inoltre associati ad un minor numero di persone che interrompono il trattamento. I dati relativi
all’aumento ponderale derivanti dai trials clinici erano disponibili solo per Olanzapina, Risperidone e Amisulpride e, per
ciascuno di essi, riportavano evidenze d’aumenti ponderali differenziati. Prove d’efficacia preliminari suggeriscono che
alcuni antipsicotici atipici possono essere associati ad una più elevata prevalenza di diabete.
Per ciò che concerne l’iperprolattinemia, effetto molto comune in corso di trattamento con antipsicotici tradizionali, con
gli atipici non sembra esservi un suo significativo aumento, segnatamente per Quetiapina ed Olanzapina, mentre il
contrario avviene con il Risperidone.
Linee guida e livelli di evidenza in medicina (EBM)
Le linee guida sono strumenti che rendono possibili una valutazione della qualità delle prestazioni erogate e non
sostituiscono le conoscenze professionali ed il giudizio clinico.
Il loro uso ottimale consiste non nel dare indicazioni vincolanti da applicare ai singoli pazienti, ma sono invece indicatori
attraverso cui le prestazioni di team di operatori possono essere valutate.
Esse, utilizzate nei processi decisionali circa i trattamenti appropriati per condizioni specifiche, derivano dalle migliori
prove d’efficacia disponibili nella ricerca, grazie all’utilizzo di metodi predeterminati e sistematici per identificare e
valutare tutte le evidenze riguardanti la specifica condizione in questione; qualora si riscontrino aree tematiche in cui le
prove d’efficacia siano carenti, le linee guida includono dichiarazioni e raccomandazioni basate su dichiarazioni di
consenso sviluppate dal Guideline Development Group (GDG).
Nel loro utilizzo è infine importante ricordare che l’assenza d’evidenze empiriche sull’efficacia nella pratica clinica di
specifici interventi non è sinonimo d’evidenza d’inefficacia.
Nell’ambito della salute mentale i trattamenti basati sulle prove d’efficacia vanno intesi nel contesto di un programma
complessivo di trattamento che comprende una gamma d’attività il cui scopo dovrebbe essere quello di facilitare la presa
in carico degli utenti, offrendo un contesto appropriato ad erogare specifici interventi; in caso contrario i benefici specifici
d’interventi pur efficaci andranno perduti, in quanto una buona relazione terapeutica è a volte più importante degli
specifici trattamenti offerti.
LEGENDA
SIGLE
Good Practice Points (GPP) , Buona Pratica Clinica, consiste in raccomandazioni basate sulle
GPP
migliori conoscenze e sull’esperienza degli esperti che la producono.
NHS National Health Service (NHS) corrispondente al nostro Servizio Sanitario Nazionale.
Il National Institute for Clinical Excellence (NICE) è stato istituito come una Special Health
Authority for England and Wales da parte del NHS nel 1999, con l’intento di fornire un’unica fonte
NICE d’indicazioni autorevoli e affidabili per i pazienti, gli operatori ed il pubblico. Esso commissiona la
realizzazione di linee guida nazionali per la pratica clinica dedicate ai trattamenti in genere ed alla
gestione di condizioni specifiche.
CATEGORIE DI EVIDENZA
Ia
Evidenza da metanalisi di trials randomizzati controllati
Ib
Evidenza da almeno un trial randomizzato controllato, ma con scarsa potenza statistica
IIa Evidenza da almeno uno studio controllato senza randomizzazione
IIb Evidenza da almeno un altro studio quasi sperimentale (comparativi di coorte)
III
Evidenza da studi descrittivi (osservazionali, comparativi, di correlazione e caso-controllo)
IV
Evidenza da relazioni di comitati di esperti e/o da esperienze cliniche di autorità scientifiche
3
GRADO DI RACCOMANDAZIONE
A
direttamente basate su evidenze di categoria I
B
direttamente basate su evidenze di categoria II o estrapolate da evidenze di categoria I
C
direttamente basate su evidenze di categoria III o estrapolate da evidenze di categoria I o II
D
direttamente basate su evidenze di categoria IV o estrapolate da evidenze di categoria I, II o III
(Eccles et al, BMJ 1998; 316: 1232-5)
Raccomandazioni per la pratica clinica
Quelle che seguono sono le principali risultanze delle raccomandazioni NICE, specificatamente rivolte alle scelte
terapeutiche in corso di psicosi, da cui è derivato un livello di evidenza.
1. La scelta del farmaco antipsicotico dovrebbe essere presa congiuntamente dalla persona e dal clinico responsabile
del trattamento, sulla base di una discussione durante la quale si sono fornite informazioni e si è discusso dei
benefici legati all’assunzione del farmaco nonché del profilo degli effetti collaterali.
LIVELLO DI EVIDENZA: NICE 2002
2. La terapia antipsicotica dovrebbe essere avviata come parte di un pacchetto completo d’assistenza che risponda ai
bisogni clinici, emozionali e sociali della persona.
LIVELLO DI EVIDENZA: NICE 2002
3. I dosaggi di un antipsicotico convenzionale per un episodio acuto dovrebbero essere compresi nel range di 3001000 mg di clorpromazina/ equivalenti al giorno per un periodo minimo di 6 settimane. I motivi per utilizzare dosaggi
al di fuori di questo range devono essere giustificati e documentati. Deve essere impiegata la dose minima efficace.
LIVELLO DI EVIDENZA: C
4. Gli antipsicotici atipici a dosaggi ai limiti inferiori del range standard sono il trattamento più indicato per una persona
al primo episodio schizofrenico e sono l’opzione di trattamento di prima scelta per il minor rischio potenziale di
sintomi extrapiramidali (EPS).
LIVELLO DI EVIDENZA: C
5. È raccomandato che gli antipsicotici atipici orali amisulpride, olanzapina, quetiapina e risperidone siano considerati
nell’ambito dei trattamenti di prima scelta per le persone per cui è stata posta per la prima volta la diagnosi di
schizofrenia.
LIVELLO DI EVIDENZA: NICE 2002
6. I farmaci antipsicotici atipici orali (amisulpride, olanzapina, quetiapina, risperidone) dovrebbero essere considerati
quali opzioni terapeutiche per i soggetti già in trattamento con farmaci antipsicotici convenzionali che, nonostante un
adeguato controllo della sintomatologia, stiano andando incontro ad inaccettabili effetti collaterali. In caso di
ricaduta, tale opzione può essere considerata, per quei soggetti che hanno già avuto esperienza di una gestione
non soddisfacente o d’effetti collaterali inaccettabili con i farmaci antipsicotici tipici.
LIVELLO DI EVIDENZA: NICE 2002
7. Strategie di mantenimento con dosaggi intermittenti e mirati, non dovrebbero essere abitualmente usate al posto di
un regime con dosaggi costanti, a causa dell’aumentato rischio di un peggioramento della sintomatologia o di una
ricaduta. Queste strategie tuttavia potrebbero essere prese in considerazione per gli utenti che rifiutano una terapia
di mantenimento o per i quali sussistano altre controindicazioni ad una terapia di mantenimento, quale una
particolare sensibilità agli effetti collaterali.
LIVELLO DI EVIDENZA: C
8. Nella pratica clinica abituale, non è indicato che i soggetti, se hanno raggiunto un buon controllo della loro
condizione senza patire effetti collaterali inaccettabili con un antipsicotico convenzionale, cambino la terapia in
favore di un farmaco antipsicotico atipico orale.
LIVELLO DI EVIDENZA: NICE 2002
4
9. I farmaci antipsicotici, atipici o convenzionali, non dovrebbero essere prescritti simultaneamente, ad eccezione di
brevi periodi per coprire il periodo di passaggio da una molecola all’altra.
LIVELLO DI EVIDENZA: C
10. Nel caso in cui sia stata identificata (o sia indicata nel Foglio Illustrativo) la possibilità che l’antipsicotico atipico
prescritto causi aumento ponderale o diabete, dovrebbe essere attivato un regolare monitoraggio di questi rischi
potenziali.
LIVELLO DI EVIDENZA: B
11. A causa dell’elevato rischio di ricaduta dopo un episodio acuto, dovrebbe essere valutata la prosecuzione del
trattamento antipsicotico per 1-2 anni dopo una ricaduta, in quanto proseguire il trattamento con antipsicotici
convenzionali per un periodo di alcuni anni sembra ridurre il rischio di ricaduta di circa due terzi (Kissling, 1991).
GRADO DI RACCOMANDAZIONE: GPP
12. Da studi controllati con placebo e dagli studi di sospensione, l’efficacia degli antipsicotici nella prevenzione delle
ricadute è confermata. Tutti gli antipsicotici identificati per la revisione, in realtà, si sono dimostrati superiori al
placebo nella prevenzione delle ricadute, sebbene non sia definito se esista un antipsicotico con una maggior
efficacia o una miglior tollerabilità rispetto ad altri, specialmente in relazione agli atipici.
LIVELLO DI EVIDENZA: C
13. La sospensione del trattamento antipsicotico deve essere intrapresa in modo graduale con un monitoraggio
costante dei segni e dei sintomi che possano indicare una potenziale ricaduta.
GRADO DI RACCOMANDAZIONE: GPP
14. Dopo la sospensione di un trattamento antipsicotico, il monitoraggio dei segni e dei sintomi di una potenziale
ricaduta deve continuare per almeno 2 anni dopo l’ultimo episodio acuto.
GRADO DI RACCOMANDAZIONE: GPP
Considerazioni conclusive
Lo scopo dello sviluppo di farmaci antipsicotici è stato quello di creare nuovi agenti con efficacia superiore e minori effetti
collaterali.
Gli studi sui nuovi farmaci atipici hanno suggerito che la loro efficacia a breve termine è per lo meno pari a quella degli
agenti antipsicotici convenzionali ma con minori effetti collaterali extrapiramidali. Per questi ultimi la differenza
d’incidenza d’effetti collaterali, è estremamente dose-dipendente; con gli antipsicotici atipici varia a seconda degli
specifici farmaci e solo per alcuni di essi gli EPS sono dose-dipendenti (Geddes et al, 2000; NICE, 2002).
In assenza di sperimentazioni in doppio (head-to-head) sufficientemente protratte nel tempo, l’efficacia relativa in termini
di prevenzione delle ricadute degli antipsicotici convenzionali rispetto agli atipici, rimane incerta.
Ringraziamenti
La realizzazione di questo percorso terapeutico , è stato reso possibile grazie alla disponibilità del Dr. Sergio Ficarra,
cui viene rivolto un sincero e profondo ringraziamento.
Bibliografia
1. American Psychiatric Association. Practice guideline for the treatment of patients with schizophrenia. Am J
Psychiatry 1997; 154(Suppl 4): 1-63.
5
2. American Psychiatric Association. Practice guidelines for the treatment of psychiatric disorders. Washington, DC:
2002.
3. Arivanitis LA, Miller BG, and the Seroquel trial 13 study group. Multiple fixed doses of "Seroquel" (quetiapine) in
patients with acute exacerbation of schizophrenia: A comparison with haloperidol and placebo. Biol Psychiatry 1997;
42: 233-246.
4. Beasley CM, et al. Olanzapine versus placebo and haloperidol. Neuropsychopharmacology 1996; 14: 111-123.
5. Beasley CM, et al. Olanzapine versus placebo: results of a double-blind, fixed-dose olanzapine trial.
Psychopharmacology (Berl) 1996; 124: 159-167.
6. Beasley Jr CM, et al. Safety of olanzapine. J Clin Psychiatry 1997; 58 Suppl. 10: S13-S17.
7. Bernstein JG. Induction of obesity by psychotropic drugs. Ann N Y Acad Sci 1985; 499: 203-215.
8. Bondolfi G, et al. Risperidone versus clozapine in treatment-resistant chronic schizophrenia: a randomized doubleblind study. Am J Psychiatry 1998; 155: 499-504.
9. Briffa D, Meehan T. Weight changes during clozapine treatment. Aust N Z J Psychiatry 1998; 32: 718-721.
10. Buchanan RW, Breier A, Kirkpatrick B, Ball P, Carpenter WT Jr. Positive and negative symptoms response to
clozapine in schizophrenic patients with and without the deficit syndrome. Am J Psychiatry 1998; 155: 751-60.
11. Bustillo JR, et al. Differential effect of clozapine on weight : a controlled study. Am J Psychiatry 1996; 153: 817-819.
12. Canadian clinical practice guidelines for the treatment of schizophrenia. Can J Psychiatry 1998; 43(Suppl 2): 2540S.
13. Claus A, et al. Risperidone versus haloperidol in the treatment of chronic schizophrenic inpatients: a multicentre
double-blind comparative study. Acta Psychiatr Scand 1992; 85: 295-305.
14. Cohen S, et al. Weight gain associated with clozapine. Am J Psychiatry 1990; 147: 503-504.
15. Conley R, Mahmoud R. A randomised double-blind study of risperidone and olanzapine in the treatment of
schizophrenia or schizoaffective disorder. Am J Psychiatry 2001; 158(5): 765-74.
16. Copolov DL, et al. A comparison of quetiapine (ICI 204,636, "Seroquel") and haloperidol in schizophrenia. Psychol
Med 2000; 30: 95-105.
17. Csernansky JG, Mahmoud R, Brenner R. A comparison of risperidone and haloperidol for the prevention of relapse
in patients with schizophrenia. N Engl J Med 2002; 346(1): 17-22.
18. Duggan L, Fenton M, Dardennes RM, El-Dosoky A, Indran S. Olanzapine for schizophrenia. Cochrane Library 4.
Oxford (UK); Update Software, 2000.
19. Emsley RA, et al. A comparison of the effects of quetiapine ("Seroquel") and haloperidol in schizophrenic patients
with a history of and a demonstrated, partial response to conventional antipsychotic treatment. Int Clin
Psychopharmacol 2000; 15: 121-131.
20. Fenton WS, et al. Determinants of medication compliance in schizophrenia: empirical and clinical findings.
Schizophr Bull 1997; 23: 637-651.
21. Geddes J, Freemantle N, Harrison P, Bebbington P. Atypical antipsychotics in the treatment of schizophrenia:
systematic overview and meta-regression analysis. Br Med J 2000; 321: 1371-6.
22. Guy W (ed) (1976). ECDEU Assessment Manual for Psychopharmacology. Revised Edition. Rockville, MD: NIMH
Pubblication.
23. Ho BC, Miller D, Nopoulos P, Andreasen NC. A comparative effectiveness study of risperidone and olanzapine in
the treatment of schizophrenia. J Clin Psychiatry 1999; 60: 658-63.
24. Höyberg OJ, et al. Risperidone versus perphenazine in the treatment of chronic schizophrenic patients with acute
exacerbations. Acta Psychiatr Scand 1993; 88: 395-402.
25. Jalenques I, Coudert AJ. Clozapine et schizophrenies resistantes. Encephale 1994 ; 20 : 767-775.
26. Kane J, Honigfeld G, Singer J, Meltzer H. Clozapine for the treatment-resistant schizophrenic: a double-blind
comparison with chlorpromazine. Arch Gen Psychiatry 1988; 45: 789-96.
27. Kay SR, Fiszbein A, Opler LA. (1987) The positive and negative symptom scale (PANSS) for schizophrenia.
Schizophrenia Bulletin, 13, 261-276.
28. Kennedy E, Song F, Hunter R, Clark A, Gilbody S. Risperidone versus typical antipsychotic medication for
schizophrenia. Cochrane Library 4. Oxford (UK); Update Software, 2000.
29. King DJ, et al. A comparison of bd and tid dose regimens of quetiapine (Seroquel) in the treatment of schizophrenia.
Psychopharmacology 1998; 137: 139-146.
30. Kraus T, et al. Body weight and leptin plasma levels during treatment with antipsychotic drugs. Am J Psychiatry
1999; 156: 312-314.
31. Leadbetter R, et al. Clozapine-induced weight gain: prevalence and clinical relevance. Am J Psychiatry 1992; 149:
68-72.
6
32. Marder SR, Davis JM, Chouinard G. The effects of risperidone on the five dimensions of schizophrenia derived by
factor analysis: combined results of the North American trials. J Clin Psychiatry 1997; 58: 538-46.
33. McElroy SL, et al. Olanzapine in treatment-resistant bipolar disorder. J Affect Disord 1998; 49: 119-122.
34. Osser DN, Sigadel R. Short-term inpatient pharmacotherapy of schizophrenia. Harv Rev Psychiatry 2001; 9(3): 89104.
35. Overall JE, Gorham DR. (1962) The Brief Psychiatric Rating Scale. Psychological Reports, 10, 799-812.
36. Peukens J, Link CGG. A comparison of quetiapine and chlorpromazine in the treatment of schizophrenia. Acta
Psychiatr Scand 1997; 96: 265-273.
37. Peukens J, Risperidone Study Group. Risperidone in the treatment of patients with chronic schizophrenia: a multinational, multi-centre, double-blind, parallel-group study versus haloperidol. Br J Psychiatry 1995; 166: 712-726.
38. Peuskens J, Link CGG. A comparison of quetiapine and chlorpromazine in the treatment of schizophrenia. Acta
Psychiatr Scand 1997; 96: 265-73.
39. Povlsen UU, et al. Tolerability and therapeutic effect of clozapine. Acta Psychiatr Scand 1985; 71: 176-185.
40. Sanger TM, Lieberman JA, Thoen M, Grundy S, Beasley C, Tollefson GD. Olanzapine versus haloperidol treatment
in first-episode psychosis. Am J Psychiatry 1999; 156: 79-87.
41. Simpson GM, Angus JWS. (1970) A rating scale for extrapyramidal side effects. Acta Psichiatrica Scandinavica, 212
(suppl 44), 11-19.
42. Small JG, et al. Quetiapine in patients with schizophrenia. Arch Gen Psychiatry 1997; 54: 549-557.
43. Società Italiana di Psicopatologia. Linee guida per la farmacoterapia della schizofrenia. Giorn Ital Psicopat 2000; 6(3
Suppl): 1-31.
44. Song F. Risperidone in the treatment of schizophrenia: a meta-analysis of randomized controlled trials. J
Psychopharmacol 1997; 11: 65-71.
45. Spivak B, et al. The effect of long-term antipsychotic treatment on the body weight of patients suffering from chronic
schizophrenia: clozapine versus classical antipsychotic agents. Int Clin Psychopharmacol 1999; 14: 229-232.
46. Stahl SM. Selecting an atypical antipsychotic by combining clinical experience with guidelines from clinical trials. J
Clin Psychiatry 1999; 60(Suppl 10): 31-41.
47. Stanton JM. Weight gain associated with neuroleptic medication: a review. Schizophr Bull 1995; 21: 463-472.
48. Tollefson GD, Beasley CM Jr, Tran PV, et al. Olanzapine versus haloperidol in the treatment of schizophrenia and
schizoaffective and schizophreniform disorders: results of an international collaborative trial. Am J Psychiatry
1997;154: 457-65.
49. Tollefson GD, et al. Olanzapine versus haloperidol in the treatment of schizophrenia and schizoaffective and
schizophreniform disorders: results of an international collaborative trial. Am J Psychiatry 1997; 154: 457-465.
50. Tran PV, et al. Double-blind comparison of olanzapine versus risperidone in the treatment of schizophrenia and
other psychotic disorders. J Clin Psychopharmacol 1997; 17: 407-418.
51. Tran PV, et al. Olanzapine versus haloperidol in the treatment of schizoaffective disorder. Br J Psychiatry 1999; 174:
15-22.
52. Tran PV, Hamilton SH, Kuntz AJ, et al. Double-blind comparison of olanzapine versus risperidone in the treatment
of schizophrenia and other psychotic disorders. J Clin Psychopharmacol 1997; 17: 407-18.
53. Treatment of schizophrenia 1999: the expert consensus guideline series. J Clin Psychiatry 1999; 60(Suppl 11): 380.
54. Wetterlin T. Bodyweight gain with atypical antipsychotics. A comparative review. Drug Safety 2001; 24: 59-73.
55. Williams R, Phil M. Optimal dosing with risperidone: updated recommendations. J Clin Psychiatry 2001; 62(4): 2829.
56. Wirshing DA, et al. Novel antipsychotics : comparison of weight gain liabilities. J Clin Psychiatry 1999; 60: 358-363.
7