SISTEMA INTERNAZIONALE
IL SISTEMA INTERNAZIONALE CLASSIFICA LE GRANDEZZE E LE RISPETTIVE UNITA' DI MISURA
LE GRANDEZZE VENGONO SUDDIVISE IN:
GRANDEZZE FONDAMENTALI
Grandezza
Unità di misura
Massa
Kg (chilogrammo)
Tempo
S (secondo)
Lunghezza
m (metro)
Quantità di materia
GRANDEZZE DERIVATE
Grandezza
Unità di misura
Area
m2 (metro quadro)
Volume
m3 (metro cubo)
Densità
Kg/m3 (chilogrammo su
metro cubo)
mol (moli)
GRANDEZZE INTENSIVE
NON dipendono dalle dimensioni del campione
GRANDEZZE ESTENSIVE
Dipendono dalla dimensioni del campione
ESEMPIO DI GRANDEZZA INTENSIVA
E' LA DENSITA'
ESEMPIO DI GRANDEZZA ESTENSIVA
E' IL VOLUME
LA DENSITA'
La densità si definisce come il numero di particelle di composto contenute in un determinato volume.
questo significa che
più è alto il numero di particelle maggiore è la densità
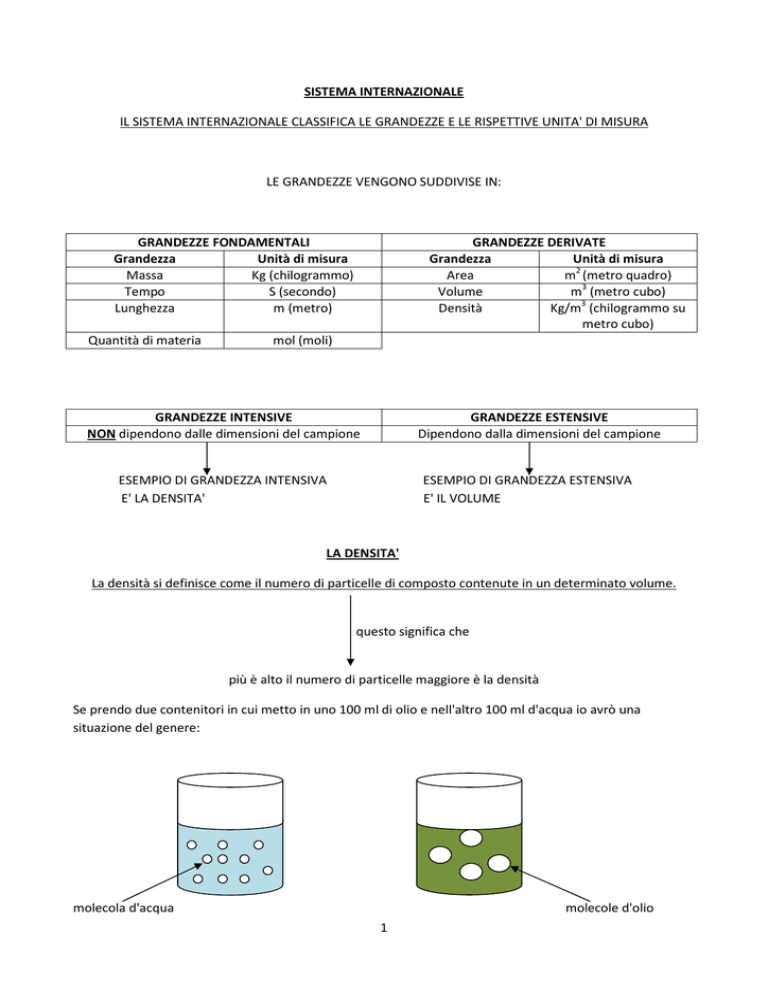
Se prendo due contenitori in cui metto in uno 100 ml di olio e nell'altro 100 ml d'acqua io avrò una
situazione del genere:
molecola d'acqua
molecole d'olio
1
come si può vedere le molecole d'acqua sono un numero maggiore di quelle d'olio questo significa che
l'olio è meno denso dell'acqua
La densità di una sostanza può essere determinata mediante una formula:
d = densità
m = massa
V =volume
esempio:
Una sostanza ha una massa di 12 Kg e occupa un volume di 10 l (litri) calcola la densità di tale sostanza
per risolvere questo problema devi seguire i seguenti passaggi:
1) scrivere la formula per calcolare la densità
2) individuare nei dati del problema quanto vale la massa e quanto il volume
m = 12 Kg
V = 10 l (litri)
3) sostituire nella formula per calcolare la densità al posto di m e V i valori corrispondenti
= 1,2 Kg/l (chilogrammo su litro)
ESERCIZI
1) SCRIVI LA DEFINIZIONE DI SISTEMA INTERNAZIONALE
2) FAI DUE ESEMPI DI GRANDEZZE FONDAMENTALI E DUE DI GRANDEZZE DERIVATE E SCRIVI ACCANTO LA
RISPETTIVA UNITA' DI MISURA
3) SCRIVI LA DEFINIZIONE DI DENSITA'
4) CALCOLA LA DENSITA' DI UNA SOSTANZA CHE HA MASSA DI 50 Kg E OCCUPA UN VOLUME DI 20 l (LITRI)
5) CALCOLA LA DENSITA' DI UNA SOSTANZA CHE HA MASSA DI 98.56 Kg E OCCUPA UN VOLUME DI 23.1 l
(LITRI)
2
LA MATERIA
La materia è tutto ciò che ci circonda che ha una massa e occupa uno spazio. Gli stati fisici della materia
sono tre SOLIDO, LIQUIDO E GASSOSO.
PASSAGGI DI STATO
In chimica la materia si definisce anche sostanza e si divide in:
SOSTANZA PURA: cioè costituita da un solo tipo di elemento chimico
MISCUGLI: sostanza formata da più tipi di elementi chimici
i miscugli a loro volta sono suddivisi in:
MISCUGLI ETEROGENEI: cioè costituiti da due o più sostanze messe insieme ma che non si mischiano tra di
loro (Esempio: ACQUA E OLIO; ACQUA E SABBIA) si dice formati da due o più FASI
MISCUGLI OMOGENEI: cioè costituiti da due o più sostanze messe insieme che si mischiano tra loro
(Esempio: ACQUA E SALE; ACQUA E ZUCCHERO; VINO) si dice formati da una sola FASE
La FASE in chimica individua UNA PORZIONE DI MATERIA FISICAMENTE DISTINGUIBILE CHE HA UN VOLUME
DEFINITO, LE CUI MOLECOLE O ATOMI CHE LA COSTITUISCONO HANNO LE STESSE PROPRIETA'.
FASE
FASE
3
I miscugli omogenei sono chiamati SOLUZIONI.
Le SOLUZIONI sono formate da una parte chiamata SOLUTO e dall'altra chiamata SOLVENTE.
Il SOLUTO è la sostanza che si trova in minore quantità all'interno della soluzione
Il SOLVENTE è la sostanza che si trova in maggiore quantità all'interno della soluzione
Il solvente scioglie il soluto
Le soluzioni quindi sono formate da un soluto e un solvente.
La quantità di soluto che si trova all'interno di una soluzione è definita CONCENTRAZIONE DELLA
SOLUZIONE.
Vi sono più formule matematiche per determinare la concentrazione di una soluzione, quella che
prenderemo in considerazione è la formula che ci permette di determinare il volume di soluto presente
all'interno di una soluzione che viene chiamato PERCENTO IN VOLUME:
V(soluto) = volume di soluto in millilitri (ml)
V(solvente) = volume di solvente in millilitri (ml)
esempio
Una soluzione è preparata sciogliendo 80 ml di alcool etilico in sufficiente acqua per avere 250 ml di
soluzione. Quale è il percento in volume di alcool nella soluzione?
1) Si individuano nel testo il volume del soluto e quello della soluzione. Il volume del soluto è sempre quello
più piccolo, in questo caso 24 ml, il volume della soluzione è sempre quello più grande, in questo caso 250
ml.
2) si sostituiscono nella formula per calcolare il percento in volume, in questo caso si ha:
ESERCIZI
1) COSA E' UN MISCUGLIO OMOGENEO?
2) COSA SI INTENDE PER FASE?
3) DA COSA SONO COSTITUITE LE SOLUZIONI?
4) DAI LA DEFINIZIONE DI MATERIA
5)UNA SOLUZIONE E' PREPARATRA AGGIUNGENDO 40 ml DI ALCCOL ETILICO A SUFFICIENTE ACQUA PER
AVERE 150 ml DI SOLUZIONE. QUALE E' IL PERCENTO IN VOLUME DI ALCOOL ETILICO NELLA SOLUZIONE?
4
ELEMENTI, MOLECOLE E COMPOSTI
ELEMENTI : sono la parte più piccola della materia chimica (sostanza), ciascun elemento è formato da un
atomo con determinate caratteristiche chimiche. Gli elementi sono tutti classificati nella TAVOLA
PERIODICA DEGLI ELEMENTI e sono indicati con l'iniziale del proprio nome latino.
il nome in latino del potassio è KALIUM e il simbolo nella tavola periodica è K
MOLECOLE: derivano dall'unione di due o più atomi dello stesso tipo, ad esempio l'ossigeno (che viene
indicato con la lettera O) in natura non si trova come singolo atomo ma unito con un'altro atomo di
ossigeno (O-O) cioè due atomi di ossigeno legati insieme o ancora più precisamente una molecola di
ossigeno e si indica mettendo un numerino in basso a destra del simbolo dell'elemento che indica quanti
elementi uguali sono uniti tra loro per formare la molecola.
Es.
La molecola di ossigeno è formata da due atomi di ossigeno legati insieme e si indica O2
La molecola dell'azoto (che nella tavola periodica è indicato con la lettera N) è formata da due atomi di
azoto legati insieme e si indica N2
La molecola dell'ozono è formata da tre atomi di ossigeno legati insieme e si indica con O3
COMPOSTI: derivano dall'unione di due o più elementi diversi. Nel linguaggio scientifico anche i composti
si chiamano molecole (non si dice un composto d'acqua ma una molecola d'acqua).
5
Es.
L'acqua è un composto perché e formata da due atomi di idrogeno e uno di ossigeno H2O (il numerino in
basso a destra del simbolo dell'elemento chimico indica quanti atomi di quell'elemento sono presenti, se in
basso a desta del simbolo chimico non viene indicato nessun numero significa che è presente solo un
atomo di quell'elemento).
H2 O
due atomi di idrogeno
un atomo di ossigeno
RAPPRESENTAZIONE DEGLI ELEMENTI MOLECOLE E COMPOSTI
Gli elementi si rappresentano con il simbolo corrispondente al nome (tutti i simboli degli elementi con i
rispettivi nomi sono scritti nella tavola periodica degli elementi)
Le molecole sono indicate con il simbolo dell'elemento da cui sono formate e in basso a destra del simbolo
dell'elemento si indica il numero di atomi dell'elemento che forma la molecola. Tale numero prende il
nome di INDICE STECHIOMETRICO.
O2
simbolo dell'elemento
che costituisce la molecola
indice stechiometrico
L' indice stechiometrico indica il numero di atomi dell'elemento che costituiscono la molecola
I composti sono indicati con i simboli degli elementi che le compongono e i rispettivi indici stechiometrici
(come nelle molecole ma in questo caso i simboli degli elementi sono più di uno in quanto i composti sono
costituiti da elementi diversi). Se ci sono più composti dello stesso tipo questi si indicano mettendo un
numero davanti alla formula.
Es.
Se sono presenti due molecole d'acqua si scrive 2H2O
se sono presenti 3 molecole di anidride carbonica si scrive 3CO2
Il numeri scritto davanti alla formula del composto si chiama COEFFICIENTE STECHIOMETRICO
3CO2
coefficiente stechiometrico
QUESTE RAPPRESENTAZIONI PRENDONO IL NOME DI FORMULE CHIMICHE
6
GLI ELEMENTI NELLA TAVOLA PERIODICA
Tutti gli elementi chimici che si trovano in natura sono rappresentati nella tavola periodica degli elementi.
La struttura della tavola periodica, cioè la posizione che occupano gli elementi nella tavola periodica, è ben
precisa in funzione delle loro caratteristiche. Una prima divisione viene fatta tra METALLI, NON METALLI E
SEMIMETALLI.
TUTTI QUELLI CHE SI TROVANO NELLA PARTE
SINISTRA DELLA TAVOLA PERIODICA SONO METALLI
GLI ELEMENTI CHE SI TROVANO A CAVALLO
DELLA LINEA GIALLA SONO SEMIMETALLI
GLI ELEMENTI CHE SI
TROVANO NELLA PARTE
DESTRA DELLA TAVOLA
PERIODICA SONO NON
METALLI
CARATTERISTICHE DEGLI ELEMENTI (METALLI, NON METALLI E SEMIMETALLI)
METALLI
SEMIMETALLI
Si trovano tutti allo stato solido Si trovano tutti allo stato solido
tranne il mercurio che è liquido
NON METALLI
Si trovano per la maggior parte
allo stato solido e gassoso tranne
il bromo che è liquido
Sono ottimi conduttori sia di Sono conduttori sia di calore che Non sono conduttori ne di calore
di elettricità solo in alcune ne di elettricità
calore che di elettricità
condizioni
Sono duttili (resistenti a forze
come trazione e compressione) e
malleabili (si possono lavorare
senza provocarne la rottura)
Sono poco duttili (resistenti a
forze
come
trazione
e
compressione) e poco malleabili
(si possono lavorare senza
provocarne la rottura)
7
Non sono duttili (resistenti a
forze
come
trazione
e
compressione) ne malleabili (si
possono
lavorare
senza
provocarne la rottura)
LE REAZIONI CHIMICHE
Le reazioni chimiche o trasformazioni chimiche cambiamo la conformazione atomico-molecolare della
materia. Questo vuol dire, in linea generale, che si parte da una materia formata da alcune molecole e
dopo che è avvenuta la reazione chimica si arriva a una materia formata da molecole completamente
differenti.
La reazione chimica in generale può essere schematizzata in questo mode:
A+B
C +D
materia di partenza formata da
due diverse molecole A e B (le
lettere indicano due molecole
qualsiasi)
materia di arrivo formata da
due diverse molecole C e D (le
lettere indicano due molecole
qualsiasi)
le molecole di partenza sono
chiamate REAGENTI
le molecole di arrivo sono
chiamate PRODOTTI
Possiamo quindi concludere che una reazione chimica parte dai REAGENTI per formare i PRODOTTI.
Inoltre i REAGENTI e i PRODOTTI sono formati da molecole con struttura completamente diversa e con
proprietà completamente diverse.
STRUTTURA DELL'ATOMO
L'atomo è formato da tre tipi di particelle: PROTONO, NEUTRONI ed ELETTRONI, queste tre particelle
prendono il nome do particelle subatomiche cioè più piccole dell'atomo.
PROTONI
NEUTRONI
ELETTRONI
Protoni e neutroni hanno masse simili e si trovano in una zona molto Gli elettroni hanno una massa
molto piccola tanto da poter
piccola e molto densa al centro dell'atomo chiamata NUCLEO
essere considerata trascurabile
rispetto a quelle dei protoni e
neutroni. Gli elettroni si muovono
intorno al nucleo con orbite ben
definite
I
protoni
sono
positivamente (+)
carichi I neutroni non hanno carica, si Gli elettroni
dice quindi che sono neutri
negativa (-)
8
hanno
carica
NUMERO ATOMICO E NUMERO DI MASSA
NUMERO ATOMICO: si indica con la lettera Z ed esprime il numero di protoni presenti nell'atomo
Il numero atomico, cioè il numero di protoni presenti nell'atomo, si scrive in basso a sinistra del simbolo
dell'elemento.
Es.
6C
indica che l'atomo di carbonio ha numero atomico 6 cioè ha 6 protoni.
Quando gli elementi sono neutri cioè il numero di protoni e quello degli elettroni sono uguali il numero
atomico oltre ad indicare il numero di protoni esprime anche quello degli elettroni presenti nell'atomo.
Quindi 6C indica che il carbonio ha 6 protoni e 6 elettroni.
NB. Nella tavola periodica degli elementi è indicato il numero atomico di ogni elemento in alto a sinistra del
quadratino dove è scritto il simbolo dell'elemento.
numero atomico
Come si può vedere osservando la tavola periodica tutti gli elementi sono ordinati orizzontalmente in base
al numero atomico crescente. Quindi si può concludere che gli elementi nella tavola periodica sono ordinati
in base:
9
1. alle proprie caratteristiche di metalli, semimetalli e non metalli
2. al loro numero atomico cioè al numero di protoni presenti nell'atomo.
NUMERO DI MASSA: si indica con la lettera A ed esprime il risultato della somma del numero dei neutroni
e dei protoni presenti nell'atomo.
Il numero di massa, cioè il risultato della somma dei protoni e dei neutroni, si scrive in alto a sinistra del
simbolo dell'elemento.
Es.
12
C
indica che la somma tra il numero dei protoni e quella dei neutroni presenti nell'atomo di carbonio (C) è 12.
Per determinare il numero di neutroni (il numero di neutroni si indica con la lettera N) presenti nell'atomo
di un elemento chimico basta fare la differenza tra il numero di massa e il numero atomico:
Es.
Determinare il numero di neutroni che si trovano nel seguente elemento
numero di massa ( protoni + neutroni) A
numero atomico (protoni) Z
il numero di neutroni (N) si ricava dalla differenza tra il numero di massa e il numero atomico:
N = A - Z =63-29 =34 il numero di neutroni presenti nell'atomo di rame (Cu) è 34
GLI ISOTOPI
Gli ISOTOPI sono atomi dello stesso elemento che hanno un numero differente di neutroni
Es.
L'atomo di idrogeno (H) può avere nel nucleo solo un protone, un protone e un neutrone oppure un
protone e due neutroni. Questi tre atomi sono isotopi dello stesso elemento cioè dell'idrogeno e si
chiamano Deuterio e Trizio.
10
IDROGENO
DEUTERIO
TRIZIO
IL NUCLEO DELL'ATOMO E' IL NUCLEO DELL'ATOMO E' IL NUCLEO DELL'ATOMO E'
FORMATO
SOLO
DA
UN FORMATO DA UN PROTONE E UN FORMATO DA UN PROTONE E
PROTONE
NEUTRONE
DUE NEUTRONI
IL NUMEO ATOMICO
NUMERO DI MASSA
UGUALI A 1
E IL IL NUMERO ATOMICO VALE 1 MA IL NUMERO ATOMICO VALE 1 MA
SONO IL NUMERO DI MASSA VALE 2
IL NUMERO DI MASSA VALE 3
A=2
Z=1
A=3
Z=1
A=1 Z=1
N= A-Z = 1-1 =0
N= A-Z = 2-1 =1
N= A-Z = 3-1 =2
Significa che nel nucleo non sono
presenti neutroni
Significa che nel nucleo è
presente un solo neutrone
Significa che nel nucleo sono
presenti due neutroni
P =protoni
e = elettroni
P =protoni
n = neutroni
e = elettroni
P =protoni
n = neutroni
e = elettroni
MASSA ATOMICA (M.A.)
La massa di ogni singolo elemento chimico viene chiamata massa atomica e si abbrevia con M.A., essa è
riportata nella tavola periodica degli elementi ed è calcolata facendo la media delle masse di tutti gli isotopi
dell'elemento preso in considerazione.
11
massa atomica
La massa atomica è troppo piccola per essere espressa in grammi (g), quindi si adopera un'altra unità di
misura: UNITA' DI MASSA ATOMICA (SI ESPRIME CON IL SIMBOLO u).
Quindi possiamo dire che il Litio (Li) ha una massa atomica di 6.941 u, l'idrogeno ha una massa atomica di
1.00794 u e così via.
MASSA MOLECOLARE (M.M.)
La massa molecolare è la somma delle masse di tutti gli elementi che costituiscono una molecola o un
composto e si abbrevia con M.M.
Es.
la massa molecolare dell'acqua che ha formula chimica H2O si calcola seguendo questo procedimento:
1. Dalla formula chimica della molecola si determinano gli elementi che la compongono, nel caso
dell'acqua sono idrogeno (H) e ossigeno (O)
2. Si ricavano le masse atomiche di ogni singolo elemento dalla tavola periodica
M.A. (H) = 1.0079 u
M.A. (O) = 15.9994 u
3. Si moltiplica la massa di ogni elemento per l'indice stechiometrico indicato nella formula chimica, in
questo caso l'indice stechiometrico dell' H è 2 mentre quello dell'O è 1 poi si sommano.
(H) = 1.0079 x 2 = 2.0158 u
(O) = 15.9994 x 1 = 15.9994 u
M.M. (H2O) = 2.0158 + 15.9994 = 18.058 u (questa è la massa molecolare dell'acqua)
GLI IONI
Gli atomi degli elementi sono formati come abbiamo detto da tre particelle: protoni, neutroni ed elettroni.
I protoni sono carichi positivamente (+), gli elettroni sono carichi negativamente (-) mentre i neutroni non
hanno carica.
12
Tutti gli atomi degli elementi che si trovano in natura, se non soggetti a trasformazione chimica, hanno lo
stesso numero di protoni ed elettroni, e siccome queste due particelle hanno cariche opposte (cioè i
protoni ( +) e i neutroni ( -)) se si sommano tutte le cariche all'interno dell'atomo il risultato è uguale a
zero, si dice allora che l'atomo è NEUTRO.
Nel caso in cui il numero di elettroni e protoni sono diversi, si dice che l'atomo è in forma ionica o meglio è
uno IONE.
Gli ioni si dividono in:
ANIONI nel caso in cui gli elettroni sono in numero maggiore rispetto ai protoni, quindi se si sommano
le cariche positive e quelle negative presenti nell'atomo si avrà un valore negativo o meglio uno IONE
NEGATIVO
CATIONI nel caso in cui gli elettroni sono in numero minore rispetto ai protoni quindi se si sommano le
cariche positive e quelle negative presenti nell'atomo si avrà un valore positivo o meglio uno IONE
POSITIVO
Possiamo riassumere gli ioni con questo schema:
IONE
CARICO NEGATIVAMENTE
CARICO POSITIVAMENTE
ANIONE
CATIONE
Per determinare il numero di protoni (P), neutroni (N) ed elettroni (e-) di un anione o di un catione si deve
ragionare in questo modo:
Una volta noto l'elemento chimico es. Na (sodio) si determina il numero atomico (dalla tavola periodica) e il
numero di massa che è un dato dell'esercizio.
Per determinare il numero dei protoni e neutroni si procede come nel caso dell'esercizio precedente,
quando cioè l'atomo è neutro.
Per determinare il numero di elettroni si procede in questo modo:
Nel caso dell'ANIONE si aggiunge al numero atomico tante unità quanti sono i meno scritti in alto a destra
del simbolo dell'elemento chimico.
Nel caso di un CATIONE si sottraggono al numero atomico tante unità quanti sono i più scritti in alto a
destra del simbolo dell'elemento chimico.
13
ANIONE
S2-
CATIONE
Na+
Z=16 A=32
Z=11 A=23
P = 16
P = 11
N =32 - 16 = 16
N =23 - 11 = 12
e- = 16-2=18
e- = 11-1=10
ESERCIZI :
1) QUALE E' LA DIFFERENZA TRA ELEMENTI, MOLECOLE E COMPOSTI?
2) DOVE SONO CLASSIFICATI TUTTI GLI ELEMENTI ESISTENTI IN NATURA?
3) COME VENGONO SUDDIVISI GLI ELEMENTI NELLA TAVOLA PERIODICA?
4) DOVE SI TROVANO NELLA TAVOLA PERIODICA I METALLI, I SEMIMETALLI E I NON METALLI?
5) QUALI SONO LE PARTICELLE CHE COSTITUISCI L'ATOMO?
6) QUALI SONO LE CARICHE DELLE PARTICELLE CHE COSTITUISCONO L'ATOMO?
7) QUALE PATICELLE CHE COSTITUISCONO L'ATOMO HANNO MASSE SIMILI?
8) DOVE SI TROVANO NELL'ATOMO I PROTONI E I NEUTRONI?
9) DOVE SI TROVANO NELL'ATOMO GLI ELETTRONI?
10) COSA INDICA IL NUMERO DI MASSA?
11) COSA INDICA IL NUMERO ATOMICO?
12) SCRIVI AFFIANCO AD OGNI ELEMENTO CHIMICO SOTTO INDICATO IL NUMERO DI PROTONI , DI
NEUTRONI E IL NOME DEL COPMPOSTO (USA LA TAVOLA PERIODICA)
13) COSA SONO GLI IONI?
14) COSA INDICA L'INDICE STECHIOMETRICO?
15) COSA INDICA IL COEFFICIENTE STECHIOMETRICO?
16) QUALE E' LA DIFFERENZA TRA ANIONI E CATIONI?
14
17) DETERMINA LA MASSA MOLECOLARE DEI SEGUENTI COMPOSTI E SCRIVI QUALE E' L'INDICE
STECHIOMETRICO DI OGNI SINGOLO ELEMENTO CHE COSTITUISCE IL COMPOSTO
H2O , NO3, HBr, H2SO4, HNO3
18) COME E' STATA CALCOLA LA MASSA ATOMICA DEGLI ELEMENTI INDICATA NELLA TAVOLA PERIODICA?
CONFIGURAZIONE ELETTRONICA
In generale la configurazione elettronica indica come sono posizionati gli elettroni intorno al nucleo di un
atomo.
ORBITA : Zona intorno al nucleo di diversa energia dove ruotano gli elettroni.
L'energia delle varie orbite è riportata in un grafico energetico. I punti del grafico che indicano l'energia
delle orbite vengono chiamati LIVELLI ENERGETICI PRINCIPALI (ad ogni orbita è associato un livello
energetico)
LIVELLI ENERGETICI
PRINCIPALI
E4
n=4
E3
n=3
E2
n=2
E1
n=1
BOHR Studiò le orbite e la loro energia ed introdusse il numero quantico principale (n). Il numero quantico
principale classifica le orbite. (prima orbita n=1, seconda orbita n=2; e così via)
ORBITALE: zone dell'orbita dove è più probabile trovare gli elettroni. Si classificano con le lettere s,p,d,f e
ciascuno ha una forma propria dalla quale deriva il numero di orientazioni che possiede ciascun orbitale.
L'orientazione è la forma che un orbitale può assumere nello spazio in finzione della posizione.
15
ORBITALE
NUMERO DI ORIENTAZIONI
s
1
p
3
d
5
f
7
Ciascun orbitale appartenente ad una certa orbita possiede una propria energia che può essere indicata nel
grafico energetico, usato precedentemente per indicare l'energia delle orbite. I punti che nel grafico
indicano l'energia degli orbitali prendono il nome di SOTTOLIVELLI ENERGETICI.
SOTTOLIVELLI ENERGETICI
LIVELLI ENERGETICI
PRINCIPALI
16
Per indicare in quale orbita è posizionato un determinato orbitale si usa scrivere davanti alla lettera che
identifica l'orbitale il numero quantico dell'orbita in cui esso si trova.
ESEMPIO
1s indica l'orbitale s che si trova nella prima orbita ( la prima orbita è caratterizzata dal numero
quantico n=1)
2p indica l'orbitale p che si trova nella seconda orbita ( la seconda orbita è caratterizzata dal
numero quantico n=2)
Se si osserva il grafico energetico riportato a pag. 16 si nota che a ciascun livello energetico principale sono
associati un certo numero di sottolivelli (equivale a dire che all'interno di ciascuna orbita ci sono un certo
numero di orbitali). Se si osserva con attenzione si può vedere che il numero di orbitali che si trovano
all'interno di ciascuna orbita corrisponde al valore del numero quantico principale che caratterizza
quell'orbita.
ESEMPIO
La prima orbita è caratterizzata dal numero quantico principale n=1 questo significa che al suo interno ha
un solo orbitale, cioè il primo (s). Che indicherò come 1s
La seconda orbita è caratterizzata dal numero quantico principale n=2 questo significa che al suo interno ha
due orbitali, cioè il primo (s) e il secondo (p) . Che indicherò come 2s e 2p
La terza orbita è caratterizzata dal numero quantico principale n=3 questo significa che al suo interno ha
due orbitali, cioè il primo (s), il secondo (p) e il terzo (d) . Che indicherò come 3s, 3p e 3d
Possiamo concludere che il numero quantico principale oltre a classificare le orbite indica il numero di
orbitali presenti all'interno di ciascuna orbita.
Il grafico energetico può essere completato inserendo anche le varie orientazioni di ciascun orbitale
mediante dei quadratini. Avremo un grafico dal quale si può ottenere un numero di informazioni maggiori
con le quali è possibile completare la configurazione elettronica. Ogni orientazione di un orbitale viene
rappresentata mediante un quadrato. Avremo quindi che l'orbitale s sarà sempre rappresentato da un
quadrato, l'orbitale p da tre quadrati, l'orbitale d da cinque quadrati e quello f da sette quadrati. Il grafico
risultante è il seguente:
17
PRINCIPIO DI ESCLUSIONE DI PAULING
Indica come si dispongono gli elettroni nei vari orbitali, possiamo riassumerlo con tre punti:
1) Gli elettroni occupano gli orbitali in ordine crescente di energia (questo vuol dire che prima occuperanno
l'orbitale 1s poi il 2s, poi il 2p e così via)
2) In una orientazione di un orbitale non possono esserci più di due elettroni e questi devono avere SPIN
opposto
3) Se gli elettroni hanno a disposizione più orientazioni dello stesso orbitale, si dispongono uno per ciascuna
orientazione con SPIN orario, quindi gli elettroni successivi si accoppiano con quelli già presenti con SPIN
antiorario. (Se un elettrone si trova da solo in una orientazione quest'ultimo avrà sempre SPIN orario)
SPIN : Verso di rotazione dell'elettrone intorno al proprio asse.
SPIN ORARIO O
POSITIVO (+)
SPIN ANTIORARIO O
NEGATIVO (-)
Quando due elettroni hanno lo stesso SPIN (cioè ruotano entrambi nello stesso verso: entrambi in senso
orario e entrambi in senso antiorario) si dice che possiedono SPIN PARALLELO
Quando due elettroni hanno diverso SPIN (cioè ruotano uno in senso orario e l'altro in senso antiorario) si
dice che possiedono SPIN OPPOSTO.
Per rappresentare nel grafico gli elettroni si usano delle frecce :
Indica un elettrone che ha spin orario
Indica un elettrone che ha spin antiorariorario
18
Si hanno ora tutte le informazioni per scrivere la configurazione elettronica degli elementi chimici mediante
grafico energetico (a quadratini).
Vediamo quali sono i passaggi da effettuare per scrivere la configurazione elettronica del Na (sodio).
1) Una volta noto l'elemento chimico di cui si deve scrivere la configurazione elettronica si deve
determinare il numero atomica Z (dalla tavola periodica)
Na Z=11
2) Osservare se si tratta di una atomo neutro, un anione o un catione. Se l'atomo è neutro il numero
atomico indica sia il numero di protoni che quello degli elettroni, se è un catione significa che possiede
meno elettroni rispetto ai protoni se invece è un anione significa che ha più elettroni rispetto ai protoni.
3) Nel nostro caso il Na è neutro quindi Z indica sia il numero di protoni che quello degli elettroni. A noi
interessa in questo caso il numero degli elettroni cioè 11.
4) Per posizionare gli undici elettroni nei vari orbitali si deve seguire quanto detto dal principio di esclusione
di Pauling si avrà:
E3
3s
2p
E2
2s
E1
1s
Un altro modo per scrivere la configurazione elettronica è la forma estesa (nello stesso modo in cui è
riportata sulla tavola periodica.
Prendiamo a esempio la configurazione elettronica del Na scritta sopra con il grafico energetico, per
indicare i due elettroni che si trovano nell'orbitale 1s mettiamo un esponente alla lettera s che indica il
numero di elettroni contenuti nell'orbitale cioè 1s2. Si legge in questo modo: nell'orbitale s della prima
orbita sono presenti due elettroni.
In definitiva la configurazione elettronica scritta in forma estesa del Na (sodio) sarà quindi :
1s2 2s2 2p6 3s1
ESERCIZI
19
1) COSA SONO LE ORBITE?
2) COSA IMDICA IL NUMERO QUANTICO PRINCIPALE?
3) COSA SONO GLI ORBITALI?
4) COSA SONO I LIVELLI ENERGETICI PRINCIPALI?
5) COSA SONO I SOTTOLIVELLI ENERGETICI PRINCIPALI?
6) DETERMINA IL NUMERO DI PROTONI, NEUTRONI ED ELETTRONI DEI SEGUENTI ELEMENTI O IONI:
Cu+ (A = 38) ; Be2+ ( A=6); Br (A = 46); S2- (A=26); Cl- (A=65); Cr (A=36)
7) SCRIVERE LA CONFIGURAZIONE ELETTRONICA DEGLI ELEMENTIO DELL'ESERCIZIO 6 SIA IN FORMA ESTESA
CHE CON IL GRAFICO ENERGETICO
8) SCRIVERE IL PRINCIPIO DI ESCLUSIONE DI PAULING
9) CHE COSA SI INTENDE PER SPIN?
10) COME VENGONO CLASSIFICATI GLI ORBITALI E QUANTE ORIENTAZIONI HANNO?
20












