DEGENERAZIONE MACULARE SENILE
La degenerazione maculare senile è ad oggi nei Paesi Occidentali, la principale causa di
abbassamento progressivo ed irreversibile della capacità visiva nelle persone con più di 60 anni di
età.
E’ una patologia progressiva ed indolore correlata principalmente all’età e con l’avanzare di questa,
aumenta il rischio di contrarre la malattia.
E’ stata individuata alla fine dell’800, ma soltanto negli ultimi decenni il miglioramento delle
tecniche diagnostiche ha permesso di individuarne precocemente i quadri clinici.
Nella fase iniziale della degenerazione maculare senile possono non presentarsi sintomi particolari o
addirittura può ancora essere conservata una buona acutezza visiva, è per questo che gli sforzi
attuali dell’oftalmologia mirano al riconoscimento tempestivo delle lesione retiniche iniziali.
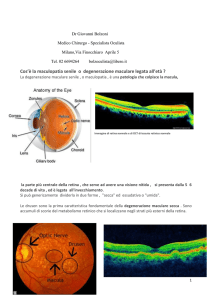
Cos’è la degenerazione maculare senile
La degenerazione maculare senile è un’alterazione progressiva della regione centrale del tessuto
retinico, la macula che è la porzione più importante e sensibile della retina in quanto fornisce una
visione centrale nitida che concorre alla concretizzazione dell’acuità visiva.
Un’alterazione a questo livello quindi, porta pian piano alla perdita di una visione precisa e nitida
per cui iniziano le difficoltà a riconoscere un volto, a distinguere i colori e le parole scritte.
Sebbene raramente questa patologia si evolva in cecità completa, le persone affette lamenteranno
difficoltà nello svolgimento di banali attività quotidiane, quali leggere, scrivere, guidare
l’automobile, …
Sono stati classificati due principali tipi di degenerazione maculare senile: la forma secca o atrofica
e la forma umida o essudativa o neovascolare.
La forma secca è il tipo più comune di degenerazione maculare senile (circa l’ 80% dei casi):
generalmente causa una moderata riduzione visiva ed è dovuta ad una lenta e progressiva atrofia del
tessuto retinico maculare (nello specifico dell’epitelio pigmentato e dei fotorecettori).
Meno comune (circa il 20% dei casi) ma più grave, responsabile infatti dalla stragrande
maggioranza dei casi di grave calo visivo per maculopatia, è invece la forma essudativa.
Tale forma è associata allo sviluppo di nuovi vasi, particolarmente deboli, che si rompono
facilmente comportando la perdita di siero e di sangue o che, modificando il tessuto circostante,
provocano fenomeni di cicatrizzazione e distruggono la macula.
L'evoluzione solitamente è molto lenta nelle forme non essudative, più rapida invece nelle forme
essudative.
Quali sono le cause
I motivi scientifici veri e propri che determinano il deterioramento e la degenerazione del tessuto
maculare retinico non sono ancora pienamente conosciuti.
E’ infatti più corretto parlare di fattori di rischio piuttosto che di cause in riferimento alla
degenerazione maculare senile, ed in particolar modo si presuppone sia la combinazione di alcuni
fattori ad esporre maggiormente al pericolo di contrarre la malattia.
Tra i fattori di rischio più noti il principale è l’età, vi sono inoltre la dieta e l’alimentazione,
soprattutto se costituita da un apporto dietetico elevato di grassi saturi, di colesterolo o di sostanze
alcoliche, il fumo, la luce solare, soprattutto se ci si espone per un periodo prolungato alla luce
ultravioletta.
L’ereditarietà, sebbene la degenerazione maculare senile non sia ereditaria alcuni studi indicano che
si può avere un rischio maggiore di sviluppare tale patologia se uno o più parenti prossimi ne
soffrono, ed infine un altro importante fattore di rischio è riconosciuto dall’ipertensione arteriosa e
da malattie cardiache , a causa della ridotta circolazione sanguigna a livello oculare.
Ovviamente non è possibile cambiare la propria età, il proprio sesso o il proprio albero genealogico,
ma per proteggere i propri occhi dai suddetti fattori di rischio si potrebbero adottare alcune semplici
precauzioni e/o abitudini, quali portare occhiali da sole quando ci si espone a sorgenti di luce
ultravioletta, indossare cappelli con visiera per proteggere gli occhi dai raggi del sole diretti o
riflessi, seguire una dieta ricca di frutta e di verdura, limitare i grassi saturi ed il colesterolo nella
propria dieta, cercare di mantenere la pressione sanguigna nei limiti consigliati, limitare
l'assunzione di alcool e soprattutto, dal momento che rimane comunque molto importante la
diagnosi precoce, sottoporsi a visita oculistica almeno una volta ogni 1, massimo 2 anni.
Quali sono i sintomi
A prescindere dal fatto che inizialmente possono non essere presenti sintomi specifici o addirittura
può essere conservata una buona acuità visiva, i sintomi principali della maculopatia senile sono la
riduzione dell’acuità visiva centrale con permanenza di quella periferica, la distorsione delle
immagini (metamorfopsia) per cui ad esempio, una riga dritta appare distorta o incompleta,
l’alterazione della percezione dei colori i quali possono apparire sbiaditi o deboli, la presenza di
un’area del campo visivo, vicina al punto di fissazione o comprendente il punto di fissazione stesso,
in cui la visione non è distinta o addirittura mancante (scotoma).
Bisogna accertarsi però che questi sintomi non siano presenti in entrambi gli occhi, in quanto non
sempre la degenerazione maculare senile colpisce tutte e due gli occhi oppure potrebbe colpirli in
due momenti differenti, quindi è possibile che la buona e corretta capacità visiva di un occhio
nasconda quella patologica sintomatica dell’altro nella visione binoculare d’insieme.
Arrivare alla diagnosi
In presenza di uno di questi sintomi specifici è bene recarsi tempestivamente dallo specialista che
procederà con tutti gli accertamenti del caso. Per l’esame delle maculopatie senili sono a
disposizione svariate metodiche, alcune ormai entrate nella comune pratica clinica da molti anni,
altre di uso corrente solo da poco tempo.
A partire dalla semplice verifica del funzionamento della vista per valutare come ogni occhio lavori
separatamente e come entrambi lavorino insieme al fine di valutare la capacità visiva per vicino e
per lontano, ed al semplice Test della Griglia di Amsler per valutare qualsiasi distorsione o
anomalia della visione, che è anche il modo più facile per monitorare da sé la propria condizione
visiva o la Retinografia, ovvero una fotografia della retina per stabilire un livello di riferimento e
per poter seguire l’evoluzione nel tempo della malattia.
Per arrivare invece, in un secondo tempo, ad esami più complessi quali l’angiografia retinica a
fluorescenza (Fluorangiografia) e la tomografia ottica a radiazione coerente (OCT).
Da diversi anni l’esame basilare per lo studio delle maculopatie è rappresentato dell’angiografia
retinica a fluorescenza classica (Fluorangiografia) che, mediante iniezione endovenosa di
fluoresceina, permette di evidenziare con precisione alterazioni a livello retinico e a livello
vascolare implicate nella maculopatia essudativa.
La fluorangiografia classica però, ha il grosso limite di non poter evidenziare con precisione le
membrane neovascolari più profonde, altrettanto minacciose per il rischio di emorragie; esiste
infatti una più moderna metodica che riesce a superare questo limite, rappresentata dall’angiografia
con verde d’indocianina.
All’angiografia retinica però, negli ultimi anni si è affiancata una nuova tecnica diagnostica non
invasiva detta tomografia ottica a radiazione coerente (OCT).
Si tratta di una complessa metodica in grado di “scannerizzare” tutti gli strati retinici permettendo di
evidenziarne anche piccolissime modificazioni con potere di risoluzione altissimo, superiore a
quello di qualsiasi altra tecnica di imaging fino ad oggi utilizzata. Inoltre, un importante vantaggio
dell’OCT è che si tratta di una metodica innocua, non invasiva, facilmente ripetibile e confrontabile,
di breve esecuzione e quindi ben tollerata dal paziente.
Attualità terapeutiche
Fino a pochissimi anni fa la fotocoagulazione classica con laser ad Argon era quasi l’unico
trattamento possibile, ma l’energia termica di questo tipo di laser comporta l’inevitabile
danneggiamento della retina sovrastante l’area trattata; recentemente infatti la fotocoagulazione
viene effettuata con i cosiddetti laser “freddi” o “intelligenti”, che evitano il danneggiamento diretto
della retina.
Il più diffuso di questi moderni trattamenti è la cosiddetta terapia fotodinamica (PDT), che prevede
l’iniezione endovena di una sostanza fotosensibile detta verteporfirina.
Un’ulteriore recente possibilità terapeutica mediante laser è costituita dalla Terapia Termica
Transpupillare (TTT), che determina un lieve riscaldamento degli strati sottoretinici alterati
risparmiando la retina sovrastante, che inoltre, non richiedendo l’iniezione endovenosa di mezzi di
contrasto, risulta essere un trattamento meno invasivo e maggiormente tollerato dai pazienti.
I trattamenti laser però, seppure consentano di arrestare o per lo meno di rallentare l’evoluzione di
molte forme di degenerazione maculare, solo in pochissimi casi riescono a dare anche un
miglioramento funzionale.
Esistono anche terapie mediche preventive per la degenerazione maculare senile, a base
principalmente di integratori dietetici e complessi polivitaminici ad azione antiossidante, utili
soprattutto nelle forme atrofiche per le quali al momento non sono disponibile altre terapie.
Nei casi invece di grave ipovisione correlata a degenerazione maculare senile evoluta, sono
disponibili ausili ottici ed elettronici in grado di aiutare i pazienti soprattutto nella lettura; l’ottimale
utilizzo di questi sistemi prevede un “allenamento” del paziente che impara a sfruttare al meglio le
aree di retina pericentrali ancora funzionanti.
Si tratta sostanzialmente di sistemi telescopici e di videolettori che, ingrandendo enormemente i
testi scritti, consentono una certa possibilità di lettura.
Esiste infine un’ulteriore possibilità, questa volta dal punto di vista chirurgico, abbinando
l’intervento chirurgico di cataratta all’impianto di un sistema ingrandente composto da un doppio
cristallino artificiale, la IOL Vip (Intra Ocular Lens-Visually Impaired People, lente intraoculare
per persone con deficit visivo).
La presenza di due cristallini artificiali, uno di elevato potere diottrico negativo inserito nel sacco
capsulare, come avviene nella quasi totalità degli interventi di cataratta moderni, ed uno di elevato
potere positivo davanti all’iride, in camera anteriore, crea all’interno dell’occhio una sorta di
sistema telescopico di tipo galileiano che produce un lieve ingrandimento delle immagini prodotte
sulla porzione di retina pericentrale, confinante con quella colpita dalla maculopatia, migliorando la
vista dei pazienti.
Esiste infine, nella degenerazione maculare senile di tipo neovascolare, la possibilità di iniettare dei
farmaci con attività antiangiogenica, cioè in grado di contrastare la formazione di neovasi e
antiedema, cioè atti a bloccare la formazione di liquido, tramite iniezioni intravitreali.
Attualmente è stata data molta importanza a questo gruppo di farmaci in grado di bloccare una
sostanza chiamata VEGF (fattore di crescita vascolare) che provoca la formazione di tali vasi,
farmaci che da soli o in associazione ad altre terapie, possono aumentare la percentuale di successo.
Scopo principale di questo trattamento è fermare e/o rallentare la progressione della malattia.
Farmaci attualmente disponibili per la somministrazione intravitreale
Vi sono tre categorie di farmaci da somministrare all’interno dell’occhio in sede intravitreale:
farmaci “on label”, farmaci “off label”, farmaci “against label”.
Un farmaco si definisce “on label” quando viene utilizzato rispettando le indicazioni riportate sulla
scheda tecnica del prodotto, approvata dalle autorità competenti.
Ad esempio se un collirio antibiotico viene usato per curare una congiuntivite batterica e
somministrato nel sacco congiuntivale, si fa un uso del collirio previsto nella scheda tecnica del
prodotto.
Un farmaco si definisce “off label” quando viene utilizzato in condizioni non previste dalla scheda
tecnica del prodotto.
Ad esempio se lo stesso collirio antibiotico viene somministro nell’orecchio invece che nell’occhio
per curare un’otite catarrale, si fa un uso del prodotto al di fuori delle indicazioni riportate nella
scheda tecnica.
Un farmaco si definisce “against label” quando viene utilizzato nonostante la scheda tecnica riporti
specifiche controindicazioni al suo uso in una determinata patologia o per una determinata via di
somministrazione.
Ad esempio se sempre lo stesso collirio antibiotico venisse somministrato per via endovenosa per il
trattamento di una polmonite.
L’uso “off label” di farmaci è estremamente diffuso in tutte le branche della medicina ed in
particolare in pediatria, in oncologia ed anche in oftalmologia, poiché le evidenze cliniche derivanti
dagli studi pubblicati sulle riviste scientifiche dimostrano che determinati farmaci possono essere
molto utili anche in altre condizioni cliniche oltre a quelle autorizzate dalla scheda tecnica.
Farmaci ON LABEL: Pegaptanib sodico (Macugen), Ranibizumab (Lucentis)
Farmaci OFF LABEL: Bevacizumab (Avastin), Triamcinolone acetonide (IVT)
Farmaci AGAINST LABEL: Triamcinolone acetonide (Kenacort – Triacort – Triamvirgi), che
riportano nella scheda tecnica specifiche controindicazioni alla somministrazione intravitreale.
Caratteristiche dei farmaci
Bevacizumab (Avastin): anche se “off-label” l’AIFA (Agenzia Italiana del Farmaco) ha autorizzato
la sua erogabilità a totale carico del SSN per il trattamento delle maculopatie essudative e del
glaucoma neovascolare, in base alle evidenze derivanti dalla letteratura scientifica.
E’ un anticorpo monoclonale che, estratto dalla cavia, è stato adattato all’uomo, ossia “umanizzato”,
in modo da evitare la risposta del sistema immunitario e che ha dimostrato di possedere spiccate
attività antiangiogeniche, antiedemigene e di arrestare la genesi vascolare.
Le indicazioni della scheda tecnica di questo farmaco prevedono l’utilizzo in terapia oncologica per
bloccare la crescita della rete neovascolare anarchica nell’ambito di forme tumorali metastatiche del
colon-retto.
Le possibili applicazioni “off label” riguardano la terapia delle degenerazioni maculari di tipo
neovascolare, e delle malattie vascolari della retina caratterizzate da una marcata componente
edematosa ed essudativa come la retinopatia diabetica e l’occlusione della vena centrale della retina.
Il Bevacizumab è stato originariamente disegnato e sviluppato per il trattamento del carcinoma del
colon e del retto metastatico per una somministrazione di 5mg/Kg per via endovenosa con
frequenza bisettimanale per un numero di infusioni variabile in base alla risposta clinica.
In ambito oftalmologico viene attualmente utilizzato per via intravitreale a dosaggi molto inferiori e
(1.0, 1.25, 1.5, 2.0 o 2.5 mg) a seconda dei diversi studi riportati in letteratura.
Tali quantità sono somministrate a cadenza mensile e con regimi di somministrazione variabili: una
o tre iniezioni iniziali e successive re-iniezioni sulla base di criteri anatomici e funzionali di
persistenza o recidiva della lesione neovascolare.
Gli eventi avversi più comuni correlati alla via di somministrazione sistemica sono: l’ipertensione
arteriosa (dal 22% al 32%) reversibile nell’84% dei casi mediante terapia anti-ipertensiva, la
proteinuria asintomatica dal 21% al 38% dei pazienti, la sua comparsa non è associata a disfunzione
renale e non preclude la continuazione del trattamento, la sindrome nefrosica è rara ed impone la
sospensione della terapia, la tromboembolia arteriosa: l’incidenza di eventi tromboembolici (ictus
cerebrale, TIA, infarto del miocardio) è simile (18% – 19.4%) a quella riscontrata nei soggetti
trattati con placebo (16.2% – 18.3%). Il rischio è maggiore in pazienti con età superiore a 65 anni o
con un’anamnesi positiva per tromboembolismo arterioso.
Il rallentamento del tempo di cicatrizzazione delle ferite si è riscontrato nei pazienti che erano stati
sottoposti a intervento chirurgico durante il trattamento. La frequenza di emorragie cutanee
(petecchie, ecchimosi) o mucose (epistassi) va dal 3.1% al 5.1%, le perforazioni gastrointestinali:
complicanza rara (1,4% – 2,0%) ma potenzialmente fatale (0.4% – 1.0%).
Gli eventi avversi correlati alla via di somministrazione intravitreale sono presumibilmente meno
importanti. Infatti i pazienti che ricevono il bevacizumab per malattie oculari sono in generale in
uno stato di salute migliore rispetto ai pazienti con tumori del colon-retto metastatico e ricevono
una dose significativamente inferiore che è rilasciata solo all’interno dell’occhio.
Sino a questo momento tuttavia non disponiamo di studi prospettici randomizzati controllati
sull’impiego del bevacizumab in ambito oftalmico. I risultati preliminari delle iniziali serie non
controllate di pazienti affetti da degenerazione maculare legata all’età neovascolare e trattati con
bevacizumab intravitreale concordano nell’indicare un rapido miglioramento anatomo-funzionale
nel breve termine (3 mesi) in assenza di eventi avversi oculari o sistemici di rilievo.
Nell’utilizzo intravitreale riportato in letteratura non sono stati descritti eventi avversi oculari e
sistemici. Non sono conosciuti i rischi oculari legati al farmaco bevacizumab.
Relativamente agli eccipienti utilizzati nella preparazione sistemica, non ci sono ad oggi
segnalazioni di possibile tossicità retinica.
Lo scopo del trattamento è cercare di prevenire un’ ulteriore riduzione della capacità visiva.
Sebbene alcuni pazienti abbiano riscontrato un miglioramento della visione, il farmaco non può
ristabilire la visione già persa e non può garantire la prevenzione di una ulteriore perdita di capacità
visiva.
La somministrazione deve avvenire ad intervalli regolari (circa ogni 4/6 settimane) fin quando lo
stato anatomico e funzionale lo richiedano.
Ranibizumab (Lucentis): è un frammento di un anticorpo monoclonale ricombinante umanizzato
diretto contro il fattore di crescita endoteliale vascolare umano A (VEGF-A).
Esso si lega con un’elevata affinità alle isoforme del VEGF-A (VEGF110, VEGF121 e VEGF165),
prevenendo così il legame del VEGF-A ai suoi recettori VEGFR-1 e VEGFR-2 ed impedendo la
proliferazione delle cellule endoteliali, la neovascolarizzazione, l’aumento della permeabilità
vasale, che si ritiene contribuiscano alla progressione della forma neovascolare della degenerazione
maculare senile.
E’ una molecola più piccola del bevacizumab (Avastin) ed ha una maggiore capacità di penetrare
tutti gli strati della retina e quindi di diffondere nello spazio sottoretinico dopo somministrazione
intravitreale.
L’attività biologica del ranibizumab è stata dimostrata su modelli animali di neovascolarizzazione
coroideale: gli studi di farmacocinetica hanno dimostrato che dopo iniezione intravitreale la
biodisponibilità del ranibizumab è molto elevata (50 – 60%) in quanto il farmaco si distribuisce
rapidamente nella retina e viene eliminato da tutti i compartimenti oculari in circa 3 giorni.
Le concentrazioni del ranibizumab nel plasma sono molto basse, riflettendo una distribuzione più
alta e una clearance più bassa del farmaco nell’occhio.
Tuttavia, non esistono dati disponibili sulla clearance del farmaco dal vitreo umano anche se si può
ipotizzare che potrebbe essere più lenta rispetto a quella degli occhi dei modelli animali a causa del
maggior volume del vitreo umano.
Allo stato attuale delle conoscenze non sono state riscontrate tracce di ranibizumab nel plasma dopo
iniezione intravitreale del farmaco.
Questo farmaco dovrebbe essere somministrato con una dose di attacco di una iniezione al mese per
tre mesi, mentre il mantenimento dovrebbe avvenire a giudizio clinico.
L’intervallo tra due dosi non deve essere inferiore al mese. Rimangono ancora da accertare gli
effetti a lungo termine e la compliance del paziente.
Gli effetti indesiderati più gravi che sono stati segnalati, associati a grave perdita visiva, sono
correlabili alla procedura di iniezione intravitreale.
Gli effetti indesiderati correlati al farmaco sono: eventi tromboembolici arteriosi - incluse le morti
per cause vascolari, infarti miocardici non fatali, attacchi ischemici non fatali e attacchi emorragici
non fatali sono stati collegati alla disponibilità sistemica degli inibitori VEGF molto potenti.
Nei dati combinati del primo anno dei tre studi di fase III (MARINA, ANCHOR e PIER),
l’incidenza globale degli eventi tromboembolici arteriosi era superiore per i pazienti trattati con
Lucentis 0,5 mg (2,5%) rispetto al braccio di controllo (1,1%).
Tuttavia, nel secondo anno dello studio MARINA, la frequenza degli eventi tromboembolici
arteriosi era simile nei pazienti trattati con Lucentis 0,5 mg (2,6%) rispetto ai pazienti del braccio di
controllo (3,2%).
Recentemente (gennaio 2007) è stato comunicato che un’ulteriore analisi su una popolazione di
5000 soggetti ha evidenziato un rischio tromboembolico nell’1.2% dei pazienti trattati alla dose
consigliata di 0.5 mg e che la percentuale di rischio scende allo 0.3% se viene utilizzata una dose di
0.3 mg - cefalea, ipertensione arteriosa, blefarite, occhio secco, infiammazione intraoculare,
distacco di vitreo, fibrosi sottoretinica, visione offuscata o ridotta.
Sono, invece, comuni: nausea, dolori articolari, dolore alla schiena, bronchite, anemia,
congiuntivite, opacizzazione della capsula posteriore della lente, essudati retinici, distacco
dell’epitelio pigmentato della retina, maculopatia.
Non comuni: fibrillazione atriale, tosse, dispnea, aumento della secrezione delle vie respiratorie
superiori, cheratosi lichenoide, degenerazione retinica, irite, iridociclite, cheratite puntata,
cheratopatia, dellen, strie corneali, cataratta nucleare, reazione nella camera anteriore, glaucoma ad
angolo chiuso, edema palpebrale, irritazione palpebrale, edema corneale.
Pegaptanib sodico (Macugen): è un aptamero cioè un piccolo frammento di RNA sintetico che
legandosi al VEGF165 impedisce il legame con il proprio recettore e la conseguente formazione di
vasi anomali e l’aumento della permeabilità vascolare.
Pertanto questo farmaco potrebbe essere usato in tutte quelle malattie caratterizzate da crescita
anomala di vasi ed aumentata permeabilità vascolare come la degenerazione maculare senile, la
retinopatia diabetica, le occlusioni venose retiniche, la retinopatia del prematuro, i tumori, ecc.
Gli aptameri hanno il vantaggio di non stimolare di solito la risposta immunologica. L’emivita del
farmaco nel corpo vitreo dell'uomo è di 347 ore. I risultati sul tempo di permanenza del farmaco nel
vitreo giustificano una frequenza di somministrazione di una volta ogni 6 settimane.
I risultati ad un anno degli studi clinici multicentrici, randomizzati, in doppio cieco, sono
promettenti. Il pegaptanib è in grado di indurre un rallentamento statisticamente rilevante rispetto al
placebo, nella crescita dell’area totale della lesione e nel mantenimento dell’acuità visiva.
Tuttavia rimangono ancora da accertare gli effetti a lungo termine e la compliance del paziente,
essendo questa una terapia da somministrarsi ogni 6 settimane.
Gli effetti indesiderati più gravi che sono stati segnalati, associati a grave perdita visiva, sono
correlabili alla procedura di iniezione intravitreale. Gli effetti indesiderati correlati al farmaco, sono
essenzialmente oculari: infiammazione della camera anteriore, dolore oculare, cheratite puntata,
mosche volanti e opacità del vitreo.
Sono comuni, invece: cefalea, rinorrea, sensazione anomala nell’occhio, iperemia congiuntivale,
edema congiuntivale, congiuntivite, distrofia corneale, irregolarità dell’epitelio corneale, alterazione
dell’epitelio corneale, edema corneale, secchezza oculare, secrezione, infiammazione, irritazione
agli occhi, prurito, rossore, gonfiore, edema intorno agli occhi, aumento della lacrimazione,
degenerazione maculare, midriasi, ipertensione oculare, ematoma periorbitale, fotofobia, fotopsia,
offuscamento della vista, riduzione dell’acuità visiva, disturbi della vista, distacco del vitreo e
alterazioni del vitreo.
Non comuni: incubi, depressione, sordità, vertigini, palpitazioni cardiache, ipertensione, aneurisma
aortico, rinofaringite, vomito, dispepsia, dermatite, eczema, alterazioni del colore dei capelli, rush
cutaneo, prurito, sudorazione notturna, mal di schiena, affaticamento, dolore toracico, aumento
delle gammaglutamiltransferasi.
Non sono note manifestazioni anomale a lungo termine. Nei pazienti con insufficienza renale,
specialmente se severa, sono stati riscontrati valori di emivita plasmatica altamente variabili per le
iniezioni intravitreali di 3 mg. Non ci sono dati per quanto riguarda i pazienti sottoposti ad
emodialisi o con epatopatie.
Rimane comunque di fondamentale importanza, sia per quanto riguarda la degenerazione maculare
senile che per patologie oculari di altra natura, l’importanza di una diagnosi precoce che permetta di
iniziare una terapia medica o chirurgica adeguata in tempi relativamente brevi.
Bibliografia
•
BERKOW J.W., “Subretinal neovascularization in senile macular degeneration”, <Am. J.
Ophthalmol.>, 1984.
•
CONSENSI INFORMATI/Schede informative approvate dalla Società Oftalmologia
Italiana, Ottobre 2007.
•
EAGLE R.C., “Mechanisms of maculopathy”, <Ophthalmology>, 1984.
•
FERRIS F.L., FINE S.L., HYMAN L., “Age-related macular degeneration and blindness
due to neovascular membranes at the macula”, <Arch. Ophthalmol.>, 1986.
•
FINE S.L., MURPHY R.P., FINKELSTEIN D., “Age related macular degeneration”, <Clin.
Mod. Ophthalmol.>, 1984.
•
FOLK J.C., “Aging macular degeneration”, <Ophthalmology>, 1985.
•
GREEN W.R., MCDONNEL P.J., YEO J.H., “Pathologic features of senile macular
degeneration in the second eye”, <Ophthalmology>, 1985.
•
GREGOR Z., BIRD A.C., CHISHOLM I.H., “Senile disciform degeneration in the second
eye”, <Br. J. Ophthalmol.>, 1977.
•
GREY R.H.B., BIRD A.C., CHISHOLM I.H., “Senile disciform macular degeneration:
features indicating suitability for photocoagulation”, <Br. J. Ophthalmol.>, 1979.
•
ISHIBASHI T., PATTERSON R., OHNISHI Y., “Formation of drusen in the human eye”,
<Am. J. Ophthalmol.>, 1986.
•
KANSKI JACK J., “Oftalmologia Clinica”, 1990.
•
KENYON K.R., MAUMENEE A.E., RYAN S.J., “Diffus drusen and associated
compications”, <Am. J. Ophthalmol.>, 1985.
•
MACULAR PHOTOCOAGULATION STUDY GROUP, “Argon laser photocoagulation
for senile macular degeneration”, <Arch. Ophthalmol.>, 1982.