Pillole di chimica organica 15
Le reazioni di sostituzione degli acidi carbossilici (e dei loro derivati)
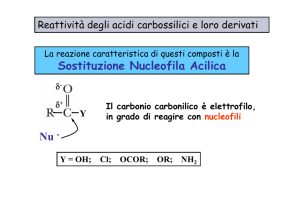
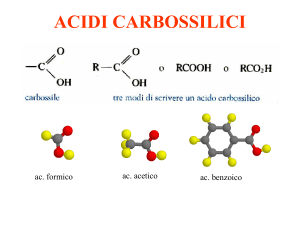
Se prendiamo in esame la formula generica di un acido carbossilico ci rendiamo subito conto che
oltre alla rottura di un legame O-H con conseguente espulsione di uno ione H+, è possibile, a causa
della polarizzazione, che il gruppo carbossilico subisca l'attacco di un nucleofilo (sul carbonio
parzialmente positivo), in analogia a quanto visto in precedenza per i composti carbonilici (aldeidi e
chetoni).
Tralasciando il meccanismo della reazione, con un generico nucleofilo H-Z possiamo scrivere:
Ciò che si è ottenuto non è più un acido carbossilico ma un derivato di un acido
carbossilico:
Nei derivati degli acidi carbossilici Z può variare ma tutti in comune hanno il
gruppo acilico:
Non confondete il gruppo acilico o, più semplicemente, l’acile, con il gruppo
carbonilico, tipico delle aldeidi e dei chetoni. Nell’acile il legame libero è
saturato da un gruppo che non è né un atomo di idrogeno, né da un gruppo
alchilico.
Tra i derivati più importanti degli acidi carbossilici il nostro studio si limiterà allo studio degli
esteri, composti ottenuti dalla reazione tra un acido carbossilico e un alcol, con l'utilizzo di tracce
di un acido con funzione di catalizzatore, la
reazione in questione è detta di esterificazione.
Da segnalare che nel corso della reazione
l'espulsione dell'acqua avviene per perdita di un
ossidrile da parte dell'acido e di un idrogeno da
parte dell'alcol e non viceversa.
Potete inoltre notare come la reazione comporti un
equilibrio, per cui la conversione dell'acido
carbossilico in estere non può mai essere totale: è
comunque possibile "sospingere" il sistema di
reazione verso la formazione dei prodotti, giocando
sulle condizioni sperimentali:
1. Si può utilizzare un eccesso di uno dei due
reagenti, solitamente il meno costoso tra i
due;
2. allontanare dal sistema di reazione uno dei
due prodotti:
Se l'estere, l'acido e l'alcol hanno una
temperatura di ebollizione nettamente superiore a quella dell'acqua si può riscaldare a 100°C
in modo da allontanare l'acqua man mano che si forma;
Chimica e Lab. Tecn. - Docente: prof. Gobbo Adelio - Classe 5a Serale
1
Pillole di chimica organica 15
Se l'estere ha una temperatura di ebollizione molto più bassa degli altri tre componenti può
essere allontanato per distillazione
Può essere usato un agente disidratante come il gel di silice, per rimuovere l'acqua dal
sistema di reazione.
Adesso che abbiamo imparato come si ottengono gli esteri andiamo a conoscerli più da vicino.
Una corsa veloce tra gli esteri, partendo dal profumo della frutta, passando per la cera delle api e
finendo coi terribili trigliceridi, il terrore degli obesi
Cominciamo con qualche informazione sulla nomenclatura degli
esteri, limitandoci una volta tanto alla nomenclatura tradizionale.
Abbiamo già detto che possiamo considerare gli esteri come
formalmente derivati dagli acidi carbossilici per sostituzione
dell'atomo di idrogeno a carattere acido con un gruppo alchilico (o
arilico).
Per questa ragione i loro nomi sono in stretta analogia con quelli dei
sali degli acidi carbossilici, precisando in questo caso quale gruppo alchilico (o arilico) prenda il
posto dell'idrogeno acido. Ad esempio:
ACETATO DI SODIO
ACETATO DI METILE
(SALE)
(ESTERE)
Dal punto di vista della proprietà fisiche possiamo dire che gli esteri, pur avendo una moderata
polarità, dovuta al raggruppamento -COO-, essendo privi di idrogeni a carattere acido non
possono formare legami a ponte d'idrogeno. Per queste caratteristiche anche gli esteri a peso
molecolare basso risultano insolubili in acqua e presentano una temperatura di ebollizione
nettamente inferiore agli alcoli e agli acidi di pari dimensioni. Quelli a basso peso molecolare
manifestano una elevata volatilità e in genere hanno odori molto gradevoli. L'odore caratteristico di
gran parte della frutta è dovuto proprio
alla presenza di esteri:
Gli esteri formati da acidi carbossilici ed
alcoli, entrambi a lunga catena formano
le cere, caratterizzate da natura idrofoba,
dovuta alle loro lunghe catene
carboniose. Ad esempio il costituente
principale della cera delle api è il
palmitato di miricile.
Comunque non credo di sbagliare se affermo che gli esteri più noti in assoluto sono
i trigliceridi, cioè gli esteri della glicerina che hanno un'importanza biologica di
tutto rispetto.
Come dovreste ricordare la glicerina (glicerolo) è un alcol trivalente, il cui nome
IUPAC è 1,2,3-propantriolo.
Chimica e Lab. Tecn. - Docente: prof. Gobbo Adelio - Classe 5a Serale
2
Pillole di chimica organica 15
Dalla reazione di questo triolo con tre molecole di acido carbossilico a lunga catena (acidi grassi)
si generano i relativi esteri, detti TRIGLICERIDI , conosciuti anche con il termine di LIPIDI:
Se i tre acidi carbossilici che entrano in combinazione con la glicerina sono tra loro uguali si parla
di trigliceridi semplici, se sono diversi abbiamo i trigliceridi misti.
Gli acidi carbossilici combinati con la glicerina posseggono catene lineari ed presentano un numero
pari di atomi di carbonio, per lo più da dodici a ventidue atomi di carbonio.
Le loro catene possono essere sature, formate quindi da una sequenza di soli legami semplici
carbonio-carbonio e si parla allora di trigliceridi saturi.
Le catene possono essere anche insature, quando siano presenti uno o più doppi legami e si parla
allora di trigliceridi insaturi. In questo caso i doppi legami presentano isomeria CIS e sono separati
tra loro da almeno un carbonio a ibridazione sp3.
I trigliceridi di origine vegetale sono prevalentemente insaturi, a temperatura ambiente sono
liquidi e vengono indicati col termine di oli.
I trigliceridi di origine animale sono invece prevalentemente saturi, risultano solidi a temperatura
ambiente e sono indicati col termine di grassi.
In genere un olio o un grasso non è mai un trigliceride puro ma è invece costituito da una miscela di
vari trigliceridi.
Ma perché a temperatura ambiente i grassi animali sono solidi e gli olii sono liquidi?
trigliceride saturo
trigliceride insaturo
Per capirlo possiamo osservare, ad esempio, che la temperatura di fusione dell'acido stearico, acido
grasso saturo a formula C18H36O2 è di 70°C, mentre quella dell'acido oleico, acido grasso insaturo
a formula C18H34O2 è di soli 13 °C. Questa diversità si ripercuote anche nei relativi trigliceridi e la
ragione si può spiegare in termini di regolarità delle rispettive molecole: la presenza dei doppi
legami rende le molecole dei trigliceridi insaturi molto più irregolari dei "cugini" saturi e quindi
Chimica e Lab. Tecn. - Docente: prof. Gobbo Adelio - Classe 5a Serale
3
Pillole di chimica organica 15
esse si "impacchettano" con più difficoltà; in termini più rigorosi possiamo affermare che più le
molecole sono irregolari più deboli sono i loro legami intermolecolari e più bassa risulterà la loro
temperatura di fusione.
Questa non è la sola differenza significativa: ad esempio, dal punto di vista chimico, i trigliceridi
saturi sono più stabili di quelli insaturi. Per quale ragione?
Quando lo strutto supera l'olio di oliva
Parlando di condimenti da usare in cucina sono sicuro che avrete sicuramente letto o sentito da
qualche parte come sia preferibile l'uso di oli vegetali in sostituzione dei grassi animali in quanto i
primi risultano più digeribili. Non voglio discutere l'affermazione ma perché essa sia sostenibile
dobbiamo fare una precisazione: se a freddo gli oli vegetali battono i grassi animali, a caldo la
situazione si rovescia e vincono indiscutibilmente i secondi.
Questo vale sopratutto quando i cibi vengono fritti: in questi casi la temperatura è davvero elevata e
i trigliceridi saturi, cioè i grassi, sono chimicamente più resistenti dei loro "cugini" insaturi, cioè gli
oli, che a causa dei doppi legami possono subire una serie di reazioni di ossidazione che non porta a
nulla di buono. Non a caso i trigliceridi sono caratterizzati da una particolare temperatura, detta
punto di fumo, che corrisponde alla temperatura a cui essi iniziano fumare, decomporsi e formando
sostanze nocive e irritanti.
Punto di fumo di alcuni oli e grassi
Olio di girasole
meno di 130 °C
Olio di soia
130 °C
Olio di mais
160 °C
Olio di arachide
180 °C
Olio extravergine di oliva
210 °C
Burro
260 °C
Strutto
più di 260 °C
In particolare liberano acroleina o aldeide acrilica (propenale per la IUPAC), sostanza tossica, di
odore acre ed irritante, la cui tossicità è tale che, anche in piccola quantità, è lesiva soprattutto per il
fegato.
Ecco perché la frittura che piace tanto fa male, specie a chi
presenta disturbi di fegato. Ed ecco perché è sbagliato
riciclare l'olio in cui vengono soffritte le vostre beneamate
patatine per enne ed enne volte.
Ed ecco perché le frittelle della nonna (o della bisnonna),
soffritte nello strutto di maiale, erano così "leggere" e
digeribili! Ah, i sapori e le sapienze dei tempi antichi!
Tornando al moderno, vi sarà capitato di certo, leggendo gli
ingredienti di quelle cose orribili che sgranocchiate continuamente a scuola di incontrare un
termine incomprensibile: GRASSI VEGETALI IDROGENATI. Cosa sono?
Dobbiamo fare una premessa: un’altra degradazione tipica dei trigliceridi insaturi è l’ossidazione (o
irrancidimento), causata dalla presenza di ossigeno e favorita dalla luce. L’ossidazione inizia già
durante la cottura, anche se in misura molto limitata e quindi non avvertibile ma prosegue
successivamente, anche a temperatura ambiente, in modo inarrestabile. Questo non è un problema
per un cibo che viene consumato dopo poche ore ma lo è per gli alimenti industriali che hanno
Chimica e Lab. Tecn. - Docente: prof. Gobbo Adelio - Classe 5a Serale
4
Pillole di chimica organica 15
tempi di conservazione molto lunghi, prima del loro utilizzo finale. Per evitare il deterioramento
delle loro caratteristiche organolettiche (in altre parole sapore e odore) questi alimenti non possono
essere preparati utilizzando oli vegetali insaturi, che avrebbero il vantaggio di essere poco costosi.
Allora, se il problema degli oli vegetali è quello dei doppi legami basta semplicemente eliminarli!
Come?
Semplice, si prende un olio di basso prezzo (olio di cotone, olio di soia, olio di mais) e lo si
sottopone a blanda riduzione, a circa 8 atmosfere e a 120 °C circa, in presenza di nichel metallico
con funzione di catalizzatore. Questo processo, detto di indurimento, trasforma un trigliceride
insaturo in un trigliceride saturo:
In questo modo, man mano che i doppi legami vengono saturati, l'olio diventa sempre più viscoso
fino a solidificare, assumendo una consistenza semisolida, simile al burro. Una consistenza ma non
le caratteristiche organolettiche del burro: niente paura, si può aggiungere del latte (quando va bene)
un po' di colorante e il gioco è fatto: signore e signori, eccovi serviti la margarina vegetale, che di
vegetale non ha proprio più niente e che viene spacciata non come un surrogato a buon mercato del
burro ma come un'autentica alternativa vegetale (e quindi per definizione "naturale") del povero
burro, che essendo di origine animale, sempre per definizione, è da vedersi con sospetto!
Ah, potenza della pubblicità in un mondo di ignoranza e di consumismo omologato!
Noi invece tiriamo dritto e andiamo a scoprire cosa possiamo fare ancora con i trigliceridi, basta un
po' di fantasia, un bel pentolone e ....
La saponificazione, ossia, come vivere puliti e felici sfruttando i trigliceridi
In precedenza abbiamo incontrato i saponi, ma ci siamo "dimenticati" un piccolo particolare: da
dove si ottengono? Semplice, dai trigliceridi o, se preferite, dai grassi e dagli oli!
Ma come, se prendo un pezzo di lardo e me lo strofino per benino riesco a fare toilette? Non
proprio, otterreste l'effetto contrario. Avreste la pelle come quella di un cotechino sotto il sole nel
mese di agosto.
Chimica e Lab. Tecn. - Docente: prof. Gobbo Adelio - Classe 5a Serale
5
Pillole di chimica organica 15
Bisogna prima prendere il lardo (ma quello, specie se di Colonnata ce lo mangiamo coi crostini), il
sego delle mucche macellate (che al massimo si usavano per fare mangimi, poi si è scoperto il
morbo della mucca pazza!), il grasso delle povere balene (per fortuna molto meno di un tempo),
l'olio di palma, l'olio "che più schifo di così si muore" e lo si sottopone a idrolisi alcalina, con soda
caustica.
In queste condizioni i legami esterei si rompono e il processo, che si dice, guarda un po', di
saponificazione perché il prodotto che si ottiene è proprio il sapone, o meglio i SAPONI.
Perché ciò che si ottiene è in realtà una miscela di sali sodici di acidi grassi a lunga catena, oltre a
glicerina:
Tecnicamente possiamo definire la reazione di saponificazione come un processo più generale di
idrolisi alcalina, comune a tutti gli esteri.
Adesso però basta coi saponi, non sapremo proprio tutto ma quello che abbiamo visto è già
abbastanza.
Chimica e Lab. Tecn. - Docente: prof. Gobbo Adelio - Classe 5a Serale
6