carbonile
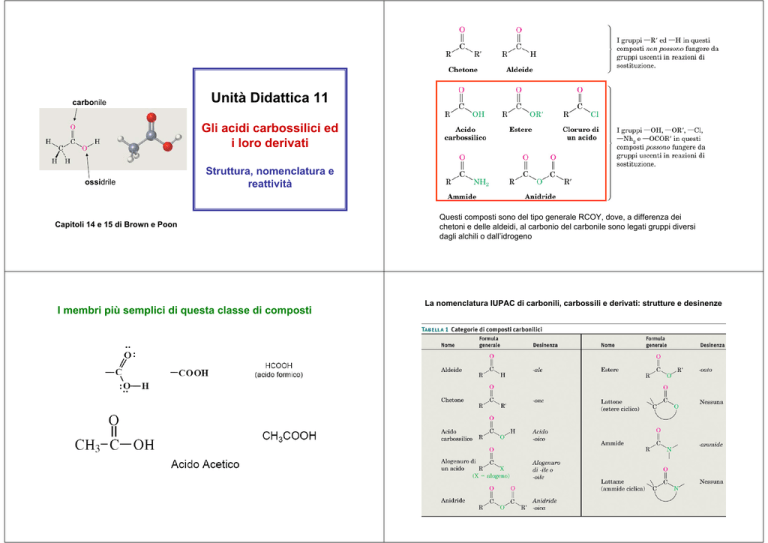
Unità Didattica 11
Gli acidi carbossilici ed
i loro derivati
ossidrile
Struttura, nomenclatura e
reattività
Capitoli 14 e 15 di Brown e Poon
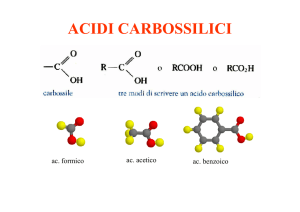
I membri più semplici di questa classe di composti
Questi composti sono del tipo generale RCOY, dove, a differenza dei
chetoni e delle aldeidi, al carbonio del carbonile sono legati gruppi diversi
dagli alchili o dall’idrogeno
La nomenclatura IUPAC di carbonili, carbossili e derivati: strutture e desinenze
Priorità crescente
Regola generale per la priorità di nomenclatura dei composti
Classe
Desinenza
Prefisso nel caso di
sostituente
Acidi carbossilici
Acido -oico
Carbossi-
Esteri
-oato
Alcossicarbonil-
Ammidi
-ammide
Amido-
Nitrili
-nitrile
Cyano-
Aldeidi
-ale
OssoFormil- (nel caso di –CH=O)
Chetoni
-one
Osso-
Alcol
-olo
Idrossi-
Ammine
-ammina
Ammino-
Alcheni
-ene
Alchenil- (es: propenil-)
Alchini
-ino
Alchinil- (es: propinil-)
Alcani
-ano
Alchil- (es: butil-)
Eteri
–
Alcossi- (es: metossi-)
Alogenuri alchilici
–
Alogeno- (es: cloro-)
Esempi di nomenclatura degli acidi carbossilici
IUPAC: prefisso acido e desinenza –oico.
Se un cicloalcano è direttamente legato al carbossile il nome
dell’alcano viene usato nella dizione: acido cicloalcano
carbossilico.
I nitrili sono analoghi degli acidi che contengono il gruppo -C≡N
(ciano).
Altri esempi (più di un gruppo funzionale)
Acidi dicarbossilici semplici hanno nomi comuni di largo uso. In IUPAC
sono acidi –dioici.
Gli acidi carbossilici hanno alti punti di ebollizione: hanno forti interazioni
intermolecolari, formano legami idrogeno tra di loro.
La ionizzazione rende gli acidi carbossilici solubili in acqua.
Sono acidi deboli, ma tra i più forti acidi
organici
Come evidenziato in precedenza, l’acidità di un acido carbossilico è dovuta sia
ad effetti induttivi, sia alla stabilizzazione per risonanza dello ione
carbossilato ottenuto dalla deprotonazione. La carica negativa è condivisa
ugualmente dai due ossigeni legati al carbonio carbossilico.
Stessa lunghezza di legame per i due
C-O del carbossilato
Le proprietà acide degli acidi carbossilici sono modulate dai gruppi
sostituenti legati
I gruppi attrattori
funzionano per effetto
induttivo: sono
specialmente efficaci se
sono numerosi ed in α
al carbossile.
I nitrili sono interessanti intermedi di sintesi: sono ottenuti facilmente per
sostituzione nucleofila usando cianuro (CN–) e possono poi essere
idrolizzati ad acidi carbossilici o ridotti ad ammine.
Le proprietà acide degli acidi carbossilici sono modulate dai gruppi
sostituenti legati
Una interessante determinazione sperimentale:
Un metodo interessante per la preparazione di acidi carbossilici è la
carbossilazione dei reattivi di Grignard con CO2. In questo modo si può passare
da un alogenuro ad un acido carbossilico con un carbonio in più.
Due strade alternative per preparare acido fenilacetico
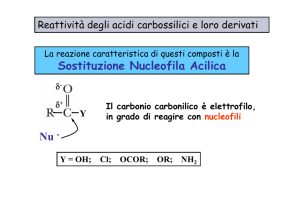
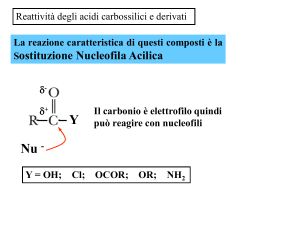
I carbossili o i loro derivati sono caratterizzati dall’avere un potenziale gruppo
uscente legato al carbonile, per cui possono dare reazione di sostituzione
acilica. L’intermedio tetraedrico che si forma per addizione nucleofila al carbonio
carbonilico ripristina il doppio legame C=O grazie all’espulsione del gruppo
uscente.
Un esempio di riduzione (gli idruri non riducono i doppi legami C=C isolati)
La reazione procede verso destra se esce un gruppo che è una base più
debole di quella entrante (ricordi il caso delle sostituzioni nucleofile?)
Acido carbossilico
Cloruro acilico bromuro acilico
(alogenuri acilici)
estere
anidride dell’acido
Hanno gruppi
che possono
essere
sostituiti da
un nucleofilo
entrante
ammidi
Reazione di sostituzione nucleofila acilica
Una breve rassegna
esempio
Ordine di reattività
Ordine di reattività
Tutti i derivati acilici possono essere idrolizzati agli acidi
corrispondenti.
La conversione di un acido carbossilico in alogenuro acilico viene
condotta con agenti alogenanti, quali SOCl2, PBr3 o PCl3
Le anidridi si ottengono per
disidratazione degli acidi.
Due gruppi acilici sono legati
ad un ossigeno etereo.
Possono essere
simmetriche o miste
Gli esteri si possono ottenere dagli acidi per sostituzione nucleofila usando il
carbossilato come nucleofilo.
Il meccanismo
dell’esterificazione, detta
“di Fischer”
In catalisi acida
Ricordate che se si fa reagire un acido con una base si ottiene un sale
Gli alogenuri acilici sono ottimi substrati per reazioni nella scala del
laboratorio, si preparano dagli acidi e si convertono in altri derivati acilici
Ricordate l’acilazione di Friedel e Crafts?
Dalla reazione di un’ammina con il cloruro acilico, si ottiene l’eliminazine di
HCl, che consuma un equivalente di base: servono due equivalenti di
ammina per portare a completamento la reazione.
Anche le anidridi sono substrati di utilità sintetica
La preparazione degli esteri
Gli esteri
La deesterificazione (saponificazione) degli esteri
Il meccanismo della saponificazione
In condizioni di catalisi
acida, la reazione di
deesterificazione è l’inverso
dell’esterificazione di
Fischer
I reattivi di Grignard producono alcol terziari (il chetone
intermedio è miglior substrato per la stessa reazione)
(producono alcoli secondari reagendo con un formiato)
La riduzione degli esteri produce alcoli primari
Gli esteri ciclici sono detti “lattoni”
Preparazione di un’ammide da un cloruro acilico
E sua idrolisi
Un’ammide ciclica è detta “lattame”
Anche i derivati dei carbossili possono formare ioni enolato, più
facilmente nel caso in cui due carbossili o un carbonile ed un carbossile
siano in posizione 1,3. (Similmente si possono preparare facilmente ioni
enolato negli 1,3-dicarbonili.)
Delocalizzazione della
carica negativa sul
carbonio alfa
Anche gli esteri sono acidi
deboli, così come aldeidi e
chetoni.
L’analogo della
condensazione aldolica sugli
esteri è detta
“condensazione di Claisen”
Gli esteri sono meno acidi di aldeidi e chetoni
Etil 3-ossobutirrato
(acetoacetato di etile) un
β-cheto estere (pKa=10.7)
2,4-pentandione un
β-dichetone
(pKa=8.9)
Un β-chetoestere
Gli acidi 1,3-dicarbossilici o 3-ossocarbossilici decarbossilano se
riscaldati
Uno dei modi per cui la si può sfruttare è la “sintesi dell’acido malonico”
basata proprio sul fatto che i carboni in α ad un 1,3-dicarbossile (o a un 1,3chetoacido) sono acidi.
R-X → R-CH2-COOH
Abbreviazione per etile-
Simile come strategia è la “sintesi acetoacetica”