Biol. Mar. Medit. (2003), 10 (2): 1112-1114
A. Pederzoli, B. Parisini, A. Gambarelli, A. Spano’*, L. Mola
Dipartimento di Biologia Animale, Università di Modena e Reggio Emilia, Via Campi, 213/D
41100 Modena, Italia.
*Azienda ittica Valle Figheri, Lova, Venezia, Italia.
LOCALIZZAZIONE ISTOCHIMICA E IMMUNOISTOCHIMICA
DELL’OSSIDO NITRICO NEL TRATTO DIGERENTE IN SVILUPPO DI
DICENTRARCHUS LABRAX
HISTOCHEMICAL AND IMMUNOHISTOCHEMICAL LOCALIZATION OF
NITRIC OXIDE IN THE DEVELOPING GUT OF DICENTRARCHUS LABRAX
Abstract
In this study we present the occurrence of nitric oxide in the gut during the first larval phases in Dicentrarchus labrax (Osteichtyes). The histochemical and immunohistochemical tests were carried out in 3, 8, and
24 days and 5 months old specimens.
Key-words: teleosts, development, gut, nitric oxide.
Introduzione
Nell’ambito di indagini sulla comparsa e distribuzione di molecole regolative
durante lo sviluppo dell’apparato digerente di spigola (Dicentrarchus labrax), abbiamo
preso in considerazione la localizzazione dell’ossido nitrico (NO), il cui possibile ruolo
regolativo nello sviluppo è stato studiato prevalentemente nei mammiferi. Abbiamo
utilizzato sia la metodica istochimica per l’evidenziazione della NADPH-diaforasi,
enzima considerato indicativo della presenza di NO e spesso utilizzato come marker,
sia quella immunoistochimica per l’evidenziazione della NO sintasi (NOS), enzima
che catalizza la produzione di NO, nella sua forma costitutiva nervosa (nNOS). Oltre
che su esemplari a pochi giorni dalla schiusa, le indagini sono state condotte anche su
regioni dell’intestino di giovani per verificare eventuali differenze nella distribuzione
dell’ossido nitrico.
Materiali e metodi
Le condizioni di allevamento sono le seguenti: fotoperiodo con 24 ore di luce nei
primi 12 giorni, salinità del 40 per mille nei primi 12 giorni, portata gradualmente al
30 per mille in sette giorni, temperatura di 16-18 °C. L’alimentazione è costituita da
rotiferi arricchiti dal 5° al 16° giorno e da Artemia appena schiusa dal 10° giorno in
poi. Sono state utilizzate larve a 3, 8 e 24 giorni dalla schiusa (rispettivamente 3, 6,
e 10 mm circa) e tratti di intestino di animali di 5 mesi. Il materiale è stato in parte
fissato in paraformaldeide 4% in PB, crioprotetto in PB più 25% di saccarosio per una
notte e tagliato al criostato in sezioni di 14-16 μm di spessore, in parte fissato in Bouin,
incluso in paraffina e tagliato in sezioni di 7 μm. Per l’evidenziazione immunoistochimica della nNOS è stato utilizzato un antisiero da coniglio contro la NOS1 (H-299)
umana (Santa Cruz Biotecnology, Inc., USA) alla diluizione di 1:150. L’incubazione
in camera umida è durata 40 ore a 4 °C. Dopo incubazione con anticorpo secondario
(da capra anti coniglio) biotinilato (Dako A/S Denmark) per 30’ e con il kit ABC
L'ossido nitrico nel tratto digerente in sviluppo di spigola
1113
(Vector, Burlingame, CA) per 45’, la perossidasi è stata evidenziata con diaminobenzidina (Sigma, St. Louis, USA). Il controllo delle reazioni è stato effettuato omettendo
l’anticorpo primario e sostituendolo con siero normale da capra o con PBS 0,1 M (pH
7,4). Per la ricerca dell’attività diaforasica l’incubazione è stata condotta a temperatura ambiente per 4 ore secondo la metodica di Li e Furness (1993) utilizzando una
miscela incubante con 0,25 mg/ml di Nitro BT, 1 mg/ml di NADPH e 0,2% di Tx100
in tampone TRIS 0,1 M a pH 7,6. Il controllo è stato eseguito omettendo il substrato
dal mezzo di incubazione.
Risultati
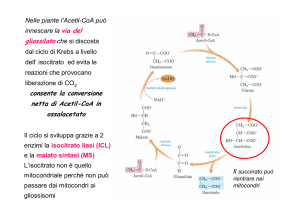
Sia negli esemplari di 3 e 8 che in quelli di 24 giorni la NADPH-diaforasi è
abbondantemente distribuita in tutte le cellule epiteliali e nelle terminazioni nervose
della muscolatura intestinale, per l’intero tubo digerente (Fig. 1a). Negli stessi stadi
larvali è presente immunoreattività per la nNOS, localizzata anch’essa nell’epitelio e
nelle terminazioni nervose della parete intestinale (Fig. 1b). Nel complesso la positività della reazione immunoistochimica risulta meno intensa ma più definita rispetto a
quella per la reazione istochimica. Nell’intestino di giovani sia l’attività enzimatica per
la NADPH-diaforasi che l’immunoreattività per la nNOS scompaiono dall’epitelio e
rimangono localizzate in neuroni e fibre nello spessore della parete.
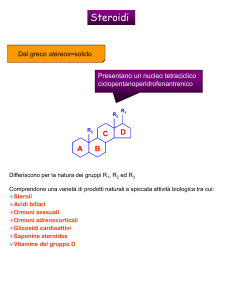
Fig. 1 - Microfotografie del tubo digerente in sviluppo di esemplari a 24 giorni dalla schiusa di
Dicentrarchus labrax (L.). Barre = 50 μm. a) Sezione trasversale del tratto subterminale;
reazione istochimica per la NADPH diaforasi. b) Sezione trasversale del tratto subterminale;
reazione immunoistochimica con anticorpi anti-nNOS (1: 150).
Light microphotografs of developing gut of 24 days old specimens of Dicentrarchus labrax (L.).
Bars = 50 μm. a) Transversal section of subterminal region; histochemical reaction for the NADPH
diaphorase. b) Transversal section of subterminal region; immunohistochemical reaction with antibodies anti nNOS (1: 150).
Conclusioni
La positività della reazione immunoistochimica per la nNOS, meno intensa ma più
definita rispetto a quella per la reazione istochimica per la NADPH diaforasi, concorda
con l’opinione di Tracey et al. (1993) secondo la quale tutte le NOS conosciute sono
NADPH diaforasi ma la NOS rappresenta solo una frazione della totale attività diaforasica cellulare.
1114
A. Pederzoli, B. Parisini, A. Gambarelli, A. Spanò, L. Mola
In base ai nostri dati possiamo affermare che l’NO è presente nel sistema nervoso
gastroenterico di larve di spigola già tre giorni dopo la schiusa. Il ruolo fisiologico
attribuito a tale molecola nel controllo inibitorio della motilità intestinale, noto per
teleostei adulti (Olsson e Holmgren, 2001), viene quindi assunto fin dai primi stadi di
sviluppo.
La scomparsa dell’ossido nitrico dall’epitelio al termine dello sviluppo larvale
suggerisce un ruolo regolativo nei processi di sviluppo e maturazione dell’apparato
digerente, fin’ora noto solo per alcuni organi di mammiferi (Solhaug et al., 2000; Belai
e Burnstock, 2000).
Bibliografia
BELAI A., BURNSTOCK G. (2000) – Pattern of distribution and co-localization of NOS and ATP in
the myenteric plexus of human fetal stomach and intestine. Neuroreport, 11: 5-8.
LI Z.S., FURNESS J.B. (1993) - Nitric oxide synthase in the enteric nervous system of the rainbow
trout, Salmo gairdneri, Arch. Histol. Cytol., 56: 185-193.
OLSSON C., HOLMGREN S. (2001) – The control of gut motility. Comp. Biochem. Physiol.,128A:
481-503.
SOLHAUG M.J., DONG X.Q., ADELMAN R.D., DONG K. W. (2000) – Ontogeny of neuronal nitric
oxide synthase, NOS I, in the developing porcine kidney. Am. J. Physiol., 278: 1453-1459.
TRACEY W.R., NAKANE M., POLLICK J.S., U. FORSTERMANN U. (1993) - Nitric oxide synthases in neuronal cells, macrophages and endothelium are NADPH diaphorases, but represent
only a fraction of total cellular NADPH diaphorase activity. Biochem. Biophys. Res. Commun.,
195: 1035-1040.