Ricci Lidia
Laboratorio Microbiologia
A.O S. M. Nuova, Reggio Emilia
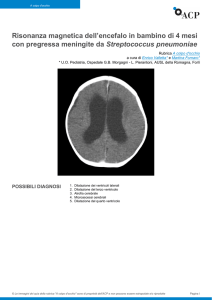
PATOGENESI DELLA MENINGITE BATTERICA
Agente
Patogeno
Attacco degli organi di difesa :
Cranio
Meningi (Pia Madre, Aracnoide, DuraMadre)
Barriera emato-encefalica
RESISTENZA A
Fagocitosi dei
leucociti
polimorfonucleati
Fagocitosi dalle
cellule
reticoloendoteliali
Lisi dal
complemento
Attacco degli
anticorpi specifici
Migrazione dei batteri nello spazio
subaracnoide e nel liquor
Invasione e replicazione batterica
con risposta infiammatoria nel
fluido cerebrospinale
Meningite
PATOGENESI
Lipopolisaccaride batterico
tropismo meningeo
recettori di superficie
infiammazione delle meningi
Dura Madre
Aracnoide
Pia Madre
Penetrazione dell'agente patogeno
Circolo ematico (più frequente)
Barriere permeabili per flogosi secondaria a
batteriemia
Dura Madre
Aracnoide
Liquor-encefalica
Ematoliquorale
Pia Madre
Ematoencefalica
Penetrazione dell'agente patogeno
Per contiguítà da infezioni presso le meningi
Oto-mastoiditi- sinusiti acute, croniche
riacutizzate sconfinanti fino alle meningi
Penetrazione dell'agente patogeno
Dall'esterno per soluzioni di continuità:
• congenite (es. meningocele, seno dermico, ecc.)
• traumatiche
x fistole liquorali,
x fratture mal consolidate frequenti della lamina cribrosa che
comportano anche rinorrachia = perdita di liquor dalle fosse
nasali
• interventi neurochirurgici
• indagini strumentali invasive
• derivazioni ventricolo-peritoneali
Penetrazione dell'agente patogeno
Attraverso le guaine delle fibre dei nervi
olfattorio ed ottico
• rinofaringe -> lamina cribrosa dell'etmoide
• dai capillari o/e vie linfatiche perinervose
Meningite Batterica
Altri Fattori di Patogenicità
Batterici
• Organi di adesione o” Pili” dei batteri
• Proteasi di Streptococcus pneumoniae che
neutralizza l’attività delle Ig A
Meningite Batterica
Altri Fattori di Patogenicità
Cellulari
• Specifici recettori di cellule mucose ed
epiteliali (es. fagocitosi di Neisseria
meningitidis nel naso-faringe)
Meningite Batterica
Fattori di rischio per le meningiti di comunità
Paziente
•
•
•
•
•
Diabete mellito
Otite media
Polmonite
Sinusiti
Abuso di alcool
Attia J,Hatala R,et al. Jama 1999
Meningite Batterica
Fattori di rischio per le meningiti nosocomiali
• Interventi neurochirurgici
• Interventi di chirurgia ORL
• Derivazioni ventricolari
AGENTI EZIOLOGICI
•Heamophylus influenzae
•Neisseria meningitidis (sierogruppi B,A,C,Y ,W135)
•Streptococcus pneumoniae
•Lysteria monocytogenes (neonati, anziani, immunodepressi ecc)
•Streptococcus agalactiae ( meningite neonatale)
•Batteri aerobi gram negativi (procedure neurochirurgiche e trauma cranico)
•Staphylococcus aureus
•Staphylococcus epidermidis
•Staphylococcus spp.
•Enterococchi
•Difteroidi
•Mycobacterium tuberculosis
•Cryptococcus neoformans (pazienti immunocompromessi)
•Candida albicans
•Candida spp.
•Anaerobi ( frequenti infezioni miste)
Meningite Batterica Nosocomiale
Batteri
% d’isolamento
Batteri gram negativi
60%
Staphylococcus spp.
20%
Streptococcus spp
10%
Neisseria meningitidis
1%
J.Albanese, Elsevier 1996
Meningite Batterica Comunitaria
Batteri
Streptococcus
pneumoniae
Neisseria meningitidis
Haemophylus
influenzae
Altri batteri (Listeria spp.,
Str. agalactiae, S.aureus)
Casi %
Mortalità %
30-50
19-46
15-40
3-17
2-7*
3 -11
6-8
*Prima dell’introduzione della vaccinazione Hib, H. influenzae era responsabile del
45%dei casi di meningite nei bambini di età < 5 anni
Meningite Batterica
Pazienti a rischio
Batteri
Immunocompromessi
S.pneumoniae,N.meningiditis,
L.monocytogenes, P. aeruginosa,
batteri gram negativi
Con frattura del cranio
S.pneumoniae, H.influenzae,
S.pyogenes
Post-traumatizzati o
sottoposti a procedure
neurochirurgiche
S.aureus, S.epidermidis,
P.aeruginosa, bacilli gram
negativi
Con shunt CSF
Propionibacterium acnes, e
gli altri batteri
MENINGITI BATTERICHE IN ITALIA
(dati ISS per l’anno 2002)
Non identificati =17.5%
S. pneumoniae =26.7%
235
Altri =8.75%
M.tuberculosis =3.8%
S. Agalactiae =3.4%
L. monocytogenes =4.3%
H. influenzae =4.7%
N. meningitidis =25.5%
MENINGITE BATTERICA
Agenti eziologici ed età
Prematuri e
neonati:
S. agalactiae. E. coli K1 ed altri enterobatteri, Listeria
monocytogenes, Enterococcus spp.
2 sett – 3 mesi:
E. Coli K1, S. agalactiae, L. monocytogenes,
S. pneumoniae
3 mesi – 4 anni
S. pneumoniae, N. meningitidis, H. influenzae*,
Streptococcus spp., bacilli G-
5 anni – 50 anni:
N. meningitidis, S. pneumoniae, H. influenzae*,
bacilli G - **, S. aureus*, Streptococcus spp.,
>50 anni
S. pneumoniae, N. meningitidis, bacilli G- **,
S. aureus, S. agalactiae, L. monocytogenes***
*Raro nei paesi dove viene attuata vaccinazione HiB ** In pazienti ospedalizzati
*** In pazienti immunodepressi
MENINGITE BATTERICA
Agenti eziologici
• Streptococcus pneumoniae ed Haemophylus
influenzae infettano soggetti di ogni età
• Negli ultimi 25 anni la meningite da Batteri
Gram Negativi si è raddoppiata negli adulti
•Le infezioni da Listeria monocytogenes sono
aumentate di 8-10 volte, causate da uso di alimenti
infetti( vegetali crudi, prodotti caseari) e colpiscono i
trapiantati, emodializzati, paz. in trattamento con
steroidi e altri farmaci,donne in gravidanza, neonati
MENINGITE MENINGOCOCCICA
MMWR Morb Mortal Wkly Rep. 2000;49(RR-7):13-20
MORTALITÀ PER MENINGITE
BATTERICA IN ITALIA
(fonte ISS, 2001)
• N. meningitidis
• S. pneumoniae
• H. influenzae
13%
12%
3%
Quale indagine effettuare su
LCR per la diagnosi eziologica
di meningite batterica?
ASPETTO DEL LIQUOR
PAZIENTE SANO
LIMPIDO
PAZIENTE CON MENINGITE BATTERICA
LATTESCENTE SMERIGLIATO PURULENTO
ESAME CHIMICO FISICO DEL LCR
NELLA MENINGITE BATTERICA
Parametri LCR
Rilievi tipici
Pressione
GB
Neutrofili
Proteine
Glucosio
Glucosio LCR/siero
200-500 mm H2O
1000-5000/mm3
>80%
100-500 mg/dL
<40 mg/dL
<0.3
ESAME CHIMICO FISICO DEL LCR
NELLA MENINGITE BATTERICA
Parametri LCR
Altamente predittivi di
meningite
GB
Neutrofili %
Proteine
Glucosio
Glucosio LCR/siero
>2000/µL
>1180/µL
>220 mg/dL
<34 mg/dL
<0.23
CARATTERISTICHE DIFFERENZIALI
DEL LCR
ESAME CHIMICO FISICO DEL LCR
NELA MENINGITE BATTERICA
Pleiocitosi linfocitica si può
osservare nelle meningiti da
Listeria monocytogenes
Mycobacterium tubercolosis,
Borrelia burgdorferi, Treponema
pallidum
COLORAZIONE DI GRAM
• Test rapido (30’), di basso costo, altamente
specifico
(Raccomandazione A, livello di Evidenza III)
Linea Guida Interaziendale
COLORAZIONE DI GRAM
• Identifica i microorganismi in causa nel 60-90%
dei casi, con una specificità >97%
• La probabilità di positività dipende dalla
concentrazione
dei microorganismi, dallo
specifico patogeno e dalla presenza di una terapia
antibiotica in atto
• Possibili falsi-positivi per errori di interpretazione,
contaminazione di reagenti, contaminazione
cutanea nell’effettuazione della LP
COLORAZIONE DI GRAM
Batteri
Sensibilità
S.pneumoniae
90%
H.influenzae
86%
N.meningitidis
75%
Gram negativi
50%
L.monocytogenes <50%
Steven I, Infect Med 2003
COLORAZIONE DI GRAM
Aspetto microscopico del meningococco
Test di agglutinazione al lattice in
meningite batteriche ad eziologia
accertata con esame colturale
Microrganismo
Haemophilus influenzae tipo b
Neisseria meningitidis
Streptococcus pneumoniae
Streptococcus agalactiae
Sensibilità
78-100%
50-93 %
67-100%
69-100%
Gray LD, Fedorko DP. Clin Microbiol Rev 1992;5:130.
TEST di AGGLUTINAZIONE
AL LATTICE
• 901 test in 37 mesi, nessun cambio di terapia in
22/26 con test positivo a
• 344 campioni LCR di cui solo 10 rappresentativi
di infezione vera: sensibilità del 70% e specificità
del 99.4% b
• In pazienti con meningite con esame colturale
negativo, sensibilità solo del 7% c
a Maxson S, et al. J Pediatr 1994;125:235.
b Hayden RT, Frenkel LD. Pediatr Infect Dis J 2000;19:290.
c Tarafdar K, et al. Clin Infect Dis 2001;33:406.
LINEE GUIDA PER L’UTILIZZO DEL
TEST DI AGGLUTINAZIONE AL
LATTICE SU LCR
• Non indicato di routine per la determinazione
dell’eziologia batterica della meningite, può
essere utile in specifiche circostanze
(Raccomandazione C, livello di Evidenza II)
• Dovrebbe essere utilizzato in casi di meningite
pretrattati con antibiotici, nei quali la colorazione
di Gram e l’esame colturale risultino negativi
(Raccomandazione B,livello di Evidenza III)
Linea Guida Interaziendale
ESAMI COLTURALI LCR
• positività 85-90%, in 24-48 ore
• test di sensibilità in vitro richiede
altre 24 ore
INFLUENZA DEL TRATTAMENTO
ANTIBIOTICO SULLE COLTURE LCR IN
128 CASI DI MENINGITE BATTERICA
non trattati
3%
neg
97%
pos
pre-trattati
46% 56%
neg pos
Kanegaye et al. Pediatrics 108:11, 2001
Polymerase chain reaction (PCR)
per l’identificazione dei patogeni
respondabili di meningite batterica
• Può essere utile, tuttavia al momento è poco
commercializzata
e
le
tecniche
poco
standardizzate
(Raccomandazione B,livello di Evidenza II)
• Il principale vantaggio è quello di non essere
influenzato dal pretrattamento con antibiotici
Emocoltura
• Due prelievi da siti differenti nell’arco
di 10-15 minuti
• Eseguire prima della terapia anche in
assenza di febbre
• Ricercare batteri aerobi ed anaerobi
in caso di sospetto di ascesso
cerebrale
(Raccomandazione B, livello di evidenza III)
Linea Guida Interaziendale
Emocoltura
• positività 75% nei soggetti con
meningite batterica non trattata
• Positività 56% nei soggetti con
meningite dopo inizio trattamento
antibiotico
INFLUENZA DEL TRATTAMENTO
ANTIBIOTICO SULLE EMOCOLTURE IN
128 CASI DI MENINGITE BATTERICA
non trattati
75%
25%
pretrattati
Positive
46%
56%
Negative
Kanegaye et al. Pediatrics 108:11. 2001
Aspirato da lesioni
• positività 75% dei casi dei soggetti
con manifestazioni cutanee
(Racccomandazione C, livello di evidenza III)
Linea Guida Interaziendale
Tampone naso-faringeo
• Positività nel 50% dei soggetti con
meningite da meningococco
• Non deve essere eseguito nelle
meningiti da pneumococco
Antibiogramma
•Deve essere eseguito con la
determinazione della minima
concentrazioni inibente (MIC)
•Consente un’applicazione terapeutica
mirata scelta in base ai valori delle
MIC
Antibiogramma
Tunkel A.R et al. Clin Infect. Dis. 2004;39:1267-84
Fattori di criticità per la
diagnosi di laboratorio
• PRELIEVO
• TEMPO
Il liquor è ipotonico con possibile lisi dei neutrofili.
Al momento del conteggio, se i campioni sono conservati a
temperatura ambiente, si potrebbe riscontrare una diminuzione del
32% dopo 1ora, del 50% dopo 24 ore.
• TEMPERATURA
PER LA COLTURA: Conservare a temperatura ambiente o incubare a 35° C,
non refrigerare.
PER RICERCA ANTIGENI : Conservare a 4 °C
Linea Guida Interaziendale
Allegato n.4