Relazione attività svolta dalla U0-04 nel secondo anno
I Ministeri dell’Economia e delle Finanze, dell’Istruzione, Università e Ricerca, dell’Ambiente
della Tutela del Territorio, delle Politiche Agricole e Forestali
----------------------------------------------
Fondo Integrativo Speciale per la Ricerca
PROGETTO ESECUTIVO
A1)
PROGRAMMA STRATEGICO: B) SVILUPPO SOSTENIBILE E CAMBIAMENTI CLIMATICI
A2) Progetto-Obiettivo: 1) Simulazioni, Diagnosi e Previsioni del Cambiamento Climatico
A3) TEMATICHE: a) studi sull’evoluzione e sulla variabilità climatica, cause dei cambiamenti climatici: ruolo dei sistemi urbani e
produttivi ivi compreso quello agroforestale. c) impatto dei cambiamenti climatici sulle coste e studi della loro vulnerabilità; previsioni
sugli ecosistemi terrestri ed acquatici, ed in particolare sulla biodiversità. f) monitoraggio, diagnosi, simulazione e previsione
dell’evoluzione dei sistemi agricoli in relazione ai cambiamenti climatici. h) metodi e tecniche sostenibili per l’immagazzinamento del
carbonio (carbon-sink).
TITOLO del PROGETTO
Cambiamenti Climatici e Sistemi Produttivi Agricoli e Forestali: Impatto sulle
Riserve di Carbonio e sulla Diversità Microbica del Suolo.
Acronimo: SOILSINK
Linea 3. Diversità genetica e funzionale dei microrganismi
UO-04 Diversità genetica dei batteri
Capofila: Renato Fani, Dipartimento di Biologia e Genetica Animale, Università di Firenze
- Batteri coltivabili - Annamaria Bevivino, UTS Biotecnologie, Protezione della Salute
e degli Ecosistemi, ENEA, C.R. Casaccia, Roma
- Batteri non coltivabili – Giacomo Pietramellara, Dipartimento di Scienza del Suolo e
Nutrizione della Pianta, Università di Firenze
1
Obiettivi
LINEA 3 Diversità
genetica e funzionale dei
microrganismi
Obiettivo 1 a)
b)
1° anno
2° anno
Valutazione della
a1) valutazione della
biodiversità batterica
biodiversità batterica
coltivabile mediante
coltivabile mediante
isolamento e
isolamento e
caratterizzazione di batteri
caratterizzazione di batteri
coltivabili campionati nelle
coltivabili campionati
diverse stagioni dal sito di
nelle diverse stagioni dal
interesse (DGGE, ARDRA);
sito di interesse (DGGE,
Valutazione della
ARDRA).
biodiversità batterica
a2) Identificazione e selezione
globale mediante estrazione
di particolari gruppi
di DNA dai campioni di
microbici coltivabili come
suolo, amplificazione del
indicatori della
16SrDNA ed analisi
funzionalità del suolo in
mediante DGGE, T-RFLP,
relazione ai cambiamenti
clonaggio e
climatici.
sequenziamento.
b1) valutazione della
biodiversità batterica
globale mediante
estrazione di DNA dai
campioni di suolo e
amplificazione del
16SrDNA ed analisi
mediante DGGE, T-RFLP,
clonaggio e
sequenziamento.
b2) Identificazione e selezione
di particolari gruppi
microbici non coltivabili
come indicatori della
funzionalità del suolo in
relazione ai cambiamenti
climatici
3° anno
a1) valutazione della biodiversità
batterica coltivabile
mediante isolamento e
caratterizzazione di batteri
coltivabili campionati nelle
diverse stagioni dal sito di
interesse (DGGE, ARDRA).
a2) Monitoraggio, mediante
FISH, PCR-in situ e/o PCR
real-time, dei gruppi
microbici coltivabili
selezionati nel secondo
anno come indicatori
biologici.
b1) valutazione della biodiversità
batterica globale mediante
estrazione di DNA dai
campioni di suolo e
amplificazione del 16SrDNA
ed analisi mediante DGGE,
T-RFLP, clonaggio e
sequenziamento.
b2) Monitoraggio, mediante
FISH, PCR-in situ e/o PCR
real-time, dei gruppi
microbici non coltivabili
selezionati nel secondo
anno come indicatori
biologici.
La strategia sperimentale globale adottata durante il 2° anno è riportata nella Figura 1.
Nelle pagine seguenti sono riportati i risultati ottenuti dai tre gruppi di ricerca afferenti alla
UO-04.
2
3
Siti e date di campionamento
1) Agugliano (Ancona)
a. 18 ottobre 2006
b. 18 giugno 2007
Lo schema di campionamento del sito di Agugliano è riportato nella Figura 2.
PARTE B
BLOCCO 1
BLOCCO 2
PARTE A
Figura 2.. Pianta lavorazioni del campo di Ancona (Agugliano)
2. Berchidda (SS)
a. 2 maggio 2007
Lo schema di campionamento del sito di Berchidda è riportato nella Figura 3.
4
5
Gruppo di Ricerca
Laboratorio di Evoluzione Microbica e
Molecolare (LEMM)
Dip.to di Biologia Animale e Genetica
Via Romana 17-19, Università di Firenze
Responsabile:
Prof. Renato Fani
Collaboratori alla ricerca:
Dott.ssa Cristiana Papaleo, Dott.ssa Edda Russo, Dott.
Antonio Frandi, Dott. Marco Fondi, Dott. Matteo Brilli,
Dott.ssa Caterina Di Sabato, Sig.na Fabrizia Riffa, Sig.na
Alice Campani, Sig.na Alessia Magnanini
L’attività di ricerca del Laboratorio di Evoluzione Microbica e Molecolare (LEMM) dell’Università degli
Studi di Firenze, coordinata dal Prof. Renato Fani, ha previsto lo studio e l’analisi della biodiversità genetica
delle comunità microbiche isolate dai campioni di suolo in esame (vedi pag. 5) attraverso due diversi
approcci molecolari di analisi del 16S rDNA amplificato via PCR: 1) l’analisi T-RFLP (Terminal Restriction
Fragment Lenght Polymorphism); 2) la costruzione di librerie di 16S rDNA ed il successivo sequenziamento
dei frammenti clonati per valutare l’effetto di lavorazione e/o concimazione (Agugliano) e l’effetto della
tipologia/copertura vegetale (Berchidda) di suolo sulla microflora batterica; 3) analisi del livello di
trasferimento genetico orizzontale mediato da plasmidi
Le metodologie ottimizzate durante il primo anno di attività sono state utilizzate per lo studio della
biodiversità in tutti i campioni di suolo isolati dai due siti di campionamento nelle tre date riportate a pag 5.
6
Dati relativi alla biodiversità delle comunità microbiche
isolate dai campioni di suolo prelevati ad Agugliano il 18
giugno 2007
Prelievo dei campioni di suolo
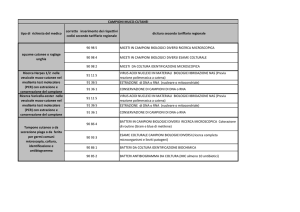
Il terreno scelto per il campionamento, eseguito il 18 giugno 2007 ad Agugliano (AN), è suddiviso in
12 parcelle ognuna delle quali è a sua volta suddivisa in 3 sotto-parcelle fertilizzate con 90 kg/Ha (1U) di
azoto sottoforma di nitrati d’ammonio. Il campionamento del suolo per l’estrazione del DNA è stato eseguito
secondo lo schema riportato nella Tabella 1.
Per ogni campione (campione I: non lavorato - N03, campione II: non lavorato + N03, campione III:
lavorato - N03, campione IV: lavorato + N03), sono state presi in esame 5 sottocampioni, che rappresentano
5 repliche per ogni condizione, per poter valutare anche la variabilità intrinseca di ogni campione. Il totale dei
campioni analizzati è stato quindi pari a 20.
I campioni di suolo sono stati prelevati da una profondità di 0 -20 cm, conservati a 4°C fino all’arri vo
in laboratorio e, successivamente, trasferiti in vaschette di alluminio per permettere l’essiccamento del suolo
stesso, in quanto ricco di argille che non ne permettevano una corretta vagliatura.
Tabella 1. Schema con il quale sono stati eseguiti i campionamenti ad Agugliano (AN) il 18 giugno 2007 e i
diversi livelli di concimazione a cui sono state sottoposte le diverse parcelle.
N.
camp.
2.2.1.
2.2.2.
4.1.1.
4.1.2.
4.1.3.
3.2.1.
3.2.2.
5.3.1.
5.3.2.
5.3.3.
Tipo
lavorazione
Livello
concimazione
(NH4NO3 Kg/ha)
Non lavorato
(Sodo)
0
Arato
0
N. camp.
2.1.1.
2.1.2.
4.3.1.
4.3.2.
4.3.3.
3.3.1.
3.3.2.
5.1.1.
5.1.2.
5.1.3.
Tipo
lavorazione
Livello
concimazione
(NH4NO3 Kg/ha)
Non lavorato
(Sodo)
90
Arato
90
Una volta eliminata l’umidità in eccesso dai diversi campioni di suolo, questi sono stati vagliati,
distribuiti in tubi Falcon da 50 ml sterili e conservati a -80°C fino al momento dell’analisi.
Estrazione del DNA totale dai campioni di suolo
Il primo passaggio della strategia sperimentale ha previsto l’estrazione del DNA totale dal suolo
®
tramite il Fast DNA Kit for soil (BIO101, Inc.); l’estrazione è stata effettuata in doppio su 500 mg di suolo per
ogni campione, e le dimensioni del DNA estratto sono state valutate mediante elettroforesi su gel di agarosio
(0.8%). I dati ottenuti sono riportati nella Figura 4 che mostra la presenza di DNA ad alto peso molecolare
7
(PM) in tutti i campioni di suolo analizzati. La quantità di DNA presente nei singoli campioni è stata
quantificata utilizzando la tecnica biofotometrica. Come per i campioni analizzati l’anno precedente, la
quantità di DNA estratto dai campioni di suolo appare molto variabile, anche all’interno della stessa parcella.
Figura 4. Elettroforesi su gel d’agarosio (0.8%) del DNA estratto da alcuni campioni di suolo prelevati ad Agugliano il 18 giugno 2007.
Prove di amplificabilità del 16S rDNA
Il passo successivo è stato quello di verificare l’amplificabilità mediante PCR del 16S rDNA dai
campioni di DNA. Poichè i migliori risultati sono stati ottenuti, durante l’attività dell’anno precedente,
utilizzando 2 unità di Taq-polimerasi ed una diluizione 1:10 (2 ng) del DNA stampo, il DNA estratto da ogni
campione è stato sottoposto ad una prova di amplificabilità via-PCR utilizzando i primer P0 (8-27f E.coli) e
P6 (1507-1492r E.coli) nelle condizioni di reazione standard. Da tutti i campioni è stato ottenuto un
amplicone delle dimensioni attese di circa 1500 bp (dati non riportati). In tutti gli esperimenti successivi,
relativi alla totalità dei campioni in esame, è stata condotta l’amplificazione del 16S rDNA, amplificazione
utilizzando il primer P0 marcato con 6-carbossifluoresceina (FAM) per la successiva analisi T-RFLP. La
reazione di PCR ha prodotto ampliconi delle dimensioni attese (ca. 1500 bp) in tutti i campioni di DNA
analizzati (dati non mostrati).
Purificazione da gel di agarosio del 16S rDNA amplificato via PCR
Successivamente, per evitare possibili errori di lettura dei profili T-RFLP dovuti alla presenza di
prodotti non specifici, tutti gli ampliconi sono stati purificati da gel di agarosio (combinando per ogni singolo
campione i tre replicati tecnici) mediante il QIAquick Gel Extraction Kit (Qiagen). Il DNA purificato è stato
quindi quantificato mediante elettroforesi su gel di agarosio allo 0,8% e diluito in modo da ottenere soluzioni
di DNA alla concentrazione di 10 ng/microlitro.
Determinazione dei profili T-RFLP dei campioni di suolo
Per la determinazione dei profili T-RFLP aliquote di ognuno dei venti campioni di DNA sono state
trattate con le endonucleasi di restrizione RsaI ed MspI che, precedentemente, avevano dato i migliori
risultati.
I frammenti di restrizione ottenuti dal trattamento con gli enzimi MspI e RsaI sono stati separati
mediante elettroforesi capillare ed i profili T-RFLP ottenuti sono stati analizzati con il software GeneMarker™
SoftGenetics. Nella Figura 5 sono riportati i profili T-RFLP dei campioni 4.1.1. e 4.1.3.
8
Figura 5. Profili T-RFLP ottenuti dal trattamento di tre aliquote del 16S rDNA amplificato dai campione 4.1.1.
(in alto) e 4.1.3. (in basso) e sottoposto alla digestione con l’endonucleasi MspI
Tabella 3. Numero dei frammenti di restrizione del 16SDNA dei venti campioni generati dal trattamento con
gli enzimi RsaI ed MspI.
Parcella
Campione
2
2
2
2
2
3
3
3
3
4
4
4
4
4
4
5
5
2.1.1
2.1.2
2.1.3
2.2.1
2.2.3
3.2.2
3.3.1
3.3.2
3.3.3
4.1.1
4.1.2
4.1.3
4.3.1
4.3.2
4.3.3
5.3.2
5.3.3
N° tot frammenti
N° medio frammenti
N° frammenti
N° frammenti
N° tot
con RsaI
con MspI
frammenti
17
20
17
34
24
0
18
24
16
36
23
14
20
21
284
18
27
20
5
34
14
36
12
27
38
40
13
30
9
6
8
337
18
44
20
37
5
68
38
36
12
45
62
56
49
53
23
26
29
621
20,26
21,06
36,53
9
10
11
Per l’analisi sono stati presi in considerazione i frammenti delle dimensioni da 30 a 500 bp e con una altezza
≥50 Unità di Fluorescenza (FU). Nella Tabella 3 sono riportati tutti i dati relativi al numero dei frammenti di
restrizione generati dai due enzimi RsaI e MspI.
I profili T-RLP sono stati confrontati tra loro in modo tale da poter stabilire delle relazioni di
somiglianza tra i diversi profili (aplotipi). I dati ottenuti sono stati successivamente utilizzati per effettuare una
“cluster analysis” mediante il calcolo del coefficiente di similarità di Jaccard con il quale sono stati costruiti i
due dendrogrammi, riportati nella Figura 6, utilizzando il metodo UPGMA (Unweighted Pair-Group Method
with Arithmetic mean).
I dendrogrammi che si osservano nella Figura 6 sono stati ottenuti considerando la presenza o
l’assenza di segnale relativo alla presenza di frammenti terminali della restrizione del 16S rDNA. Come è
possibile verificare dall’analisi dei dendrogrammi, in uno stesso cluster possono essere presenti profili
ottenuti da parcelle con diversa concimazione e diverso livello di concimazione. Questa situazione viene
riscontrata sia nel trattamento con RsaI che con MspI mettendo in evidenza che a seconda del punto di
campionamento anche all’interno della stessa parcella troviamo popolazioni differenti. Questo può dipendere
dal fatto che il sito di campionamento si trova in collina e non è perfettamente piano quindi al cadere della
pioggia lo scorrere dell’acqua sul terreno funziona come veicolo per il trasporto di nutrienti ed alla variazione
delle condizioni che troviamo nei diversi punti di campionamento
E’ tuttavia interessante notare che il dendrogramma costruito integrando i dati ottenuti con RsaI ed
MspI (Figura 7) rivela che i campioni di “sodo” e “tradizionale” vengono separati, suggerendo che è il tipo di
lavorazione che influisce sulla composizione della comunità microbica residente, mentre il livello di
concimazione sembra avere un ruolo molto meno importante, se non ininfluente.
12
Dati relativi alla biodiversità microbica isolata dai campioni di
suolo prelevati a Berchidda il 2 maggio 2007
Il secondo campionamento, effettuato il 2 maggio 2007 presso Berchidda (SS), ha preso in
considerazione un vigneto lavorato, un vigneto inerbito, una sughereta, un pascolo ed un erbaio (Figura 12 e
Tabella 7). Per ogni sito di campionamento sono stati considerati 5 punti di campionamento dove effettuare il
carotaggio. I campioni di suolo prelevati da una profondità di 0-20 cm sono stati conservati a 4°C e
successivamente vagliati. L’estrazione del DNA dai campioni di suolo è stata effettuata mediante il Fast
®
DNA Kit for soil (BIO101, Inc.). ed i risultati analizzati mediante elettroforesi su gel di agarosio. Da tutti i
campioni analizzati era stato possibile estrarre DNA di PM tale da poter permettere l’amplificazione per PCR
del 16S rDNA.
Tabella 4. Schema con il quale sono stati eseguiti i campionamenti a Berchidda (SS) il 2 maggio 2007
N.
Tipo
camp. lavorazione
VI 1
VI 2
VIGNETO
VI 3
INERBITO
VI 4
VI 5
VL 1
VL 2
VIGNETO
VL 3
LAVORATO
VL 4
VL 5
N.
camp.
SU 1
SU 2
SU 3
SU 4
SU 5
ER 1
ER 2
ER 3
ER 4
ER 5
Tipo
lavorazione
SUGHERETA
N.
camp.
PA 1
PA 2
PA 3
PA 4
PA 5
Tipo
lavorazione
PASCOLO
ERBAIO
13
ER
SU
PA
VI
VL
Figura 8. Fotografia aerea del sito di campionamento in sardegna. Nella foto sono indicati i punti di
campionamento e la posizione dei profili nei vari siti di campionamento.
14
Amplificazione del 16S rDNA dai campioni di suolo
Nell’anno precedente Il 16S rDNA era stato quindi amplificato utilizzando il primer P6 ed il primer P0
M FAM da tutti i campioni utilizzando.
C+ C- I prodotti4diUNITA’
M con gli
marcato con
amplificazione ottenuti sono stati trattai
enzimi RsaI ed MspI, ma i profili T-RFLP devono essere ancora analizzati e lo saranno nel corso del terzo
anno di attività.
15
Dati relativi all’analisi del profilo plasmidico da un campione di
suolo prelevato ad Agugliano il 18 giugno 2007
Analisi del contenuto plasmidico da 1.200 ceppi batterci
I plasmidi sono molecole di DNA extra-cromosomiale a doppia elica generalmente circolari, di
dimensioni variabili, e l’informazione genetica in essi contenuta non è di vitale importanza, si tratta cioè di
geni codificanti per funzioni accessorie come per esempio: resistenza agli antibiotici, enzimi coinvolti nella
fissazione dell’azoto etc. I plasmidi permettono lo scambio dell’informazione genetica in essi contenuta
attraverso trasferimento genetico orizzontale (TGO).
Lo studio dei plasmidi presenti nella microflora batterica del suolo potrebbe permettere di individuare
particolari attività di alcuni microrganismi in relazione all’ambiente in cui vivono e come lo scambio
dell’informazione genetica possa avvenire tra cellule appartenenti alla stessa od a specie diverse.
Una parte dell’attività di ricerca del Laboratorio di Evoluzione Microbica e Molecolare ha previsto
pertanto la valutazione della (eventuale) presenza di molecole plasmidiche all’interno delle cellule batteriche
isolate dal suolo campionato in località Agugliano (AN) il 18 giugno 2007, prendendo in considerazione solo
il suolo che è stato coltivato con mais e non trattato unità con azoto.
La strategia sperimentale utilizzata in questa parte del lavoro è riportata nella Figura 15 ed ha
previsto l’analisi del contenuto plasmidico dei batteri coltivabili. A questo scopo sono state utilizzate le cellule
batteriche isolate dal gruppo di ricerca dell’ENEA (responsabile Dr.ssa Bevivino) su piastre di terreno TSA,
seminando la coltura T.Q. e diluizioni seriali. Le piastre sono state incubate in stufa a 27 °C e monitorate per
i seguenti 5 giorni e ogni giorno è stata eseguita la conta delle colonie. Come risulta dalla relazione dell’anno
precedente, 1.200 colonie sono state isolate su piastre di terreno TSA. L’analisi effettuata precedentemente
aveva rivelato la presenza di plasmidi di dimensioni diverse (variabile tra 2.000 e 20.000 bp) in 41 pool.
16
SUOLO
Campionamento Agugliano (AN) 18 giugno 2007
SODO 0; 90
ARATO 0; 90
Semina delle cellule;
Conta delle colonie; Valutazione
del titolo dei batteri coltivabili in
ogni parcella.
Isolamento di 1200 colonie su
TSA
Inoculo 1200 ceppi
In TSA liquido
30°C ON
Pellet di ogni singolo ceppo
Costruzione di 300 pool da 4
ceppi ciascuno
Identificazione dei
Microrganismi.
Profilo di restrizione
Plasmidico
Estrazione Plasmidica
dai ceppi del POOL
POOL
segnale positivo
Estrazione Plasmidica da POOL
Segnale NEGATIVO
Profilo
ARDRA
Sequenziamento mediante
Pyrosequencing
Figura 16. Strategia sperimentale per l’isolamento e la caratterizzazione di molecole plasmidiche dai ceppi batterici estratti dai campioni di suolo di Agugliano del 18 giugno 2006.
17
L’attività di ricerca del II anno relativa a questa parte del lavoro ha riguardato: 1) la valutazione della
presenza di DNA plasmidico nei 41 pool; 2) l’identificazione e la collocazione filogenetica mediante
sequenziamento ed analisi comparativa 16S rDNA dei ceppi batterici contenenti plasmidi; 3) la tipizzazione
degli stessi ceppi mediante analisi RAndom Amplified Polymorphic DNA (RAPD); 4) l’integrazione dei dati
riguardanti il profilo plasmidico, l’’affiliazione filogenetica e la tipizzazione; 5) la valutazione della
composizione e quindi il livello di biodiversità esistente all’interno della comunità microbica aerobica
coltivabile mediante identificazione di 100 isolati batterici non contenenti plasmidi; ed infine 6) l’elaborazione
di programmi bioinformatici per l’analisi dei dati
Analisi del contenuto plasmidico dei vari pool.
La prima fase del lavoro ha previsto l’estrazione del DNA plasmidico da ognuno dei 164 (41x4)
isolati batterici mediante la metodica della “lisi alcalina”. I dati ottenuti sono riportati nella Figura 9 e
dimostrano che 27 ceppi (pari ad una percentuale del 2% dell’intera popolazione analizzata) contengono uno
o più plasmidi di dimensioni variabili da 2.000 a 20.000 paia di basi (in accordo con i dati ottenuti
precedentemente). La percentuale di presenza plasmidica è molto bassa, inferiore a quella generalmente
stimata per campioni di suolo. L’analisi degli elettroferogrammi rivela inoltre che alcuni isolati batterici
contengono plasmidi delle stesse dimensioni; per quanto non sia possibile, sulla base della sola stima
dimensionale, valutare l’identità delle molecole plasmidiche nei diversi ceppi, è plausibile supporre che
plasmidi con le stesse dimensioni possano corrispondere alla stessa molecola.
Affiliazione filogenetica degli isolati batterici contenenti plasmidi.
Al fine di identificare i 27 isolati batterici che contengono molecole plasmidiche, il 16S rDNA di
ognuno di essi è stato amplificato mediante PCR utilizzando i primer P0 e P6. Come si evince dall’analisi
dell’elettroforesi su gel di agarosio, da ognuno di essi è stato ottenuto un amplicone delle dimensioni attese
(circa 1.500 paia di basi). L’amplicone è stato estratto da gel e successivamente sottoposto a
determinazione della sequenza nucleotidica. Ognuna delle sequenze ottenute è stata confrontata con quelle
contenute nelle banche dati, allineata con le sequenze ortologhe più simili in modo da ottenere degli alberi
filogenetici che potessero affiliare ogni singolo ceppo batterico ad una determinata specie o genere. In tal
modo i 27 ceppi batterici sono stati assegnati a 7 diversi generi (due Gram positivi e cinque Gram negativi)
(vedi Figura 10), questi ultimi tutti appartenenti ai gamma-proteobatteri, suggerendo una limitata
distribuzione filogenetica dei plasmidi. Il significato biologico di tale dato è al momento ignoto e potrà essere
chiarito analizzando la globalità dei dati durante il terzo anno di attività.
Per ognuno di essi è stato costruito un albero filogenetico che ha permsso di posizionarli all’interno di essi.
Un esempio di tali alberi e relativo ai ceppi di Acinetobacter è riportato nella Figura 11, dalla quale si evince
che alcuni degli isolati batterici di Acinetobacter appartenenti alla popolazione microbica in esame e
contenenti plasmidi sono localizzati in punti diversi dell’albero, suggerendo che appartengano a specie
diverse e che, quindi si tratti di ceppi diversi. Altri ,invece, hanno la stessa identica sequenza del 16S rDNA;
questo potrebbe essere una indicazione dell’identità dei ceppi. Per tale motivo è stata effettuata un’analisi
RAPD (vedi paragrafo successivo).
Tipizzazione dei ceppi batteri contenenti plasmidi mediante analisi RAPD
L’acronimo RAPD (Random Amplified Polymorphic DNA) definisce una variante della PCR, descritta
per la prima volta da Williams et al. nel 1990, che viene comunemente utilizzata per produrre marcatori
molecolari in studi di diversità genetica. Il principio di base di questa tecnica è la possibilità di amplificare
18
19
20
21
22
mediante PCR segmenti ignoti di un genoma (batterico e non) utilizzando un singolo oligonucleotide,
generalmente molto corto (10 basi), come innesco. L’amplificazione è resa possibile dal fatto che la reazione
di PCR viene effettuata in condizioni di bassa stringenza, cioè ad una temperatura di appaiamento del
primer molto bassa e, comunque, inferiore alla temperatura di melting dello stesso. In queste condizioni, i
movimenti delle molecole del primer sono sufficientemente deboli da non ostacolare l’appaiamento del
primer anche a sequenze di DNA (migliaia) non perfettamente complementari alla propria.. Queste migliaia
di molecole di primer, legate ognuna ad una regione bersaglio, possono perciò innescare la reazione di
polimerizzazione da parte della Taq polimerasi. Poichè ciò può avvenire su entrambe le eliche del DNA
bersaglio, se due molecole di primer vengono a trovarsi in orientamento opposto sulle due eliche, con le
estremità 3’-OH rivolte l’una verso l’altra, rendono possibile l’amplificazione della regione fra loro compresa.
In generale, quanto maggiore è la complementarietà tra le molecole del primer e le sequenze bersaglio,
tanto maggiore sarà l’efficienza con la quale un segmento di DNA sarà amplificato.
L’effetto finale sarà, quindi, la generazione non di un singolo frammento di amplificazione, come
avviene durante una PCR classica (specifica), ma di una serie di frammenti di differente lunghezza (variabile
tra 100 e 2.000 bp) dovuti ai diversi punti di appaiamento dei primer. I prodotti di amplificazione vengono
visualizzati ed esaminati mediante elettroforesi su gel di agarosio o poliacrilammide dove generano un
profilo a bande (una sorta di codice a barre) che costituisce l’impronta molecolare (molecular fingerprinting)
del microrganismo esaminato. Questa metodica permette perciò di discriminare anche ceppi appartenenti
alla stessa specie (tipizzazione). Per questo motivo la tecnica RAPD è stata utilizzata per ottenere il
molecular fingerrpinting dei 27 ceppi in esame, utilizzando il primer 1253. I profili ottenuti sono riportati nella
Figura 12, in cui i dati plasmidici, di16S rDNA e RAPD sono integrati tra loro, dimostrando che:
1. In alcuni casi (ad esempio Acinetobacter e Paenibacillus) isolati batterici diversi mostrano lo stesso
profilo RAPD, suggerendo che in realtà si tratti dello stesso ceppo. I 27 profili RAPD ottenuti sono
riconducibili a 15 aplotipi (e quindi, presumibilmente, a 15 ceppi) diversi.
2. generalmente ceppi batterici identici contengono plasmidi identici (ad esempio Acinetobacter e
Paenibacillus); in altri casi isolati batterici che mostrano lo stesso profilo RAPD contengono plasmidi
diversi (ad esempio Enterobacter), suggerendo la possibilità di un trasferimento genetico orizzontale tra
cellule dello stesso ceppo o di riarrangiamenti molecolari di un plasmide all’interno dello stesso ceppo.
3. Ceppi diversi della stessa specie possono contenere plasmidi con le stesse dimensioni (ad esempio
Enterobacter 508 e 511 o Acinetobacter). Assumendo che tali plasmidi portino la stessa informazione
genetica (una ipotesi comunque da confermare mediante sequenziamento dei plasmidi stessi), questo
significherebbe il TGO della molecola plasmidica tra ceppi diversi appartenenti alla stessa specie.
4. Apparentemente, e con il beneficio del dubbio di cui al punto 3, solamente ceppi di Acinetobacter e
Klebsiella condividono un plasmide delle stesse dimensioni, suggerendo che un trasferimento genetico
orizzontale tra specie diverse è estremamente limitato nel contesto del campione di suolo analizzato.
23
Analisi filogenetica della comunità microbica coltivabile
Al fine di valutare la composizione e la variabilità genetica della popolazione microbica analizzata un
campione di 100 isolati batterici non contenenti plasmidi è stato oggetto di ulteriore caratterizzazione. A
questo scopo il 16S rDNA è stato amplificato mediante PCR da ognuno dei 100 isolati batterici.
Successivamente, ognuna delle sequenze ottenute è stata confrontata con quelle contenute nelle banche
dati, allineata con le sequenze ortologhe più simili in modo da ottenere degli alberi filogenetici che potessero
affiliare ogni singolo ceppo batterico ad una determinata specie o genere. L’analisi preliminare, tuttora in
corso e che sarà terminata durante il 3° anno di at tività, dimostra l’esistenza di una notevole variabilità
genetica all’interno della comunità microbica isolata, superiore a quella rilevata tra i ceppi portatori di
plasmidi. Differenti specie batteriche, appartenenti sia ai Gram positivi che ai Gram negativi, sono state infatti
identificate.
Messa a punto di un software per l’analisi dei dati
Uno dei punti cruciali del progetto è la messa a punto di software per l’analisi dei dati ottenuti; in particolare,
è stato messo a punto, un nuovo programma bioinformatico per l’analisi dei dati relativi ai plasmidi ed ai
genomi batterici. Tale programmma, denominato Blast2Network (B2N), estremamente versatile permette
l’immediata visualizzazione delle relazioni di omologia esistenti tra molecole di DNA (plasmidiche e/o
cromosomiche). Tale programma è stato utilizzato con successo su un campione di plasmidi noto al fine di
ottimizzare il sistema. Il programma è stato inviato per la pubblicazione sulla rivista BMC Bioinformatics
(vedi avanti) e sarà utilizzato durante il terzo anno di attività per la valutazione delle relazioni esistenti tra
plasmidi e cromosomi caratterizzati nel corso del presente studio.
Durante il terzo anno di attività, la ricerca in questo settore sarà orientata verso la determinazione
della sequenza nucleotidica mediante “pyrosequencing”, al fine di evidenziare le relazioni evolutive esistenti
tra plasmidi in modo tale da tracciarne la loro origine ed evoluzione. Le analisi saranno inoltre rivolte ad
identificare ORF presenti sulla sequenza in modo tale da caratterizzare anche la loro funzione e ruolo
biologico rispetto al microrganismo e la comunità di cui il microrganismo fa parte.
24

![mutazioni genetiche [al DNA] effetti evolutivi [fetali] effetti tardivi](http://s1.studylibit.com/store/data/004205334_1-d8ada56ee9f5184276979f04a9a248a9-300x300.png)