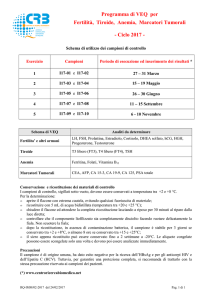
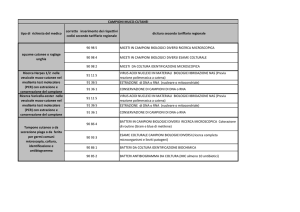
Versione 17.09.07
Modulo 3
Sottostudi di genetica
Per l’attuazione di tali studi si rimanda all’Autorizzazione al trattamento dei dati genetici del
22.02.07 del Garante per la Protezione dei dati personali e al documento (nato dalla
collaborazione SIFO-GlaxoSmithKline): Linee-Guida per la valutazione di una sperimentazione
farmacogenetica del 15/07/04
Promotore dello studio: ______________________________
Lo studio prevede la raccolta di materiale genetico?
SI
NO
Se SI completare i quadri seguenti:
Ambito materiale genetico raccolto od indagato:
- dati genetici
SI
NO
- campioni biologici
SI
NO
- test genetici
SI
NO
- test farmacogenetici
SI
NO
- screening genetico
SI
NO
- consulenza genetica
SI
NO
BASI RAZIONALI DELLA RICERCA
Quali sono le conoscenze già disponibili in letteratura sull’argomento oggetto dello
studio? (presentare in modo sintetico ciò che è ad oggi noto o, in alternativa, l’aspetto
innovativo della ricerca)
..............................................................................................................................................................................................................................
...............................................................................................................................................................................................................................
RILEVANZA CLINICA DELLA RICERCA (Che cosa lo studio si propone di
dimostrare?)
(indicare le finalità del trattamento dei dati genetici, gli scopi della ricerca e i benefici previsti
per i pazienti nello studio, per altri pazienti, per la società)
...............................................................................................................................................................................................................................
...............................................................................................................................................................................................................................
POPOLAZIONE IN STUDIO
Totale dei soggetti coinvolti nello studio, se prevedibile: n°.
Caratteristiche:
Volontari sani
……….
Ambulatoriali
……..
Malati ospedalizzati ………
Minori
SI
1
NO
Versione 17.09.07
Soggetti incapaci di intendere o volere
Range di età
…….
Sesso
MODALITA’ DI TRATTAMENTO DEI DATI
- C’è pertinenza tra i dati/campioni
raccolti e gli scopi perseguiti
SI
NO
M
F
SI NO
- descrivere le modalità di prelievo, custodia e sicurezza dei dati raccolti:
……………………………………………………………………………………………………………
……………………………………………………………………………………………………………
……………………………………………………………………………………………………………
……………………………………………………………………………………………………………
- nel Protocollo sono sufficientemente esplicitate le Misure di Sicurezza da
adottare per la tutela dei pazienti coinvolti?
Misure di Sicurezza sono quelle riguardanti: accesso ai locali ove sono conservati i
dati/campioni, conservazione-utilizzo-trasporto, trasferimento dati in formato elettronico,
consultazione dati genetici in formato elettronico, possibilità o meno di identificare l’interessato
SI NO
DISEGNO DELLO STUDIO E METODICHE CHE SI INTENDONO UTILIZZARE
(gene candidato, analisi di linkage, genome wide scan, ecc)
…………………………………………………………………………………………
…………………………………………………………………………………………
…………………………………………………………………………………………
…………………………………………………………………………………………
…………………………………………………………………………………………
…………………………………………………………………………………
SEQUENZE DI DNA CHE SI INTENDONO INDAGARE (geni, SNPs, Microsatelliti,
VNTR, ecc.)
……………………………………………………………………………………………………
……………………………………………………………………………………………………
……………………………………………………………………………………………………
……………………………………………………………………………………………………
……………………………………………………………………………………………………
……………………………
METODO DI VALUTAZIONE STATISTICA (numerosità del campione, controlli,
valutazione statistica, odd ratio, RR, ecc.)
…………………………………………………………………………………………
…………………………………………………………………………………………
…………………………………………………………………………………………
…………………………………………………………………………………………
…………………………………………………………………………………………
…………………………………………………………………………………
2
Versione 17.09.07
ATTREZZATURE NECESSARIE E/O DISPONIBILI PER ESEGUIRE LO STUDIO
…………………………………………………………………………………………
…………………………………………………………………………………………
…………………………………………………………………………………………
……………………………………………………………………………………
INFORMAZIONI AL PAZIENTE
L’informativa al paziente contiene gli elementi sottoelencati?
esplicitazione analitica di tutti gli scopi dell’indagine
SI NO
risultati che si intendono conseguire
SI NO
periodo di conservazione dei dati/campioni
SI NO
il consenso è libero e revocabile
SI NO
accorgimenti adottati per consentire l’identificabilità degli interessati solo per il
tempo necessario agli scopi della raccolta o del successivo trattamento
SI NO
- eventualità che i dati/campioni siano conservati e utilizzati per altri scopi di
ricerca scientifica e statistica, adeguatamente specificati, anche con riguardo alle
categorie di soggetti ai quali possono essere eventualmente comunicati i dati
oppure trasferiti i campioni
SI NO
-
- possibilità o meno che il campione venga distrutto in caso di revoca del consenso
SI NO
- al paziente è data la possibilità di scegliere se conoscere o meno i risultati che lo
riguardano
SI NO
COMUNICAZIONE DATI/CAMPIONI
- E’ prevista la comunicazione a terzi di dati genetici o la
condivisione/trasferimento di campioni biologici
SI NO
- Chi sono i terzi?
- ………………………………………………………………………………………
………………………………………………………………………………………
……………………………………………………………………………………..
- Quali sono gli scopi della comunicazione/trasferimento dei dati/campioni?
- ………………………………………………………………………………………
………………………………………………………………………………………
……………………………………………………………………………………..
3
Versione 17.09.07
RESPONSABILE DELLA CUSTODIA DEL DNA
…………………………………………………………………………………………
……………………………………………………………………………………..
CRITERI ADOTTATI PER LA ARCHIVIAZIONE E LA CONSERVAZIONE DEL DNA, A
GARANZIA DELL’ANONIMATO DEI CAMPIONI DI DNA
(tipo di codifica adottata per l’anonimato, possibilità o meno di risalire all’identità del
paziente in ogni momento, destino dei campioni a studio terminato, durata della
conservazione ecc.)
………………………………………………………………………………………………………………………………………
ASSICURAZIONE
SI
NO
Si prevede un tacito rinnovo?
SI
NO
L’assicurazione prevede una franchigia?
SI
NO
Esiste un contratto di assicurazione?
(Se SI allegarne copia)
Indicare la data di scadenza
/ / // / // / /
g
m
a
Se non è stata attivata una specifica assicurazione si prevede di utilizzare quella
dell’Azienda Sanitaria in cui lo studio sarà effettuato?
Specificare
SI
NO
.............................................................................................................................................
Firma
del Proponente lo studio
Firma
del Responsabile dell’Unità Operativa
-----------------------------------------
----------------------------------------------
Luogo e data
..........................................
4