PROGRAMMA SVOLTO
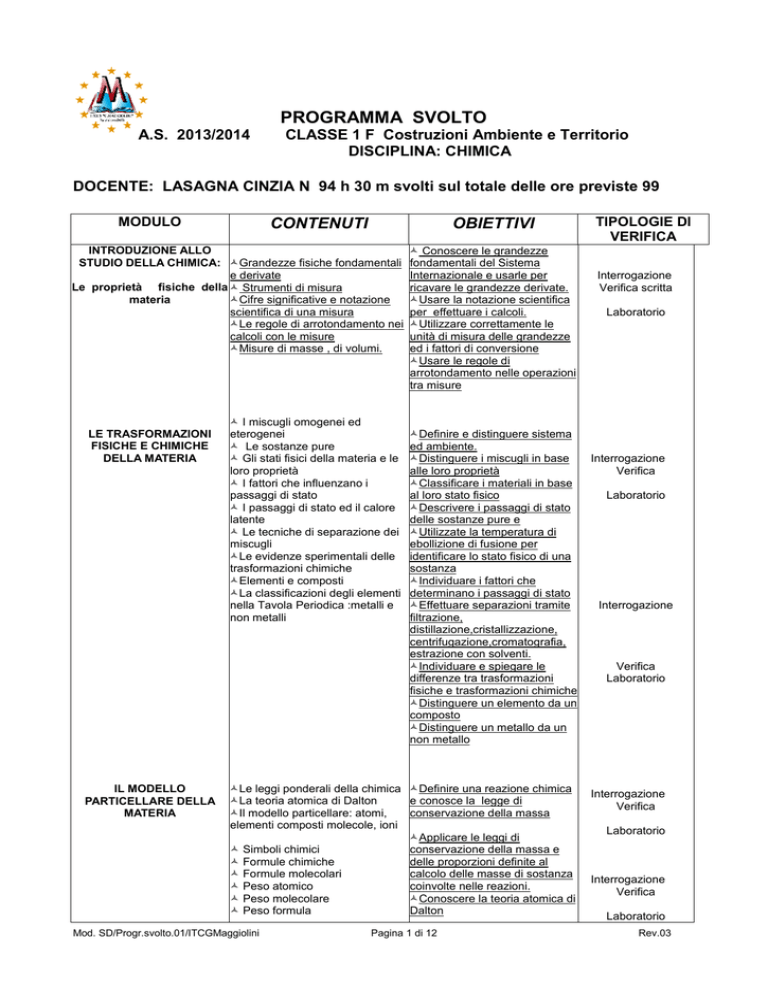
A.S. 2013/2014
CLASSE 1 F Costruzioni Ambiente e Territorio
DISCIPLINA: CHIMICA
DOCENTE: LASAGNA CINZIA N 94 h 30 m svolti sul totale delle ore previste 99
MODULO
CONTENUTI
OBIETTIVI
INTRODUZIONE ALLO
STUDIO DELLA CHIMICA: Grandezze fisiche fondamentali
e derivate
Le proprietà fisiche della Strumenti di misura
materia
Cifre significative e notazione
scientifica di una misura
Le regole di arrotondamento nei
calcoli con le misure
Misure di masse , di volumi.
LE TRASFORMAZIONI
FISICHE E CHIMICHE
DELLA MATERIA
IL MODELLO
PARTICELLARE DELLA
MATERIA
I miscugli omogenei ed
eterogenei
Le sostanze pure
Gli stati fisici della materia e le
loro proprietà
I fattori che influenzano i
passaggi di stato
I passaggi di stato ed il calore
latente
Le tecniche di separazione dei
miscugli
Le evidenze sperimentali delle
trasformazioni chimiche
Elementi e composti
La classificazioni degli elementi
nella Tavola Periodica :metalli e
non metalli
Conoscere le grandezze
fondamentali del Sistema
Internazionale e usarle per
ricavare le grandezze derivate.
Usare la notazione scientifica
per effettuare i calcoli.
Utilizzare correttamente le
unità di misura delle grandezze
ed i fattori di conversione
Usare le regole di
arrotondamento nelle operazioni
tra misure
Definire e distinguere sistema
ed ambiente.
Distinguere i miscugli in base
alle loro proprietà
Classificare i materiali in base
al loro stato fisico
Descrivere i passaggi di stato
delle sostanze pure e
Utilizzate la temperatura di
ebollizione di fusione per
identificare lo stato fisico di una
sostanza
Individuare i fattori che
determinano i passaggi di stato
Effettuare separazioni tramite
filtrazione,
distillazione,cristallizzazione,
centrifugazione,cromatografia,
estrazione con solventi.
Individuare e spiegare le
differenze tra trasformazioni
fisiche e trasformazioni chimiche
Distinguere un elemento da un
composto
Distinguere un metallo da un
non metallo
Le leggi ponderali della chimica Definire una reazione chimica
La teoria atomica di Dalton
e conosce la legge di
Il modello particellare: atomi,
conservazione della massa
elementi composti molecole, ioni
Applicare le leggi di
Simboli chimici
conservazione della massa e
Formule chimiche
delle proporzioni definite al
Formule molecolari
calcolo delle masse di sostanza
Peso atomico
coinvolte nelle reazioni.
Peso molecolare
Conoscere la teoria atomica di
Peso formula
Dalton
Mod. SD/Progr.svolto.01/ITCGMaggiolini
Pagina 1 di 12
TIPOLOGIE DI
VERIFICA
Interrogazione
Verifica scritta
Laboratorio
Interrogazione
Verifica
Laboratorio
Interrogazione
Verifica
Laboratorio
Interrogazione
Verifica
Laboratorio
Interrogazione
Verifica
Laboratorio
Rev.03
LE REAZIONI CHIMICHE
LA MOLE E I CALCOLI
STECHIOMETRICI
LE PARTICELLE
DELL'ATOMO
La legge di Lavoisier
I composti e la legge delle
proporzioni costanti di Proust
-La teoria atomica di Dalton
La legge di Dalton delle
proporzioni multiple
Interpretare una formula
chimica dal punto di vista
qualitativo e quantitativa
Saper rappresentare con il
modello particellare
elementi,composti, miscugli
Spiegare le caratteristiche
macroscopiche e microscopiche
delle principali trasformazioni
fisiche
Il bilanciamento delle reazioni
chimiche
La classificazione formale delle
reazioni chimiche
Il simboli nelle equazioni
chimiche
Utilizzare correttamente il
simbolismo in una equazione
chimica
Bilanciare le equazioni
chimiche
Leggere un’equazione chimica
bilanciata sia sotto l ’aspetto
macroscopico che sotto l'aspetto
La mole
Il numero di Avogadro
La Composizione percentuale
La formula minima
La formula bruta/molecolare
Quantità stechiometriche in una
reazione chimica
Reagente limitante (cenni)
Misurare la massa di un certo
numero di atomi o di molecole
usando il concetto di mole e la
costante di Avogadro
Determinare il numero di moli
in un campione di una sostanza
Calcolare la massa molare di
un elemento e di un composto
Usare la costante di Avogadro
in semplici esercizi
Determinare la composizione
percentuale di un composto
Ricavare la formula minima e
molecolare di un composto
conoscendo la percentuale di
ogni elemento.
Riconoscere il reagente
limitante rispetto alle quantità
stechiometriche
Ricavare dallo stesso sistema
di reazione le quantità chimiche
di reagenti e prodotti
Identificare le particelle
Le particelle subatomiche
atomiche e collegarle alle
Il numero atomico,il numero di rispettive funzioni
massa e gli isotopi
Distinguere Z da A, e isotopi
di un elemento
LA
NOMENCLATURA CHIMICA I principali composti chimici
IUPAC
Riconoscere i principali
composti chimici inorganici
inorganici: ossidi,anidridi,idrossidi, Utilizzare la nomenclatura
idracidi,ossoacidi, sali binari e
IUPAC per denominare i
ternari
principali composti chimici
inorganici
Mod. SD/Progr.svolto.01/ITCGMaggiolini
Pagina 2 di 12
Interrogazione
Verifica
Interrogazione
Verifica
Laboratorio
Interrogazione
Verifica
Laboratorio
Interrogazione
Verifica
Verifica
Rev.03
LA SICUREZZA IN
LABORATORIO
Il regolamento di laboratorio
Le etichette delle sostanze
chimiche ed i simboli di
pericolosità
Le frasi di rischio e di prudenza
I MISCUGLI OMOGENEI
La polarità dell’acqua
Il potere solvente dell’acqua
La tensione superficiale e il
legame a idrogeno
Cogliere le interazioni tra
esigenze di vita e processi
Individuare le fonti
potenziali di pericolo in un
ambiente
Riconoscere i simboli e le
sigle di pericolosità
Applicare le norme di
comportamento idonee a
seconda delle attività svolte
Individuare ed interpretare la
miscibilità e la solubilità di
alcune sostanze in base alla
polarità della molecola
acqua
FIRME STUDENTI
……………………………………
……………………………………
N.
Laboratorio
Verifica
UdA
“ La risorsa acqua”
Laboratorio
Prova UdA
FIRMA DOCENTE
.Parabiago,
03/06/14
ORE DEDICATE AD ALTRE ATTIVITA’:
Area di progetto
Concorsi
Recupero itinere /pausa didattica Totale 8 ore
nel 2° quadrimestre(5+3)
Attività integrative
altro (specificare)
TESTI ADOTTATI E/O IN USO:
Titolo
Autore
Corso di Chimica primo anno
Insegnanti della rete Book in Progress
Mod. SD/Progr.svolto.01/ITCGMaggiolini
Pagina 3 di 12
Casa Editrice
Book in Progress
Rev.03
I.T.C.G.
MAGGIOLINI di PARABIAGO
COSTRUZIONI AMBIENTE E TERRITORIO
CLASSE 1 sez. A Tecnologico A.S. 2012/2013
CHIMICA
Lavoro estivo per gli alunni promossi alla classe seconda.
Ripassare gli argomenti svolti
Risolvere i seguenti esercizi su un quaderno apposito.
N.B.
Il fascicolo e il quaderno con gli esercizi svolti devono essere consegnati i primi giorni di scuola dal
rientro della pausa estiva e contribuiranno alla valutazione del 1° quadrimestre per l'a.s.2013/14
1. Distingui le grandezze del sistema internazionale in fondamentali (F) da quelle derivate (D)
Grandezza
Risposta
Grandezza
Risposta
volume
quantità di sostanza
massa densità
intensità corrente elettrica
Velocità
pressione
tempo
temperatura
2.Approssima i dati alla seconda cifre decimale
Dati
Risposta
Dati
15,197520 m
carica elettrica
Risposta
Dati
68.428 g
12458,897Kg
-1
0,123 s
0.01954 cm
3. Trascrivi accanto ad ogni numero la sua notazione scientifica
Numero
Notazione scientifica
Numero
1,12x10 g
Notazione scientifica
0,0497 m
0,0137 Kg
426,2 g
1234000 mg
30,05 m2
0,0030303 Km
0,000456 L
892,0 mL
0,0000018 m2
4.Esegui le seguenti equivalenze:
Dato
Risultato
Dato
180 L
24,5 L
11Kg
Risultato
ml 12,96 dm3
-5
mg 5,2 x10 Kg/L
Risposta
Dato
Risultato
cm3 18,4 m2
cm2
g/cm3 0,45 g/ml
-8
Kg/ dm3
-2
0,24 Km
mm 56x10 mg
Kg 345,5 x10 g/L
Kg/ml
5. Una fialetta di vetro chiusa ermeticamente contiene 2 g di etanolo,una sostanza che bolle a 79 °C e
fonde a -117 °C. che cosa succede se la fialetta viene riscaldata a 100°C
a. ____________________________________________________________________
b. Come varia la massa dell’etanolo?_________________________________________
c. Come varia la densità?__________________________________________________
6. Scrivi accanto ad ogni sistema la corretta indicazione (ME= miscuglio eterogeneo; MO = miscuglio
omogeneo)
Sabbia + sale
Mod. SD/Progr.svolto.01/ITCGMaggiolini
Pagina 4 di 12
Rev.03
Bronzo
Aria
Maionese
Fumo
Aceto di vino
Acqua marina
Nebbia
Miscela per ciclomotore
7. Indica con una x quali sono i prodotti che ritieni costituiti:
a) da una sola sostanza b) classificali in elementi e composti
Risposta a
Risposta b
Latte parzialmente scremato
Aceto
Trielina
Alcol denaturato
Lattina di fanta
Carta stagnola
Palline di naftalina
8. Uno dei motivi per cui ci si preoccupa del riscaldamento globale è che, aumentando la
temperatura media, l’acqua di mare diventa:
A) meno densa e il livello del mare cresce
B) più densa e il livello del mare cresce
C) meno densa e il livello del mare diminuisce
D) più densa anche se il livello del mare non cresce
9. L’elemento più denso tra quelli noti è l’osmio che ha una densità di 22,48 g/cm3, pertanto un cubo di tale
elemento, avente lo spigolo di 2,54 cm, ha una massa di:
A) 890,0 g
B) 368,4 g
C) 719,7 g
D) 568,7 g
10. La molecola di una sostanza chimica (elemento o composto) possiede tutte le proprietà:
A) chimiche ma non quelle fìsiche della sostanza
B) chimiche e la maggior parte di quelle fisiche della sostanza
C) fisiche ma non tutte quelle chimiche dell’individuo chimico
D) delle specie atomiche che la compongono
11. Una reazione chimica è un processo:
A) che trasferisce tutte le proprietà dei reagenti in quelle dei prodotti
B) modifica spesso le proprietà delle specie che reagiscono
C) non modifica mai la natura degli individui chimici che reagiscono
D) modifica sempre la natura dei composti che reagiscono
12. Completare in modo corretto.
Nelle trasformazioni fisiche, al contrario di quelle chimiche:
A) varia la natura chimica delle sostanze che vi prendono parte ma non la loro energia
B) variano le proprietà fisiche (energia,
posizione, stato fisico, etc.) ma non quelle chimiche delle sostanze
C) varia lo stato fisico ma non l’energia e la posizione di una sostanza
D) variano i legami forti delle sostanze ma non quelli deboli
13. L’aria atmosferica non inquinata è formata da:
A) un miscuglio (miscela eterogenea) di ossigeno, azoto e idrogeno
B) una soluzione di ossigeno e altri gas in tracce (soluti) in azoto (solvente)
C) un miscuglio di ossigeno, ossido di carbonio e azoto
D) una miscela omogenea di ossigeno, azoto e idrogeno
14. Completare in modo corretto. La massa di uno sciatore:
A) varia da luogo a luogo con l’altitudine
Mod. SD/Progr.svolto.01/ITCGMaggiolini
Pagina 5 di 12
Rev.03
B) è sempre costante indipendentemente dal luogo e dall’altitudine
C) dipende dal valore dell’accelerazione di gravità
D) dipende dalla velocità con cui scia
15. In un bicchiere d’acqua è presente un cubetto di ghiaccio galleggiante. Perciò nel sistema in esame:
A) ci sono due fasi
B) c’è una sola fase
C) avendo acqua e ghiaccio la stessa formula non ci sono fasi
D) c’è una sola fase perché il ghiaccio galleggia e non è sul fondo
16. La massa atomica e molecolare delle sostanze chimiche (individui chimici) si misurano:
B) in kg o in u (l’obsoleta u.m.a. o a.m.u.)
D) in unità adimensionali
17. I chimici sono abituali a usare, accanto alla massa atomica e alla massa molecolare, anche le
masse atomiche e molecolari relative (simboli IUPAC: Ar e Mr) chiamandole anche peso atomico
e peso molecolare (a volte ancora indicati con simboli obsoleti P.A. e P.M.). E talvolta si dimentica che si
tratta di unità adimensionali. Individuare l’indicazione corretta del peso molecolare dell’acqua:
A) 18 senza alcuna unità di misura
C) 18 u
D) 18 Da o a.m.u. o u.m.a.
18. La massa molare di un individuo chimico rappresenta:
A) la massa di una molecola di un individuo e si esprime in u
C) la massa di una molecola di un individuo e si esprime in u.m.a. o in dalton
D) la massa di una mole di atomi o di molecole e si esprime con un numero puro (adimensionale
19. Indicare il numero di ioni presenti in 0,1 mg di MgCl2, una massa che, in una buona bilancia
analitica, rappresenta la minima quantità pesabile:
18
A) 1,9 ·10 ioni
17
B) 6,3 ·10 ioni
19
C) 3,2 ·10 ioni
17
D) 5,4 ·10 ioni
20. Completare in modo corretto l’enunciato del principio di Avogadro: volumi eguali di gas
diversi, nelle stesse condizioni di temperatura e di pressione, contengono un egual numero:
A) di atomi
B) di molecole
C) di ioni
D) di molecole solo se sono diatomiche
21. Un composto ha mostrato la seguente analisi elementare: C = 24,3%; Cl = 71,6%; H = 4,07%.
Indicare la sua formula molecolare:
A) CH2Cl2
B) CHCl3
C) CH3Cl
D) C2H4Cl2
22. La molecola di una sostanza chimica (elemento o composto) possiede tutte le proprietà:
A) chimiche ma non quelle fìsiche della sostanza
B) chimiche e la maggior parte di quelle fisiche della sostanza
C) fisiche ma non tutte quelle chimiche dell’individuo chimico
D) delle specie atomiche che la compongono
23. Una reazione chimica è un processo:
A) che trasferisce tutte le proprietà dei reagenti in quelle dei prodotti
B) modifica spesso le proprietà delle specie che reagiscono
C) non modifica mai la natura degli individui chimici che reagiscono
D) modifica sempre la natura dei composti che reagiscono
24. Completare in modo corretto. Nelle trasformazioni fisiche, al contrario di quelle chimiche:
A) varia la natura chimica delle sostanze che vi prendono parte ma non la loro energia
B) variano le proprietà fisiche (energia,
posizione, stato fisico, etc.) ma non quelle chimiche delle sostanze
C) varia lo stato fisico ma non l’energia e la posizione di una sostanza
D) variano i legami forti delle sostanze ma non quelli deboli
25. In un bicchiere d’acqua è presente un cubetto di ghiaccio galleggiante. Perciò nel sistema in esame:
A) ci sono due fasi
B) c’è una sola fase
Mod. SD/Progr.svolto.01/ITCGMaggiolini
Pagina 6 di 12
Rev.03
C) avendo acqua e ghiaccio la stessa formula non ci sono fasi
D) c’è una sola fase perché il ghiaccio galleggia e non è sul fondo
26. La massa atomica e molecolare delle sostanze chimiche (individui chimici) si misurano:
A) solo in kg e sono dell’ordine di 10 kg
B) in kg o in u (l’obsoleta u.m.a. o a.m.u.)
D) in unità adimensionali
26. I chimici sono abituali a usare, accanto alla massa atomica e alla massa molecolare, anche le
masse atomiche e molecolari relative (simboli IUPAC: Ar e Mr) chiamandole anche peso atomico
e peso molecolare (a volte ancora indicati con simboli obsoleti P.A. e P.M.). E talvolta si dimentica che si
tratta di unità adimensionali. Individuare l’indicazione corretta del peso molecolare dell’acqua:
A) 18 senza alcuna unità di misura
C) 18 u
D) 18 Da o a.m.u. o u.m.a.
27. La massa molare di un individuo chimico rappresenta:
A) la massa di una molecola di un individuo e si esprime in u
C) la massa di una molecola di un individuo e si esprime in u.m.a. o in dalton
D) la massa di una mole di atomi o di molecole e si esprime con un numero puro (adimensionale)
28. Dopo aver bilanciato le reazioni rispondere al seguente quesito
Quanti grammi di H2 vengono prodotti dalla reazione tra 11,5 grammi di Na ed acqua La reazione è:
Na + H2O → NaOH + H2
(R= 0,5g)
29. Indicare quanti atomi di ossigeno sono contenuti in una mole di molecole di questo gas.
23
A) 6,02 ·10
23
B) 2 · 6,02 ·10
23
C) 16 · 6,02 ·10
23
D) 32 · 6,02 ·10
13
14
30. I due nuclidi C e N hanno in comune il numero di:
A) protoni
B) neutroni
C) protoni + neutroni
D) elettroni + protoni
23
31. Indicare la massa d’acqua che contiene il numero di molecole più vicino a 6,02 ·10 :
A) 16 g
23
B) 18 ·10 g
C) 18 g
D) 18 kg
32. Un nuclide isotopo di un elemento e lo stesso nuclide isotopo, con una carica positiva, differiscono per il
numero di:
A) protoni
B) elettroni
C) neutroni ed elettroni
D) elettroni e protoni
33. Indicare la massa di 1,70 mol di ammoniaca (NH3 ).
A) 2,89 g
B) 28,9 g
C) 17,0 g
D) 1,70 g
34. Il peso formula del sale da cucina, NaCl, si ottiene:
A) moltiplicando il peso atomico del sodio con quello del cloro
B) sommando il peso atomico del cloro con quello del sodio
C) sommando i numeri di massa di cloro e sodio
D) sommando i numeri di massa di cloro e sodio e moltiplicando il tutto per la costante di Avogadro NA
35. In una comune reazione chimica la somma delle masse dei reagenti:
A) è uguale a quella dei prodotti
B) è minore di quella dei prodotti (difetto di massa)
C) è uguale a quella dei prodotti se nessuno di essi è un gas
D) è uguale a quella dei prodotti se non varia il numero di molecole
36. Indicare la massa di due moli di NaCl (peso formula Fr = 58):
23
A) 58 · 6,02 ·10
B) 116 g
23
C) 58 · 2 · 6,02 ·10
Mod. SD/Progr.svolto.01/ITCGMaggiolini
Pagina 7 di 12
Rev.03
D) 116 g/mol
37. Individuare la miglior definizione di equazione chimica:
A) la descrizione per simboli di una reazione chimica con l’indicazione degli aspetti qualitativi e quantitativi
dei reagenti e dei prodotti della reazione
B) l’equazione usata dai chimici per calcolare quante moli di prodotti si ottengono da una mole di un
reagente
C) l’equazione che permette di calcolare la costante di equilibrio in una reazione di equilibrio
D) l’equazione che mette in relazione la velocità di una reazione con la temperatura
38. Il passaggio di una sostanza dallo stato liquido allo stato solido:
A) avviene con cessione o assorbimento di
energia termica a seconda della sostanza
B) si dice condensazione
C) avviene con cessione di energia termica
D) si dice trasmutazione
39. H2SO4 + Al(OH)3 → Al2(SO4)3 + H2O Dopo aver bilanciato, calcolare quanto Idrossido di Alluminio
Al(OH)3 e' necessario per far reagire completamente 15 g di Acido Solforico H2SO4? Quanto
Solfato di Alluminio Al2(SO4)3 si formerà da tale reazione? ( R= 8,0g 17,4)
40..Un composto avente Mr = 230, all’analisi elementare ha dato i seguenti risultati: C, 62,58 %;H, 9,63 %;
O, 27,79 %. Indicare le sue possibili formule minima e molecolare
PROVA a risolvere questi 2 quesiti
1. In una reazione si fa reagire clorometano (CH3Cl; 0,250 mol) con cloro gassoso Cl2(0,250 mol)
per formare diclorometano (CH2Cl2) e cloruro di idrogeno (HCl). Bilanciare la reazione e calcolarne la
resa (come % in massa), sapendo che si ottengono 12,8 g di CH2Cl2 ( massa effettiva):
FORMULA RESA: (massa effettiva/ massa teorica)x100
oppure(moli effettive/ moli teoriche)x100
A) 102%
B) 80,1%
C) 60,1%
D) 75,0%
2.Calcolare la formula minima e molecolare di un composto formato soltanto da C e H, sapendo che per
1,0g
di C sono contenuti in questo composto 0,17g di H e che il peso molecolare è 112.[R. CH2; C8H16]
LAVORO ESTIVO PER GLI ALUNNI CON LA SOSPENSIONE DEL GIUDIZIO
Ripassare gli argomenti svolti
Risolvere TUTTI i seguenti esercizi su un quaderno apposito.
N.B.
Il fascicolo e il quaderno con gli esercizi svolti devono essere consegnati il giorno della prova finale
che si svolgerà a fine agosto/inizio settembre
Tale lavoro verrà considerato nella valutazione finale.
UNITÀ 1: INTRODUZIONE ALLO STUDIO DELLA CHIMICA
1. Distingui le grandezze del sistema internazionale in fondamentali (F) da quelle derivate (D)
Grandezza
Risposta
Grandezza
Risposta
volume
quantità di sostanza
massa densità
intensità corrente elettrica
Velocità
pressione
tempo
temperatura
carica elettrica
2. Scrivi ad ogni grandezza la corrispondente unità di misura
Grandezza
Unità di misura
Grandezza
lunghezza
massa
temperatura
tempo
quantità di sostanza
densità
Mod. SD/Progr.svolto.01/ITCGMaggiolini
Pagina 8 di 12
Unità di misura
Rev.03
3. Scrivi ad ogni unità di misura il corrispondente simbolo
Unità di misura
Simbolo
Unità di misura
mole
metro
secondo
kilogrammo
kelvin
forza
Simbolo
4. Indica il numero di cifre significative(c.s.) dei seguenti dati:
dati
c.s.
dati
c.s.
dati
3214,45 g
0,000021 s
102,02 m
438,00 Kg
0,2004990 Km
0,0012 L
5. Approssima i dati alla seconda cifre decimale
Dati
Risposta
Dati
Risposta
Dati
Risposta
15,197520 m
68.428 g
12458,897Kg
0,123 s
0.01954 cm
1,12x10 g
-1
6. Trascrivi accanto ad ogni numero la sua notazione scientifica
Numero
Notazione scientifica
Numero
Notazione scientifica
0,0497 m
0,0137 Kg
426,2 g
1234000 mg
30,05 m2
0,0030303 Km
0,000456 L
892,0 mL
0,0000018 m2
180 L
7.Esegui le seguenti equivalenze:
Dato
Risultato
Dato
24,5 L
Risultato
ml 12,96 dm
c.s.
3
-5
11Kg
mg 5,2 x10 Kg/L
0,24 Km
mm 56x10 mg
-8
Dato
Risultato
cm
3
2
18,4 m
g/cm
3
0,45 g/ml
-2
Kg 345,5 x10 g/L
cm
2
Kg/ dm
3
Kg/ml
UNITÀ 2:ASPETTI E TRASFORMAZIONI DELLA MATERIA
1. Indica con una x ciò che non è materia
L’aria
le onde radio
il fulmine
il suono
il fumo
il calore
il rancore
la nebbia
il cielo
il fuoco
il sudore
l’energia
2. Compila la tabella scrivendo si o no facendo riferimento agli stati di aggregazione
Materiali
Ha massa propria? Ha forma propria ? Ha volume proprio?
Indica stato di
aggregazione
Vetro
Metano
Mod. SD/Progr.svolto.01/ITCGMaggiolini
Pagina 9 di 12
Rev.03
Vino
Acciaio
Farina
Mercurio
Aria
Protossido
d’azoto
3. Per essere certi che due sistemi siano costituiti dalla stessa sostanza, quali sono le proprietà che è
opportuno conoscere:
massa , volume,e densità
volume ,temperatura e densità
densità temp. di fusione,temp. di ebollizione
massa,temperatura di fusione,densità
massa temperatura e densità
4. Una fialetta di vetro chiusa ermeticamente contiene 2 g di etanolo,una sostanza che bolle a 79 °C e fonde
a -117 °C. che cosa succede se la fialetta viene riscaldata a 100°C
a. ____________________________________________________________________
b. Come varia la massa dell’etanolo?_________________________________________
c. Come varia la densità?__________________________________________________
5. Associa a ogni trasformazione il nome del passaggio di stato corretto
Solido →
Solido
→
aeriforme
liquido
Liquido →
aeriforme
Aeriforme →
liquido
Aeriforme → solido
Liquido
→ solido
6. Scrivi accanto ad ogni sistema la corretta indicazione (ME= miscuglio eterogeneo; MO = miscuglio
omogeneo)
Sabbia + sale
Bronzo
Aria
Maionese
Latte
Fumo
Aceto di vino
Acqua/iodio/esano
Acqua marina
Nebbia
Miscela per ciclomotore
7. Indica con una x quali sono i prodotti che ritieni costituiti:
a) da una sola sostanza? b) classificali in elementi e composti
Risposta a
Risposta b
Latte parzialmente scremato
Aceto
Trielina
Mod. SD/Progr.svolto.01/ITCGMaggiolini
Pagina 10 di 12
Rev.03
Pepsi-cola
Acqua demineralizzarta
Sale fino
Spaghetti di farina di grano duro
Alcol denaturato
Lattina di fanta
Carta stagnola
Palline di naftalina
8.In base alla reazione chimica zolfo + nichel� solfuro nichelico per ottenere 200 g di solfuro di nichel furono
necessari 129 g di nichel quanti g di zolfo hanno reagito?____________________________________
9.Calcolare la densità (in g/ml) nei seguenti casi:
a) 7 Kg di sostanza occupano 100 cc di volume
b) 0,4 g di sostanza occupano 12 l di volume
3
10.Calcola il volume occupato da un oggetto di alluminio (d= 2,7 g/cm ) la cui massa è di 1,5 kg
3
11. Determina la massa di un oggetto di ferro (d =7,96 g/cm ) che occupa un volume di 2 m
3.
UNITA'3 : TRASFORMAZIONI CHIMICHE E LEGGI PONDERALI
UNITA' 4 : LA MOLE E I CALCOLI STECHIOMETRICI
1. Distingui gli elementi in metalli M , non –metalli NM e semi metalli SM
SOSTANZA
TIPO
SOSTANZA
Bromo
Piombo
Cromo
Silicio
Zolfo
Bario
Alluminio
Boro
Carbonio
Sodio
TIPO
2. Bilanciare le seguenti reazioni
1. ____H3PO3 +____ CuO →____ Cu3(PO3)2 +____H2O
2. ____NaF +____ Mg(OH)2 → ____MgF2 +____ NaOH
3. ____Al(OH)3 + ____H3PO4 → ____ AlPO4 + ____H2O
4. ____AgNO3 +____ FeCl3 →____ AgCl +____ Fe(NO3)3
5. ____Al(OH)3 +___ HCN → ___Al(CN)3 +____ H2O
6. ____H2CO3 +___ Fe(OH)3 → ___ Fe2(CO3)3 +___ H2O
7. ___ HgOH + ___H2S → ___ Hg2S +___ H2O
8. ___H2Cr2O7 +___ KOH → ___ K2Cr2O7 +___ H2O
9. ___H2SO4 + ___LiOH → ___Li2SO4 + ____H2O
10. ___H2S + ___AgNO3 → ___Ag2 S + ____HNO3
A.PESI MOLECOLARI
Calcolare: i pesi molecolari delle seguenti sostanze
FORMULA
PESO MOLECOLARE
FeSO4
Na Cl
(NH4)2SO4
Ca(IO2)2
KBr
Na2CO3
KNO3
Na2CrO4
HClO4
Mod. SD/Progr.svolto.01/ITCGMaggiolini
Pagina 11 di 12
Rev.03
B. ESERCIZI MOLI, MOLECOLE, ATOMI,PESO MOLECOLARE
1. Quanti grammi pesano:
a) 0,2 mol di Idrossido di Magnesio Mg(OH)2
-3
b) 7,3 10 mol di Solfato di Bario BaSO4
2. A quante moli corrispondono :
a) 50 gr di Carbonato di Litio Li2CO3
b) 753 gr di idrossido Ferrico Fe(OH)3
2. Quanti atomi sono presenti in 2 g d’Oro Au
3. Quanto pesano 10
21
atomi di Ferro Fe
4.Quante molecole sono presenti in 120 g di glucosio C6H12O6
5. A quante moli corrispondono e quanto pesano 2 1018 atomi di Rame Cu
6. Qual è la massa in grammi di una mole di ossigeno (O)?
7. Quale dei tre campioni seguenti contiene il numero maggiore di atomi:
5.00 g di Li 5.00 g di Pb 5.00 g di Co?
11. Un campione di acqua contiene 3.14 mol di molecole di H2O. Quante molecole H2O sono presenti?
C. RAPPORTI STECHIOMETRICI MOLARI E PONDERALI
Dopo aver bilanciato le reazioni rispondere ai quesiti proposti
1. Quanti grammi di H2 vengono prodotti dalla reazione tra 11,5 grammi di Na ed acqua La reazione è:
Na + H2O → NaOH + H2 ( 0,5)
2. Quanti grammi di Ossigeno vengono richiesti per bruciare completamente 85,6 grammi di Carbonio?
E quanti grammi di CO2 si formeranno? La reazione è C + O2 → CO2. ( 228,1g 313,7)
3. Fe + O2 → Fe2O3 Dopo aver bilanciato, calcolare che massa di ossido ferrico (Fe2O3) può essere ottenuta
per completa ossidazione di 100 g di ferro. (143,0)
4. Il solfuro di carbonio può essere prodotto dalla seguente reazione: C + SO2 → CS2 + CO Dopo
aver bilanciato, calcolare quanto solfuro (CS2) si può produrre da 450 kg di anidride solforosa (SO2).
(5,2-1,4;267,4)
D.FORMULE MINIME ,COMPOSIZIONE PERCENTUALE
1.Un composto avente Mr = 230, all’analisi elementare ha dato i seguenti risultati: C, 62,58 %;H, 9,63 %; O,
27,79 %. Indicare le sue possibili formule minima e molecolare
2.Calcolare la formula minima e molecolare di un composto formato soltanto da C e H, sapendo che per
1,0g
di C sono contenuti in questo composto 0,17g di H e che il peso molecolare è 112.[R. CH 2; C8H16]
3.Vengono bruciati 5,00 g di saccarosio, un composto che contiene nella sua molecola C, H, O: si
formano 2,894 g di H2O e 7,719 g di CO2. Calcolare la composizione percentuale in peso del
saccarosio.[R. C 42 %, H 6,44 %, O 51,56 %]
Firme studenti
……………………………………
…………………………………….
Parabiago,
03/06/14
Mod. SD/Progr.svolto.01/ITCGMaggiolini
Firma docente
……………………………………
Pagina 12 di 12
Rev.03












