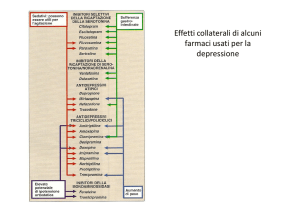
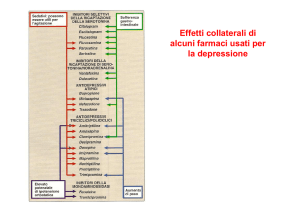
ESEMPI DI FARMACI ANTITUMORALI
METABOLIZZATI DAL SISTEMA DEL CITOCROMO P45O:
Anastrozole
CYP 2C9/CYP 3A4
Ifosfamide
CYP 2B6/ CYP 3A4
Bleomycvin
N/A
Imatinib
CYP 2C9/CYP 3A4
Busulfan
CYP 3A4
Irinotecan
CYP 3A4/UGT 1A1
Capecitabine
Carbossilesterasi citidinesterasi
Methotrexate
ABCC1/ABCG2
Cisplatin
OCT2/ABCC2
Mytomicine C
N/A
Cyclofosfamide
CYP 2B6/ CYP 2C9/ CYP 3A4
Oxaliplatin
OTC2
Docetaxel
CYP 3A4/5 – ABCB1
Paclitaxel
CYP 3A4/ CYP 2C8
Doxorubicine
CYP 3A4/ CYP 2D6 –ABCB1
Tamoxifene
CYP 2D6/ CYP 3A4
Epirubicine
CYP 3A4
Teniposide
CYP 3A4 – ABCB1
Erlotinib
CYP 3A4/ CYP 1A2
Topotecan
CYP 3A4 – ABCB2
Etoposide
CYP 3A4/ABCB1/ABCC1-2
Vimblastine
CYP 3A4 – ABCB1
Fluorouracile
Diidropirimidin deidrogenasi
Vincristine
CYP 3A4/5 – ABCB1
Gefitinib
CYP 3A4/ABCG2
Vinorelbine
CYP 3A4
Gemcitabine
Deamminasi
Istituto di Medicina Genetica Preventiva Personalizzata
Direttore Sanitario Dott. Giuseppe Di Fede
Via Molino delle Armi, 3 - 20123 Milano
Tel. 02 58300445 - 02 58300376
Fax 02 58300670 - [email protected]
www.imbio.it - www.alcat.it - www.imbiolab.com - www.imgep.com
FARMACOGENOMICA
FARMACOGENOMICA
GENI COINVOLTI NEL METABOLISMO DEI FARMACI:
E’ ben noto che pazienti diversi possano rispondere in maniera diversa ad un medesimo farmaco,
I geni che determinano la risposta ai farmaci possono essere distinti in due grandi classi: i geni
generando uno spettro di risposte cliniche in cui gli effetti terapeutici e le reazioni avverse cam-
codificanti per il bersaglio terapeutico primario e quelli codificanti per proteine coinvolte nell’as-
biano da individuo ad individuo.
sorbimento, metabolismo ed escrezione del farmaco. Polimorfismi a carico di questi geni possono
Un farmaco somministrato viene assorbito, distribuito ed eliminato e la sua efficacia dipende dalla
pertanto determinare modificazioni nell’azione di un farmaco, provocando la comparsa di effetti
concentrazione che raggiunge nel sangue e nei tessuti. La farmacocinetica studia le modalità at-
avversi o l’assenza di risposta clinica ad un determinato trattamento.
traverso cui un farmaco dopo la somministrazione viene assorbito, distribuito e eliminato e valuta
Il sistema enzimatico del citocromo P450 ha un ruolo primario nel metabolismo dei farmaci. Que-
la sua concentrazione nei diversi compartimenti corporei. Un’altra branca della farmacologia, la
sti enzimi presenti nel fegato sono responsabili del metabolismo di molti farmaci di uso corrente
farmacodinamica, studia l’interazione del farmaco con i bersagli terapeutici e collaterali. Gli ef-
e di alcuni ormoni come ad esempio il testosterone. Ogni tipo di citocromo ha una propria speci-
fetti dei farmaci dipendono in ultima analisi dalla reazione complessiva con questi tipi di bersagli.
ficità verso la sostanza metabolizzata. I geni che codificano per questi enzimi sono chiamati CYP,
Attualmente si ritiene che la risposta individuale ai farmaci abbia sempre una componente gene-
e nell’uomo ne sono stati identificati a tutt’oggi circa 57 membri suddivisi in diverse famiglie e
tica; così, il background genetico individuale contribuisce alla differente risposta ai farmaci che si
sotto-famiglie.
osserva in pazienti diversi. L’obiettivo di una terapia medica è di massimizzare gli effetti
Polimorfismi in questi geni possono portare alla sintesi di enzimi con attività diverse, in grado di
terapeutici e minimizzare gli effetti collaterali. Oggi è possibile sfruttare il background ge-
metabolizzare più o meno velocemente i farmaci: questo può portare ad un loro accumulo, nel
netico per predire la reazione di un individuo ad un determinato farmaco; la farmacogenomica si
caso di un metabolizzatore lento, oppure alla loro troppo rapida eliminazione, nel caso di un me-
occupa proprio di discriminare i pazienti su base genetica per comprendere l’utilità di un farmaco
tabolizzatore rapido.
e individuare la dose migliore da somministrare al paziente.
Lo studio delle varianti genetiche degli enzimi CYP e’ estremamente importante per valutare in
Attraverso il sequenziamento di ultima generazione (Next Generation Sequencing) è possibile
modo corretto la risposta ai farmaci e la loro tossicità. Queste varianti alleliche sono responsabili
conoscere l’assetto genetico di un individuo; i clinici potranno utilizzare questa informazione per
dell’aumentata risposta e/o tossicità dei farmaci.
decidere la terapia ottimale e personalizzare il dosaggio. I benefici consisteranno in una ridotta
incidenza di reazioni avverse, in migliori esiti clinici ed in costi ridotti. Partendo dalla sequenza
del genoma si arriva quindi a una medicina personalizzata e/o a una medicina di precisione.
La farmacogenomica è dunque la scienza che studia le basi genetiche della variabilità nella ri-
LA FARMACOGENOMICA NELLA TERAPIA ANTITUMORALE:
sposta ai farmaci su scala genomica; è un’evouzione della terapia medica, in cui la componente
La questione dell’ampia variabilità individuale nella risposta ai farmaci è particolarmente impor-
genetica dell’individuo, definibile e misurabile, diventa un elemento di valutazione che indirizza
tante nella terapia antitumorale perchè in questo caso vengono utilizzati farmaci con un indice
l’intervento terapeutico.
terapeutico molto ristretto, nei quali la differenza tra dose efficace e dose tossica è molto sottile.
Le terapie antitumorali convenzionali hanno una ridotta specificità per le cellule tumorali rispetto
ai tessuti sani, provocando in questo modo un danno collaterale alle cellule non cancerogene.
In questi farmaci dal ristretto range terapeutico, la proporzione tra la dose associata all’efficacia
terapeutica e quella responsabile della tossicità è relativamente bassa.
A tal proposito è importante notare che non soltanto i polimorfismi del genoma dell’ospite, ma
anche quelli del genoma del tumore possono influenzare la risposta ai farmaci chemioterapici;
il genoma del tumore possiede la maggior parte dei polimorfismi che influenzano l’aggressività
tumorale e la sua farmaco-sensibilità o resistenza (mutazioni in oncogeni e geni oncosoppressori come ad esempio p53, KIT, EGFR, etc.); i polimorfismi del genoma dell’ospite rappresentano
invece i principali responsabili del rischio di tossicità per il paziente (ad esempio polimorfismi in
geni responsabili del metabolismo come tiopurina metiltransferasi, UDP glucuronosiltransferasi,
glutatione-transferasi etc).