TRANSAMINASI (AMINOTRANSFERASI)
• sono PLP-dipendenti
• agiscono con un meccanismo ping-pong
• catalizzano reazioni reversibili
• sono presenti sia nel citosol che nei mitocondri
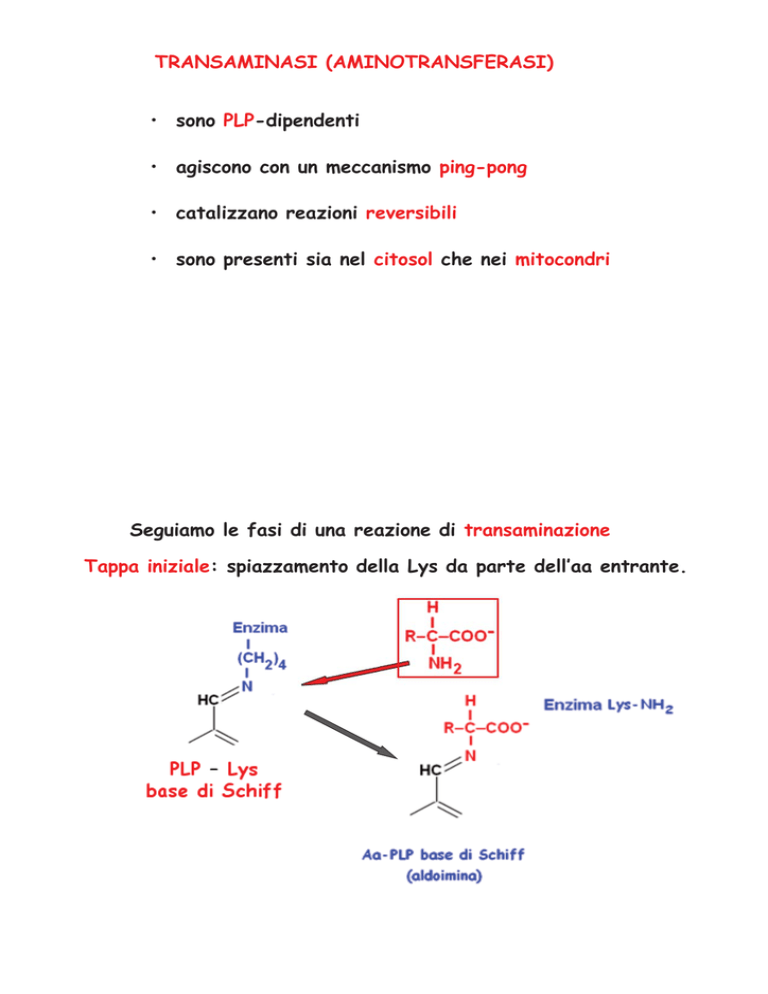
Seguiamo le fasi di una reazione di transaminazione
Tappa iniziale: spiazzamento della Lys da parte dell’aa entrante.
Meccanismo a ping-pong delle transaminasi
Le reazioni di transaminazione sono reversibili e quindi
possono servire per sintetizzare gli aa non essenziali
a partire dai corrispondenti chetoacidi.
La finalità principale delle reazioni di transaminazione è di
raccogliere i gruppi aminici dei diversi aa sul Glu,
che verrà poi trasportato nei mitocondri, dove andrà
incontro ad una reazione di deaminazione ossidativa
ad opera della Glu deidrogenasi (GluDH).
DEAMINAZIONE OSSIDATIVA
La reazione è catalizzata dalla Glu deidrogenasi (Glu DH)
DEAMINAZIONE OSSIDATIVA
AMINAZIONE RIDUTTIVA
La GluDH
- è un enzima mitocondriale
- catalizza una reazione reversibile
- può utilizzare sia NAD+ che NADP+
Generalmente:
- NAD+ interviene nella deaminazione ossidativa
- NADPH nella aminazione riduttiva
La direzione delle reazioni dipende dalle concentrazioni relative
di Glu, α-KG e NH3 e dal rapporto [NAD+]/[NADPH].
La GluDH è regolata allostericamente:
- GDP e ADP sono modulatori positivi
- GTP e ATP sono modulatori negativi
Una bassa carica energetica promuove la degradazione degli aa
e la produzione di energia dai loro scheletri carboniosi.
L’azione combinata delle transaminasi e
della GluDH è detta transdeaminazione.
Serve nella degradazione degli aa.
Al contrario l’azione della GluDH e delle
transaminasi serve nella sintesi degli aa.
La direzione delle reazioni dipende dalle concentrazioni relative
di Glu, α-KG e NH3 e dal rapporto [NAD+]/[NADPH].
La transdeaminazione è la fonte principale di NH3 nei vari tessuti.
Altre fonti sono le basi azotate ed altri composti azotati.
L’NH3 così prodotta deve poi arrivare al fegato, che la eliminerà
sotto forma di urea.
L’NH3 è molto tossica, in particolare per il cervello: essendo
in grado di attraversare facilmente la barriera ematoencefalica,
un incremento dei livelli ematici (5-50 μM) può indurre
- stato comatoso
- edema cerebrale
- aumento della pressione intracranica.
L’NH3 deve quindi arrivare al fegato in una forma non tossica.
Gln e Ala rappresentano le forme di trasporto dell’NH3
dai tessuti extra-epatici e dai muscoli al fegato.
- Gln dalla maggior parte dei tessuti attraverso la reazione
catalizzata dalla Gln sintetasi
- Ala dai muscoli attraverso la transaminazione Pir->Ala
(ciclo Glc-Ala)
Cause della tossicità dell’NH3
• alcalinizzazione
• eccessiva aminazione riduttiva dell’α-KG a Glu
• eccessiva aminazione di Glu a Gln
Alcalinizzazione
A pH fisiologico, quindi, l’ammoniaca è presente
quasi totalmente come ione ammonio
Un eccesso di NH3, che si può verificare come conseguenza
di patologie epatiche (epatiti, cirrosi, etc), determina:
1. aminazione riduttiva dell’ a-KG
2. ulteriore aminazione del Glu a Gln
1. aminazione riduttiva dell’ a-KG, con
sottrazione di questo metabolita dal
ciclo citrico, deleteria per il cervello
2. ulteriore aminazione del Glu a Gln,
anch’essa deleteria per il cervello
Gln è la forma di trasporto dell’NH3
dai tessuti extra-epatici al fegato
La reazione avviene in due tappe
con il J-glutamil-P come intermedio.
La concentrazione ematica di Gln è maggiore rispetto a
tutti gli altri aa.
Oltre che per il trasporto dell’NH3, la Gln serve:
- nella sintesi proteica
- quale fonte di –NH2 in numerose vie biosintetiche
L’eccessiva aminazione di Glu a Gln è deleteria per il cervello
perché provoca deplezione di ATP oltre che di Glu e GABA,
che funzionano da neurotrasmettitori.
Inoltre l’accumulo di Gln esplica una forte azione osmotica
determinando:
- rigonfiamento degli astrociti
- edema cerebrale
- aumento della pressione intracranica
Ricapitolando: l’azione tossica dell’NH3 a carico del SNC
avviene principalmente attraverso:
- aminazione riduttiva dell’α-KG a Glu
- ulteriore aminazione del Glu a Gln con forte effetto osmotico
- deplezione di Glu, GABA e ATP.
Nei reni l’azione di quest’enzima consente l’eliminazione
dell’eccesso di H+ ed il mantenimento dell’equilibrio acido-base
in condizioni di acidosi metabolica.
Infatti NH3 si combina con i H+ per formare ioni NH4+ che
vengono eliminati con le urine.