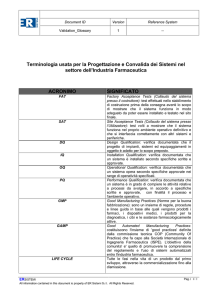
FDA approva Stivarga per i tumori stromali gastrointestinali in fase avanzata
L’FDA (Organo regolatorio USA) il 25 febbraio 2013 ha approvato l’uso di Stivarga
(regorafenib) per il trattamento dei pazienti con tumori stromali gastrointestinali (GIST) in
fase avanzata che non possono essere rimossi chirurgicamente e non rispondono più ad
altri trattamenti approvati dall’FDA per questa malattia.
Il GIST è un tumore nel quale le cellule cancerose si formano nel tessuto del tratto
gastrointestinale, parte del sistema digestivo. Secondo il National Cancer Institute si stima
che ogni anno negli Stati Uniti si verifichino 3.300 – 6000 nuovi casi di GIST, più spesso
negli anziani.
Stivarga, un inibitore multi chinasi, blocca diversi enzimi che favoriscono la crescita del
cancro. Grazie a questa nuova approvazione Stivarga è destinato a essere usato in
pazienti il cui GIST non può rimosso chirurgicamente o si è diffuso ad altre parti del corpo
(metastasi) e non risponde più a Glivec (imatinib) e Sutent (sunitinib), altri due farmaci
approvati dall’FDA per il trattamento dei GIST.
“Stivarga è il terzo farmaco approvato dall’FDA per il trattamento dei tumori stromali
gastrointestinali” ha detto Richard Pazdur, MD, Direttore dell’Ufficio dei prodotti di
Ematologia e Oncologia nel Centro dell’FDA per la valutazione del Farmaco e della
Ricerca. “Stivarga fornisce un’opzione importante di nuovo trattamento per i pazienti con
GIST per i quali altri farmaci approvati non sono più efficaci”.
Stivarga è stato valutato dall’FDA con la procedura di priorità, che permette una revisione
accelerata in sei mesi per quei farmaci che possono fornire una terapia sicura ed efficace,
quando non esiste terapia alternativa soddisfacente o che possono offrire un
miglioramento significativo rispetto ad altri farmaci in commercio. Il farmaco è stato
designato come farmaco orfano perché è destinato a curare una malattia rara.
La sicurezza e l'efficacia di Stivarga per quest’uso sono state valutate in uno studio clinico
su 199 pazienti con GIST che non poteva essere rimosso chirurgicamente e che è andato
in progressione dopo trattamento con Glivec o Sutent. I pazienti sono stati randomizzati
per ricevere o Stivarga o un placebo. Tutti i pazienti hanno anche ricevuto ottimale terapia
di supporto, che include trattamenti per gestire gli effetti collaterali e i sintomi del cancro.
I pazienti arruolati nello studio hanno assunto Stivarga o placebo fino a quando il cancro
ha avuto progressione o gli effetti collaterali sono diventati inaccettabili. I risultati hanno
dimostrato che i pazienti che hanno assunto Stivarga hanno avuto un ritardo nella crescita
del tumore (sopravvivenza libera da progressione), che è stato, in media, di 3,9 mesi
rispetto ai pazienti trattati con placebo. Ai pazienti che hanno ricevuto il placebo è stata
data la possibilità di passare a Stivarga quando il loro cancro è andato in progressione
Gli effetti collaterali più comuni riportati nei pazienti trattati con Stivarga sono stati
debolezza e affaticamento, sindrome mani-piedi (detto anche eritrodisestesia palmoplantare), diarrea, perdita di appetito, pressione alta, ulcere della bocca, infezioni,
variazioni nel volume della voce o nella qualità di tono, dolore, perdita di peso, dolore di
stomaco, eruzioni cutanee, febbre e nausea.
Effetti indesiderati gravi, che si sono verificati in meno dell’uno per cento dei pazienti, sono
stati danni al fegato, gravi emorragie, formazione di vesciche e desquamazione della pelle,
pressione arteriosa molto alta che richiedeva il trattamento di emergenza, attacchi di cuore
e perforazioni intestinali.
Stivarga è stato approvato nel Settembre 2012 per il trattamento del cancro del colonretto. E’ commercializzato da Bayer HealthCare Pharmaceuticals, con sede nel Wayne,
NJ. Gleevec è commercializzato da Novartis con sede a East Hanover, NJ e Sutent è
commercializzato da Pfizer, con sede a New York City.
Per maggiori informazioni:
FDA: Office of Hematology and Oncology Products
FDA: Approved Drugs: Questions and Answers
NCI: Gastrointestinal Stromal Tumors
La FDA, l'agenzia del Dipartimento della Salute e Servizi Umani, protegge la salute pubblica garantendo la
sicurezza, l'efficacia dei farmaci per uso umano e veterinario, vaccini e altri prodotti biologici per uso
umano, e dispositivi medici. L'agenzia è anche responsabile per la sicurezza dell'approvvigionamento
alimentare della nostra nazione (US), cosmetici, integratori alimentari, prodotti che emettono radiazioni
elettroniche, e per la regolamentazione dei prodotti del tabacco.
http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm340958.htm