RADIOATTIVITA’ E DECADIMENTI NUCLEARI
CIMMINO
EMMA
CICATIELLO MADDALENA
VITOLO
LEA
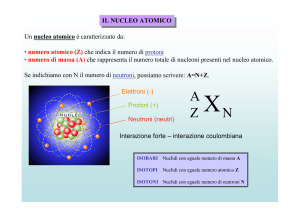
La radioattività è un insieme di processi tramite i quali dei nuclei atomici instabili, detti nuclidi,
emettono particelle subatomiche per raggiungere uno stato di stabilità.
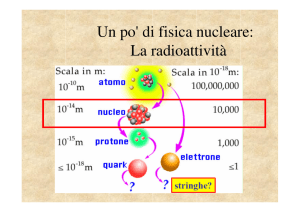
Ogni atomo è formato da un nucleo contenente protoni e neutroni, e da un certo numero di elettroni
che gli orbitano intorno. Essendo tutti carichi positivamente i protoni tendono a respingersi per via
della forza di Coulomb e, se non ci fossero altre forze a tenerli uniti, i nuclei non sarebbero stabili,
quindi affinchè restino uniti si deve ammettere l’esistenza di forze a corto raggio di azione molto
più intense di quelle coulombiane. Heisenberg per primo formulò l’esistenza di tale forza nel 1932
che prende il nome di forza nucleare forte. Questa a differenza della forza gravitazionale e e.m. è
esauribile avendo un raggio di azione di 10 15 m , quindi agisce solo tra protoni che si trovano in
questo raggio di azione.
Oltre un certo numero atomico non possono esistere nuclei formati da soli protoni, così viene
giustificata la presenza dei neutroni che hanno una funzione compattatrice esercitando solo forze
nucleari e non avendo carica elettrica. La loro presenza è tanto più necessaria quanto più è grande il
numero atomico, infatti al crescere di questo cresce anche il rapporto tra numero di neutroni e
protoni. Si osserva inoltre che tra due isotopi il più stabile è quello avente maggiore numero di
massa. Comunque tutti gli isotopi con un numero di protoni maggiore di 83 sono instabili.
Quando le forze all'interno del nucleo non sono
bilanciate (ovvero il nucleo è instabile) questo tende
spontaneamente a raggiungere uno stato stabile
attraverso l'emissione di una o più particelle. Così
alcuni nuclei sono stabili e altri instabili perché la
combinazione di protoni e neutroni non è “corretta”,
ovvero i neutroni non riescono a compensare, legandosi
ai protoni, la repulsione tra i protoni stessi, che si
esplica tra tutti, dato che è a lungo raggio. Per i nuclei
con numero di massa A < 40 (Z<20 e N<20) il numero
di protoni e quello di neutroni sono uguali o quasi. Per i
nuclei con A>40 il numero di neutroni supera il numero
di protoni, per cui i nuclei corrispondono a punti del
grafico che si trovano al di sopra della retta N=Z.
Il nucleo ha una energia che impedisce ai nucleoni di andare ognuno per conto proprio, questa è
detta appunto energia di legame Eleg di un nucleo è data dalla formula Eleg m c 2 secondo la
relazione di Einstein tra massa e energia, dove m è la differenza tra la massa totale dei nucleoni
che formano quel nucleo e la massa effettiva del nucleo .
L’energia media di legame per nucleone è il rapporto tra l’energia totale di legame del nucleo e il
numero di nucleoni che lo formano, cioè Eleg A . Tale energia media di legame fornisce
un’indicazione sulla diversa stabilità dei nuclei: quanto maggiore è Eleg A , tanto più fortemente
sono legati tra loro i nucleoni nel nucleo.
Storicamente i decadimenti nucleari sono stati raggruppati in tre classi principali:decadimento alfa,
decadimento beta e decadimento gamma.
Per radiazione si intendono particelle cariche positivamente che vengono emesse nei
decadimenti radioattivi. Esse sono costituite da due neutroni e due protoni; sono per loro natura
facilmente fermate da un foglio di carta ovvero dallo strato morto della pelle. Sono pericolose
soltanto se i materiali emettitori sono introdotti nell'organismo.
4
Schematicamente si ha: AZ X A-4
Z-2Y + 2 He
Cioè si emettono di nuclei di elio; sono soprattutto i nuclei pesanti (A > 200) e deficienti in
234
neutroni ad essere interessati da questo processo nucleare, ad esempio 238
92U 90Th ;
Per radiazione si intendono elettroni o
positroni emessi nei decadimenti radioattivi. Sono
molto più penetranti delle particelle ma
possono essere fermati da sottili strati di materiali
(acqua, vetro, metallo etc.). L'introduzione nel
corpo di materiali -emettitori può essere
pericolosa ma molto meno di quella degli emettitori.
Schematicamente i Decadimenti e sono
rispettivamente:
A
A
Z X Z 1Y
+ e-
e
A
A
Z X Z-1Y
+ e+
A
Y+ .
(con emissione di elettroni o positroni) oppure la cattura elettronica: AZ X + e- Z-1
Quando il numero di neutroni, per nuclei non troppo pesanti, supera di molto il numero di protoni,
entra in gioco il fatto che il neutrone ha una massa maggiore di quella del protone e quindi il nucleo
tende a decadere verso un nucleo che con un protone in più ed un neutrone in meno è più stabile.
Per raggi si intendono radiazioni elettromagnetiche simili alla luce e alle onde ma di lunghezza
d’onda più corta. I raggi sono molto più penetranti dei raggi e . Soltanto materiali ad alta
densità quali il piombo, sono in grado di fermarli. La loro pericolosità è strettamente connessa con
l’elevata capacità di penetrazione che essi hanno nei vari materiali, tessuti viventi compresi.
Mentre il decadimento alfa ed il decadimento beta cambiano il numero di protoni nel nucleo e
quindi il numero di elettroni che vi orbitano attorno, cambiando così la natura chimica dell'atomo
stesso, il decadimento gamma avviene fra stati eccitati dello stesso nucleo e comporta solo la
perdita di energia.
I raggi alfa e beta sono composti di particelle con carica elettrica, perciò interagiscono quasi
immediatamente con la materia circostante, e vengono assorbiti quasi tutti entro una determinata
distanza: i raggi gamma invece vengono assorbiti solo per urto diretto contro un atomo o un nucleo
atomico, e percorrono distanze molto maggiori. Inoltre non esiste una distanza limite per il loro
assorbimento ma vengono assorbiti esponenzialmente, cioè all'aumentare del cammino percorso dal
fascio, "sopravvive" una frazione sempre più piccola (ma sempre diversa da zero) delle particelle
originarie.
Il primo scienziato a osservare il fenomeno della radioattività fu il francese Antoine Henri
Becquerel durante uno studio sulle relazioni intercorrenti tra fosforescenza e Raggi X nel 1896.
Studiando da tempo il cristallo voleva verificare se anche questo fosse in grado di emettere raggi
X. L’esperiento doveva svolgersi in piena luce solare volendo far riflettere il sole sui cristalli per
verificarne le radiazioni luminose, ma il cielo era nuvoloso e Bequerel dovette aspettare per poter
eseguire l’esperimento. Così lasciò i cristalli in un cassetto insieme a una lastra fotografica in una
busta.
Le lastre fotografiche sono ricoperte da una sostanza che si modifica quando viene colpita dalla
luce o dai raggi X.
Vedendo che il tempo non migliorava Bequerel perse spazientito sviluppò la lastra senza pensare
in realtà di ottenere dei risultati. Rimase sorpreso vedendo che la lastra era ricoperta da macchie
nere. Ne dedusse che qualcosa aveva emesso delle radiazioni nel buio del cassetto e dato che sulla
lastra si trovava solo un cristallo e di capì che l’elemento del cristallo che aveva provocato queste
radiazioni era l’uranio usato per la colorazione di questo.
Nel 1898 Pierre e Marie Curie annunciarono la scoperta di due elementi radioattivi, il radio e il
polonio, da loro isolati dalla pechblenda, un minerale dell’uranio. Successivamente lo scienziato
neozelandese Ernest Rutherford identificò le radiazioni emesse dalle sostanze radioattive in
emissioni alfa e beta e i suoi esperimenti lo portarono ad ipotizzare una nuova struttura nucleare.
Il decadimento radioattivo tende a prodursi in famiglie (o catene o serie) radioattive: ciascun
decadimento o di un atomo progenitore (o padre) genera un atomo discendente (o figlio) che
è esso stesso radioattivo.
Esempio tipico: è quello che si vede nella figura
, in cui l’ 235
92 U quando decade, passa attraverso
vari nuclei intermedi prima di raggiungere
l’elemento stabile finale della serie, il 207
82 Pb . Si
può osservare che alcuni nuclei intermedi
possono decadere in un solo modo, mentre altri
hanno due possibilità di decadimento.
DECADIMENTO ALFA
Il decadimento alfa avviene tramite l'emissione di una particella, detta appunto particella alfa,
composta da due protoni e due neutroni legati dalla forza forte, da parte dell'isotopo di un elemento
con elevato numero atomico(Z>83). Perdendo due protoni l'elemento indietreggia di due posizioni
nella tavola periodica degli elementi. Le ragioni di tale fenomeno sono da ricercare nella tendenza
di tutti i sistemi fisici a cercare condizioni di energia più stabile.
La vita media tipica di questo tipo di decadimento nucleare è abbastanza varia, si passa, infatti dagli
oltre 1010 anni del torio, fino alle frazioni di secondo come , ad esempio, nel polonio 214 (1.6 x 10-4
s). Il decadimento più noto è però quello dell'uranio:
La teoria che sta alla base di tale decadimento è stata sviluppata dal fisico ucraino George Gamow e
si basa sull'effetto tunnel.
L'effetto tunnel è un effetto quanto-meccanico che permette una transizione ad uno stato impedita
dalla meccanica classica.
Nella meccanica classica la legge di conservazione dell'energia impone che una particella non possa
superare un ostacolo (barriera) se non ha l'energia necessaria per farlo. Questo corrisponde al fatto
intuitivo che, per far risalire un dislivello ad un corpo, è necessario imprimergli una certa velocità
ovvero cedergli dell'energia.
La meccanica quantistica invece prevede che una particella abbia una probabilità, piccola ma finita,
di attraversare spontaneamente una barriera arbitrariamente alta e quindi che possa violare
temporaneamente il principio di conservazione dell'energia.
Infatti, applicando i postulati della meccanica quantistica al caso di una barriera di potenziale in una
dimensione, si ottiene che la soluzione dell'equazione di Schrödinger all'interno della barriera è
rappresentata da una funzione esponenziale decrescente. Dato che le funzioni esponenziali non
raggiungono mai il valore di zero si ottiene che esiste una piccola probabilità che la particella si
trovi dall'altra parte della barriera dopo un certo tempo t.
Quello che è interessante notare è che non è mai possibile osservare una particella mentre attraversa
tale barriera perché, come la meccanica quantistica prevede (principio di indeterminazione di
Heisenberg), l'atto stesso di osservare tale particella ne perturba lo stato. È di conseguenza possibile
osservare tale particella prima e dopo tale transizione ma non mentre la effettua.
Si può immaginare che una particella in un nucleo sia come una pallina intrappolata all’interno
della buca di potenziale. Prendiamo come esempio il nucleo di 226 Ra il quale si trasforma in
222
Rn emettendo una particella α di energia cinetica E = 4.784 MeV che corrisponde alla
α
transizione tra i due stati fondamentali.
Ora, chiamando con mP la massa del radio e con mD quella del radon, si possono scrivere alcune
relazioni energetiche:
Etotf = mαc2 + mDc2 + Tα
Etoti = mPc2
Prima di scendere nel dettaglio, si supponga di avvicinare due atomi di deuterio: si otterrà una
particella α: ogni reazione di questo tipo dà una energia di circa 10 MeV. I due atomi, per unirsi,
devono però superare la così detta barriera coulombiana, che è anche la barriera che deve superare
la particella α per poter uscire dal nucleo decadente.
La barriera coulombiana (in verde l'energia cinetica della particella α)
e per la conservazione dell'energia:
e quindi il decadimento avviene solo quando la massa del nucleo che decade (massa iniziale) è
maggiore della somma delle masse dei nuclei prodotti.
Ogni volta che la pallina urta la barriera essa rimbalza. La probabilità che ogni urto determini il
tunneling (effetto secondo cui i nucleoni possono scavarsi profonde gallerie e lasciarsi alle spalle le
barriere di potenziale) attraverso la barriera, con conseguente uscita della particella, è piccola. Ma la
particella compie molti urti contro la parete nell’unità di tempo. Se la sua energia E è maggiore di
zero, come nella figura, la particella finirà per attraversare la barriera. Quando lo fa, la particella si
trova fuori dal raggio di azione della forza nucleare e quindi risulta soggetta solamente alla forza
coulombiana dovuta alle cariche positive che porta e al nucleo restante. Così la particella viene
fortemente respinta e si allontana dal nucleo con notevole energia (energia cinetica di 2 7 MeV).
L’energia liberata nel processo di decadimento è detta energia di disintegrazione.
DECADIMENTO BETA
Il decadimento β è uno dei processi per cui nuclei instabili (e dunque radioattivi) si trasformano in
altri nuclei di atomi che possono a loro volta essere radioattivi oppure stabili. In natura i nuclei sono
all'interno degli atomi e questo processo causa la trasformazione dell'intero atomo da un elemento
chimico ad un altro.
Più precisamente, il decadimento beta avviene tramite la trasformazione di un neutrone in una
coppia protone-elettrone più un antineutrino elettronico. Il protone resta nel nucleo atomico, mentre
le altre due particelle vengono espulse (emesse). Esempio di questo è il decadimento dell'isotopo
cobalto-60 (instabile) nell'isotopo nichel-60 (stabile), che segue questo schema:
Dato che i neutrini interagiscono debolmente con la materia, quando Marie Curie osservò per la
prima volta questo tipo di decadimento lo associò alla sola emissione di un elettrone; fu Enrico
Fermi che, seguendo un'idea di Wolfgang Pauli, introdusse l'idea del neutrino per risolvere
un'apparente contraddizione fra i risultati sperimentali ed il principio di conservazione dell'energia.
Negli anni successivi alla scoperta della radioattività è stato osservato un diverso comportamento
delle particelle emesse dalle sostanze radioattive durante il decadimento. In molti casi gli strumenti
di rivelazione mostravano la presenza di tracce simili a scie: quando era applicato un campo
magnetico, le tracce provenienti da alcune sostanze radioattive avevano la curvatura rivolta verso un
lato, altre avevano una curvatura rivolta nel verso opposto alle prime. Ai raggi associati alle tracce
deviate da una parte è stato convenzionalmente dato il nome di raggi alfa, a quelli le cui tracce
erano deviate dall'altra parte quello di raggi beta; ai rimanenti, il nome di raggi gamma. La natura
delle particelle emesse e dei decadimenti è radicalmente diversa nei tre casi. La scoperta dei
processi che avvengono all'interno del nucleo per dar luogo a questi decadimenti ha richiesto
notevoli ricerche agli inizi del ventesimo secolo. Queste ricerche hanno portato alla conoscenza del
fatto che la scia emessa nel caso dei raggi beta è dovuta al fatto che viene emesso un elettrone nel
corso del decadimento beta. Il motivo per cui i tre tipi di raggi sono deviati in modo diverso dipende
dalla diversa carica elettrica che hanno le particelle emesse: positive (si tratta di particelle alfa) nel
caso decadimento alfa, negative (elettroni) nel caso del decadimento beta e neutro (si tratta di
fotoni) nel caso del decadimento gamma.
Lo studio sul decadimento Beta fu realizzato da Enrico Fermi.
Oggi i decadimenti vengono classificati come beta (β) non più in base alla carica negativa della
particella emessa bensì in base al particolare tipo di processo nucleare che avviene tramite
interazione debole.
In natura l'unico decadimento che si osserva spontaneamente è quello
in cui un neutrone si trasforma in un protone e viene emesso un elettrone ed un anti-neutrino e
prende il nome di decadimento beta meno.
Normalmente il neutrone coinvolto si trova in un nucleo di un atomo e quello che si verifica, oltre
alla emissione delle due particelle, è che l'atomo si trasforma in quello di un altro elemento (in
quello con numero atomico (Z) successivo). La somma dei protoni e dei neutroni (A) all'interno del
nucleo rimane invariata.
Tuttavia viene osservato anche il seguente decadimento:
in cui un protone legato si trasforma in un neutrone legato, un positrone ed un neutrino. Il positrone,
che è l'antiparticella dell'elettrone ha carica positiva, pertanto questo decadimento viene indicato
con il termine beta più (β+). È importante sottolineare che il decadimento beta più può avvenire, per
motivi cinematici (conservazione dell'energia), solo per nucleoni legati.
Un altro processo correlato, anche se non si tratta di decadimento, ma di cattura è
chiamato cattura elettronica. Per certi versi quest'ultimo processo è del tutto simile a quello del
decadimento beta più.
Parliamo ora del decadimento beta meno che è quello molto più frequente rispetto agli altri, a tal
punto che spesso ci riferisce a questo con il solo nome di decadimento beta. Tuttavia gli stessi
ragionamenti, con le dovute modifiche, valgono anche nel caso del decadimento beta più e in alcuni
casi anche per la cattura elettronica
Il decadimento che si osserva è quello del neutrone, che apparentemente decade in un protone ed in
un elettrone:
n → p + eIn questo caso, lo spettro dell'elettrone uscente dovrebbe essere una riga, poiché
mec2 (0,5 MeV) << mpc2 (938,3 MeV) circa mnc2 (939,6 MeV)
Supponendo che il neutrone sia fermo, si può ragionevolmente ritenere che anche il protone creato
sia immobile, quindi l'unica particella a muoversi è l'elettrone. Quindi, per la conservazione
dell'energia si ha:
mnc2 = Ep + Ee
con
Trascurando il rinculo del protone si ha:
dove l'unica incognita è l'impulso dell'elettrone e quindi lo spettro risulta una riga (in pratica si
sarebbe dovuto osservare un picco).
Sperimentalmente, però, si osserva qualcosa di diverso: uno spettro completo che parte da 0 per
salire, raggiungere un massimo e quindi ritornare ad annullarsi in corrispondenza di un valore
massimo che è circa 5 volte e mezza la massa dell'elettrone.
Questo risultato portò enorme scompiglio nella comunità scientifica, e il primo a riprendersi fu
Bohr, che suggerì la presenza di una violazione nella conservazione dell'energia. In realtà sia Fermi,
sia Pauli supponevano che il decadimento non fosse a due corpi, come osservato, ma a tre: ovvero i
prodotti della reazione ci fosse una terza particella, piccolissima, di carica neutra e non rilevabile
con le strumentazioni usuali: il neutrino.
La reazione, allora, deve essere corretta nel modo seguente:
mentre la conservazione dell'energia diventa:
dove si trascura la massa del neutrino.
Appare evidente come, in questo caso, le variabili siano due e viene pertanto ovviamente spiegato
lo spettro osservato come di un processo a tre e non a due corpi. Tra l'altro, ponendo nullo l'impulso
del neutrino, si riesce a calcolare l'impulso massimo dell'elettrone che risulta consistente con il
valore sperimentalmente trovato.
Il decadimento β avviene spontaneamente, senza necessità di energia esterna per attivarsi. La vita
media del neutrone è τn=887 s, e, ovviamente, si riferisce al neutrone libero: esso, infatti, all'interno
del nucleo atomico, è assolutamente stabile.
L'interazione delle particelle beta con la materia ha generalmente un raggio d'azione dieci volte
superiore, e un potere ionizzante pari a un decimo rispetto all'interazione delle particelle alfa.
Vengono bloccate completamente da pochi millimetri di alluminio.
Il cannone elettronico dei tubi catodici usati nei televisori può essere considerato una sorgente di
radiazione beta, che viene fermata dai fosfori posti all'interno del tubo per creare la luce.
DECADIMENTO GAMMA
Un nucleo formatosi in seguito ad un decadimento radioattivo o può ritrovarsi nel suo stato
fondamentale oppure trovarsi in uno dei suoi stati eccitati. Come avviene per l’atomo, anche il
nucleo si porterà nella configurazione più stabile emettendo radiazione elettromagnetica
corrispondente al salto energetico dei livelli interessati. A questa radiazione elettromagnetica
(E=h) viene dato il nome di emissione gamma . Quindi più che di decadimento è meglio
parlare di emissione .
Nella figura si vede un ragionevole processo di decadimento per 232 U : nella parte (a) della figura
viene emessa una particella . Nella parte (b) la particella cade dal suo livello energetico
iniziale a un livello più basso all’interno del nucleo e viene emesso un fotone , successivamente
viene emessa un’altra particella . Nella parte (c) la particella compie due transazioni
successive mentre il nucleo emette fotoni . Si noti che le energie dei fotoni sono uguali alle
differenze tra le energie delle particelle .
I raggi gamma sono una forma energetica di radiazione elettromagnetica prodotta dalla
radioattività. I raggi gamma sono più penetranti sia della radiazione alfa sia della radiazione beta,
ma sono meno ionizzanti. I raggi gamma si distinguono dai raggi X per la loro origine: i gamma
sono prodotti da transizioni nucleari o comunque subatomiche, mentre gli X sono prodotti da
transizione energetiche dovute ad elettroni in rapido movimento. Poiché è possibile per alcune
transizioni elettroniche superare le energie di alcune transizioni nucleari, i raggi X più energetici si
sovrappongono con i raggi gamma più deboli.
Uno schermo per raggi γ richiede una massa notevole. Per ridurre del 50% l'intensità di un raggio
gamma occorrono 1 cm di piombo, 6 cm di cemento o 9 cm di materiale pressato. In termini di
ionizzazione, la radiazione gamma interagisce con la materia in tre modi principali: l'effetto
fotoelettrico, lo scattering Compton e la produzione di coppie elettrone-positrone.
e gli
col
Effetto fotoelettrico: occorre
quando un fotone gamma
interagisce con un elettrone
orbitante attorno ad un atomo
trasferisce tutta la sua energia,
risultato di espellere
l'elettrone dall'atomo.
L'energia cinetica del
"fotoelettrone" risultante è uguale all'energia del fotone gamma incidente meno l'energia di legame
dell'elettrone. Si pensa che l'effetto fotoelettrico sia il meccanismo principale per l'interazione dei
fotoni gamma e X al di sotto dei 50 keV (migliaia di elettronvolt), ma che sia molto meno
importante ad energie più alte.
Scattering Compton: un fotone gamma incidente espelle un elettrone da un atomo, in modo simile
al caso precedente, ma l'energia addizionale del fotone viene convertita in un nuovo fotone gamma,
meno energetico, con una direzione diversa dal fotone originale. La probabilità dello scattering
Compton diminuisce con l'aumentare dell'energia del fotone. Si pensa che questo sia il meccanismo
principale per l'assorbimento dei raggi gamma nell'intervallo di energie "medie", tra 100 keV e 10
MeV (milioni di elettronvolt), dove va a ricadere la maggior parte della radiazione gamma prodotta
da un'esplosione nucleare. Il meccanismo è relativamente indipendente dal numero atomico del
materiale assorbente.
Produzione di coppie: interagendo con la forza coulombiana del nucleo, l'energia del fotone
incidente è convertita nella massa di una coppia elettrone/positrone (un positrone è un elettrone
carico positivamente). L'energia eccedente la massa a riposo delle due particelle (1.02 MeV) appare
come energia cinetica della coppia e del nucleo. L'elettrone della coppia, in genere chiamato
elettrone secondario, è molto ionizzante. Il positrone avrà vita breve: si ricombina entro 10-8 secondi
con un elettrone libero. L'intera massa delle due particelle viene quindi convertita in due fotoni
gamma con un'energia di 0.51 MeV ciascuno.
Raggi gamma, raggi X, luce visibile e radiazione ultravioletta sono tutte forme di radiazione
elettromagnetica. L'unica differenza è la frequenza e quindi l'energia dei fotoni. I raggi gamma sono
i più energetici.
Ecco un esempio di generazione di raggi gamma:
Prima un nucleo di cobalto-60 decade in un nichel-60 eccitato attraverso il decadimento beta:
dove
è l'antineutrino elettronico, poi il nichel-60 passa al suo stato di energia minima emettendo
un raggio gamma:
DECADIMENTI E TEMPO DI DIMEZZAMENTO
Il decadimento radioattivo non avviene in un tempo standard, ma si è osservato che dipende
dall’isotopo e questo impiega sempre lo stesso tempo per decadere metà degli atomi pari alla metà
del totale, in un tempo t 1 detto tempo di dimezzamento.
2
Considerato un elemento radioattivo che al tempo t 0 ha N 0 nuclei, dopo un tempo t il numero di
nuclei residui è N (t ) N 0 2
t / t
1
2
, infatti per t= t 1 si ha che N (t ) N 0 / 2 .
2
Bisogna notare che questa rappresenta solamente una soluzione approssimata, in primo luogo
perché rappresenta una funzione continua, mentre l'evento fisico reale assume valori discreti, poi
perché descrive un processo casuale, solo statisticamente vero. Comunque, poiché nella gran parte
dei casi N è estremamente grande, la funzione fornisce un'ottima approssimazione.
Ora considerando un intervallo di tempo t << t 1 il numero di emissioni di atomi nell’intervallo di
2
tempo considerato è
N ln 2
N 2
1 0
t
t
2
t
1
t
2
ln 2
N (t ) .
1
t
2
N
ln 2
t essendo il rapporto tre i nuclei decaduti e il numero totale dei nuclei, è la
1
N (t )
t
2
probabilità di decadimento che si osserva essere indipendente dal tempo t.
Conosciamo quindi la probabilità che un nucleo di una sostanza decada ma non prevedere il
comportamento di ciascuno di essi.
P(t )
Queste relazioni ci permettono di vedere che molte delle sostanze radioattive presenti in natura sono
ormai decadute, e quindi non sono più presenti in natura, ma possono essere prodotte solo
artificialmente. Per avere un'idea degli ordini di grandezza in gioco, si può dire che la vita media dei
vari radionuclidi può variare da 109 anni fino a 10-6 secondi.
DATAZIONE COL METODO DEL CARBONIO-14
Una sostanza radioattiva, essendo caratterizzata da una propria vita media, può essere utilizzata
come misuratore per determinare l’età di un reperto.
Il metodo del 14C (carbonio-14), o del radiocarbonio, è un metodo di datazione radiometrica basato
sulla misura delle abbondanze relative degli isotopi del carbonio.
Fu ideato e messo a punto tra il 1945 e il 1955 dal chimico statunitense Willard Frank Libby, che
per questa scoperta vinse il Premio Nobel nel 1960.
Il metodo del 14C permette di datare oggetti di origine organica (resti umani o animali, legno,
tessuti, eccetera) fino a tempi dell'ordine di alcune decine di migliaia di anni. È largamente
utilizzato in archeologia per la datazione dei reperti.
Il 14C, è un isotopo radioattivo del carbonio scoperto il 27 febbraio 1940 da Martin Kamen e Sam
Ruben. Il suo nucleo contiene 6 protoni e 8 neutroni. La sua presenza nei materiali organici è usato
come base per la datazione al radiocarbonio di reperti archeologici, geologici e idrogeologici.
Nell'atmosfera, per effetto dei raggi cosmici, avviene la seguente reazione:
14
N + n → 14C + p
ΔE = -1.14MeV
Questo processo è all'origine del nuclide carbonio-14.
I Tutti gli organismi viventi che fanno parte del ciclo del carbonio scambiano continuamente
carbonio con l'atmosfera attraverso processi di respirazione (animali) o fotosintesi (vegetali),
oppure lo assimilano nutrendosi di altri esseri viventi o sostanze organiche. Di conseguenza finché
un organismo è vivo, il rapporto tra la sua concentrazione di 14C e quella degli altri due isotopi si
mantiene costante e uguale a quella che si riscontra nell'atmosfera.
l carbonio è un elemento chimico fondamentale per la vita e presente in tutte le sostanze organiche.
Esso possiede tre isotopi: due stabili 12C e 13C e uno radioattivo 14C. Quest'ultimo si trasforma per
decadimento beta in azoto 14N con un decadimento beta secondo lo schema 14C → 14N + e
con un tempo di dimezzamento medio (o emivita) di 5730 anni.
Di conseguenza a lungo andare scomparirebbe, se non venisse continuamente reintegrato, infatti
all’istante della morte di un organismo la materia che lo compone non ha più scambi con la
biosfera, così la quantità di 14C comincia a diminuire secondo la legge del decadimento radioattivo
14
C (t )14C 0 2
t / t
1
2
Dove 14 C 0 è la concentrazione di 14C nell'atmosfera, t il tempo trascorso dalla morte dell'organismo,
t 1 il tempo di dimezzamento 14C .
2
Misurando dunque la quantità di 14C presente nei resti organici, se ne ricava l'età .
Questo metodo permette di ottenere datazioni con un margine di errore tra il 2 e il 5% e fino ad un
tempo massimo di circa 50000 anni: per campioni più antichi la concentrazione di 14C è troppo
bassa per poter essere misurata con sufficiente accuratezza.
Va tenuto inoltre presente che uno degli assunti fondamentali su cui si basa il metodo del
radiocarbonio, cioè che la concentrazione del 14C nell'atmosfera sia costante nel tempo, è vero solo
approssimativamente: diversi fattori infatti possono influenzare la produzione di 14C nell'alta
atmosfera, dalle variazioni nell'attività solare agli effetti delle eruzioni vulcaniche e, in epoca
recente, all'azione dell'uomo.
Gli esperimenti nucleari condotti nella seconda metà del XX secolo hanno infatti rilasciato
nell'atmosfera grandi quantità di 14C e di diversi altri isotopi radioattivi, a tal punto che la
concentrazione di 14C misurata in reperti moderni è talvolta anche del 50% superiore a quella che si
aveva nel 1950, data convenzionalmente scelta come riferimento. Per contro l'uso su larga scala del
petrolio e dei suoi derivati ha diffuso nell'atmosfera grandi quantità di carbonio di origine fossile,
vecchio di diversi milioni di anni, nel quale la concentrazione di 14C si è ridotta a zero.
È assai dubbio pertanto che il metodo del 14C possa continuare in futuro ad essere usato.