+DECADIMENTO RADIOATTIVO
Storia della radioattività
I primi studi sulla radioattività iniziano verso la fine del XIX secolo quando William Röntgen scopre i raggi
X nel 1895. Dopo di lui iniziano a essere scoperte le radioattività degli elementi, in particolare nel 1896
quando viene scoperta la radioattività naturale dell'uranio da Antoine Becquerel, il quale vinse il Premio
Nobel per la Fisica insieme a Pierre e Marie Curie. Questi ultimi nel 1898 scoprirono la radioattività del
polonio e del radio e tali studi portarono poi alla malattia e alla morte di Marie.
Queste scoperte portarono a condurre nuovi esperimenti e a nuove scoperte, come la scoperta delle
particelle α da parte di Rutherford nel 1899, aprendo nuovi campi per la scienza moderna.
Si dice disintegrazione, o decadimento radioattivo, l’insieme dei processi tramite i quali alcuni nuclei atomici
instabili emettono particelle subatomiche per raggiungere uno stato di stabilità tramite la cosiddetta catena
di decadimento.
Nel momento in cui un atomo è instabile, ovvero si verifica uno squilibrio tra protoni e neutroni o
un’eccessiva abbondanza di entrambi, questo emette naturalmente particelle per stabilizzarsi. Nel lasso di
tempo in cui l’atomo si trova in questo stato di precarietà, esso può essere definito come atomo
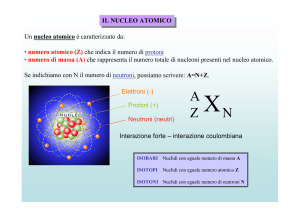
radioattivo. Si può riconoscere l’instabilità di un atomo quando il numero di protoni (P) sulla somma del
numero degli elettroni(E) e di neutroni (N),ovvero numero atomico su numero di massa, è uguale a Z>82
P/(E+N)=Z>82
In questo caso l’isotopo è instabile. In generale l’instabilità degli isotopi cresce con l’aumentare del loro
numero atomico. L’isotopo del piombo (Z=82) è comunemente considerato il culmine di tutte le catene di
decadimento.
Si hanno tre tipi di decadimento:
1)
Decadimento α
2)
Decadimenti β e β+
3)
Decadimento γ
1) Il decadimento α è caratteristico degli atomi i cui nuclei per stabilizzarsi tendono ad emettere particelle
composte da 2 neutroni e 2 protoni, dette appunto particelle α. Tramite questo processo si ottiene la
diminuzione di 2 unità del numero atomico e di 4 unità del numero di massa e perciò l'elemento diventa un
isotopo dell'elemento nella tavola periodica posto due posizioni prima.
2.1) Nel caso di un eccesso di elettroni rispetto ai protoni nel nucleo si verifica un processo di decadimento
in cui vengono emessi dei raggi β, ovvero elettroni veloci. Si ottiene numero atomico del nucleo che si
forma superiore di un’unità rispetto al nucleo di partenza, mentre rimane inalterato il numero di massa e
quindi il nuovo atomo sarà un isotopo di un elemento superiore nella tavola periodica.
2.2) Quando si riscontra un eccesso di protoni rispetto ai neutroni nel nucleo, può verificarsi la
trasformazione di un protone in un neutrone, questo avviene o tramite l’emissione di un positrone che
corrisponde ad un elettrone con carica positiva, o per cattura di un elettrone, tra quelli presenti nei livelli
più vicini al nucleo. Sia nel processo di emissione che in quello di cattura elettronica il numero atomico del
nucleo che decade diminuisce di un’unità, mentre resta invariato il numero di massa. Da ciò ne deriva che il
nuovo atomo risulti un isotopo dell’elemento precedente della tavola periodica.
3) Si parla di emissione γ quando, in seguito ad un’emissione di tipo α o β, avviene un rilascio di pacchetti di
energia. In questo caso sia il numero di massa che il numero atomico rimangono invariati.
In generale parlando di decadimento non si può individuare una legge fisica che stabilisca con precisione
l’istante in cui questo si verifica. Si tratta di un processo continuato nel tempo e spesso caratterizzato da
una casualità che rende impossibile fare delle previsioni su di esso. Si può comunque riferire ogni processo
di decadimento allo schema descritto da una curva con andamento esponenziale decrescente, detta curva
di decadimento (a intervalli di tempo uguali corrisponde la stessa percentuale di sostanza radioattiva che
decade) .
L’equazione che descrive questa curva è: M = Mo e-λt con M massa dopo un certo lasso di tempo(t), M0
massa all’inizio del processo, la costante irrazionale(e) ed infine (λ) come costante di decadimento
radioattivo (diversa per ogni elemento) che è il reciproco dell’emivita.
L’emivita (o tempo di dimezzamento) è il tempo occorrente per ridurre metà degli atomi di un isotopo
radioattivo.
Dato un intervallo di tempo pari al tempo di emivita (T ½, varia per ogni elemento), il numero dei nuclei che
si conservano ancora in uno stato di instabilità è pari alla metà di quelli presenti inizialmente