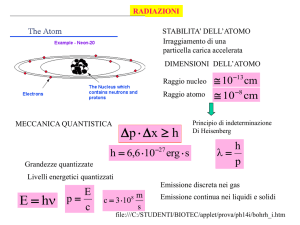
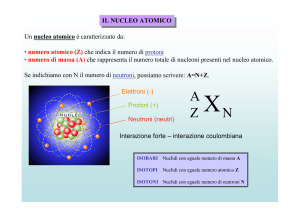
DECADIMENTO RADIOATTIVO E RADIOATTIVITA’
Il decadimento radioattivo è un particolare tipo di reazione nucleare. Esso consiste nella trasformazione di
atomi di un certo tipo in atomi di un altro tipo. Nel medioevo gli alchimisti cercarono di produrre la pietra
filosofale, secondo le loro convinzioni la pietra filosofale sarebbe servita per trasformare dei metalli comuni e
poco preziosi in oro. Sappiamo che il numero atomico (e cioè il numero dei protoni in un nucleo) stabilisce la
specie chimica. Se nel nucleo di un atomo ci sono 3 protoni quell’atomo sarà Litio se ne ha 29 sarà Rame se ne
ha 92 sarà Uranio. Per poter trasformare una sostanza in un’altra bisognerebbe allora cambiare il numero di
protoni di cui quella sostanza è composta. Ovviamente è molto difficile e non si può pensare che una pietra
filosofale possa realizzare qualcosa del genere. Tuttavia spontaneamente alcune sostanze si trasformano in altre,
queste trasformazioni spontanee quando avvengono producono radiazioni ed il fenomeno è chiamato
radioattività o decadimento radioattivo.
Zio Paperone e la pietra filosofale https://issuu.com/mariogreco9/docs/zio_paperone_e_la_pietra_filosofale
Esistono due tipi di decadimento radioattivo:
DECADIMENTO ALFA che consiste nella trasformazione di un atomo di una certa specie in un atomo di
un’altra specie avente numero atomico più basso
A
Z
X ZA42Y 42 He
come si vede quando si ha un decadimento alfa, un atomo X avente numero di massa A e numero atomico Z si
trasforma in un altro atomo Y avente il numero atomico di due unità più basso (l’atomo Y ha due protoni in
meno di X). Anche il numero di massa diminuisce ma di ben 4 unità ( questo vuol dire che l’atomo Y ha anche
1
due neutroni in meno) i due neutroni ed i due protoni che l’atomo X ha perso vanno a costituire un nucleo di
elio ( 42 He ) che come sappiamo è formato da due protoni e da due neutroni. Il nucleo di elio che viene così
emesso dall’atomo X costituisce i cosiddetti raggi alfa o radiazione alfa.
Es.
4
U 234
90Th 2 He
238
92
In questo esempio si vede come l’uranio si trasforma in torio emettendo raggi alfa ( 42 He ).
DECADIMENTO BETA
Il decadimento beta si può presentare in due forme diverse
1) decadimento beta negativo
2) decadimento beta positivo
Il decadimento beta negativo consiste nella trasformazione di un atomo avente un certo numero di massa ed un
certo numero atomico in un altro atomo avente lo stesso numero di massa, ma il numero atomico maggiorato di
una unità
X Z 1AY e
A
Z
come si vede nel decadimento beta negativo viene anche emesso un elettrone che costituisce i cosiddetti raggi
beta o radiazione beta.
Un esempio può aiutare a capire cosa è successo. Consideriamo il decadimento beta negativo del carbonio che
si trasforma in azoto ed in un elettrone
C 147N e
14
6
ed esaminiamo cosa è successo al nucleo del carbonio (vedi figura seguente)
Atomo di Carbonio: 6 protoni e 8 neutroni
Atomo di Azoto: 7 protoni e 7 neutroni
Protoni colorati in blu neutroni colorati in verde
Si vede allora che durante il decadimento beta negativo un neutrone si è trasformato in un protone, sappiamo
che un neutrone è formato da un protone ed un elettrone allora durante il decadimento semplicemente il
neutrone si è decomposto in protone ed elettrone e quest’ultimo lo ritroviamo sotto forma di raggi beta.
Nel decadimento beta negativo si ha una trasformazione di un neutrone in un protone ed un elettrone
Nel decadimento beta positivo accade l’opposto di quello che accade nel decadimento beta negativo e cioè è un
protone che si trasforma in un neutrone mentre il numero di massa non cambia.
La reazione può essere scritta in questo modo
A
Z
X Z A1Y e
2
Anche in questo caso un esempio può aiutare a capire cosa è successo. Consideriamo un isotopo del carbonio il
11
6 C . Esso si trasforma mediante decadimento beta positivo in Boro
C 115B e
11
6
esaminiamo cosa è successo al nucleo del carbonio (vedi figura seguente)
Atomo di Carbonio: 6 protoni e 5 neutroni
Atomo di Boro: 5 protoni e 6 neutroni
Si vede allora che durante il decadimento beta positivo un protone si è trasformato in un neutrone ed in più è
stato prodotto un positrone indicato con il simbolo e . Il positrone è una particella identica all’elettrone ma
invece di avere carica elettrica negativa ha carica elettrica positiva e rappresenta un esempio di antimateria 1.
Nel decadimento beta positivo si ha una trasformazione di un protone in un neutrone ed un positrone
Esistono tre forme distinte di radioattività classificate per modo di decdimento: sono i raggi alfa, i raggi beta e i
raggi gamma.
I raggi alfa e beta li abbiamo già esaminati. Bisogna soltanto dire qualcosa sui raggi gamma
I RAGGI GAMMA
I protoni ed i neutroni che formano il nucleo non sono fermi ma si muovono, possono ruotare su loro stessi
oppure possono oscillare muovendosi avanti ed indietro intorno ad una posizione di equilibrio. Questi
movimenti se molto accentuati possono portare ad una deformazione del nucleo atomico che può passare da una
forma sferica ad una ellissoidale.
Quando gli elettroni ed i protoni fanno dei movimenti molto ampi è evidente che sono dotati di molta energia al
contrario se i movimenti sono più limitati. Se in un nucleo atomico si passa da movimenti ampi a movimenti
meno ampi si ha una diminuzione dell’energia del nucleo.
Questa energia persa non può scomparire perché l’energia si trasforma senza
scomparire nel nulla. L’energia apparentemente sparita la ritroviamo all’interno
di un particolare tipo di onda elettromagnetica chiamata raggio gamma che
come tutte le onde elettromagnetiche trasporta energia. In particolare i raggi
gamma sono tra le onde elettromagnetiche quelle che trasportano più energia
tanto da essere molto pericolose nel caso in cui dovessero colpire dei tessuti
viventi
L’esistenza del positrone venne predetta nel 1927 mediante un calcolo dal fisico P.A.M. Dirac, ma solo nel 1932 venne realmente
osservato nei raggi cosmici. Il positrone è solo uno dei tanti esempi di antimateria. Ogni particella è dotata della sua antiparticella ad
esempio esiste l’antiprotone. Quando una particella e la sua antiparticella vengono a contatto scompaiono e l’unica traccia dello loro
esistenza è una radiazione che viene emessa. Allo stesso modo quella radiazione potrebbe ritrasformarsi nella particella e nella sua
corrispondente antiparticella.
1
3
Il tempo di dimezzamento
Quando avviene un decadimento radioattivo del tipo alfa oppure beta, gli atomi si trasformano da un tipo ad un
altro.
Il tempo di dimezzamento è il tempo necessario affinché la metà degli atomi di una sostanza radioattiva
possano trasformarsi in un altro tipo di atomo.
Esempio tratto dalla prova Invalsi del 2016
Il carbonio 14 (da wikipedia)
Il carbonio è un elemento chimico fondamentale per la vita e presente in tutte le sostanze organiche. Esso è
presente sulla terra in tre isotopi: due stabili (12C e 13C) e uno radioattivo (14C). Quest'ultimo si trasforma
per decadimento beta in azoto (14N), con un tempo di dimezzamento medio (o emivita) di 5.730 anni, di
conseguenza questo isotopo a lungo andare scomparirebbe, se non venisse continuamente reintegrato. La
produzione di nuovo 14C avviene regolarmente in natura negli strati alti della troposfera e nella stratosfera.
Il metodo del 14C (carbonio-14), o del radiocarbonio, è un metodo di datazione radiometrica basato sulla
misura delle abbondanze relative degli isotopi del carbonio.
Fu ideato e messo a punto tra il 1945 e il 1955 dal chimico statunitense Willard Frank Libby, che per questa
scoperta ottenne il Premio Nobel nel 1960.
Il metodo del 14C permette di datare materiali di origine organica (ossa, legno, fibre tessili, semi, carboni di
legno, ...). Si tratta di una datazione assoluta, vale a dire in anni calendariali, ed è utilizzabile per materiali di
età non più antica di 50.000 anni salvo casi particolari. La sua principale utilizzazione è in archeologia per
datare i reperti costituiti da materia organica, quindi contenenti atomi di carbonio.
4
Tavola degli atomi radioattivi
Elemento con tutti gli isotopi stabili
Elemento radioattivo con isotopi che possiedono tempi di dimezzamento molto lunghi. Emivita di oltre un milione di anni,
radioattività nulla o trascurabile
Elemento radioattivo con isotopi che possono causare modesti pericoli per la salute. Emivita di più di 500 anni, radioattività
paragonabile con i livelli naturali
Elemento radioattivo con isotopi che possono causare elevati pericoli per la salute. Emivita di oltre un giorno, livelli di
radioattività pericolosi
Elemento con isotopi altamente radioattivi
Elemento con isotopi estremamente radioattivi
5