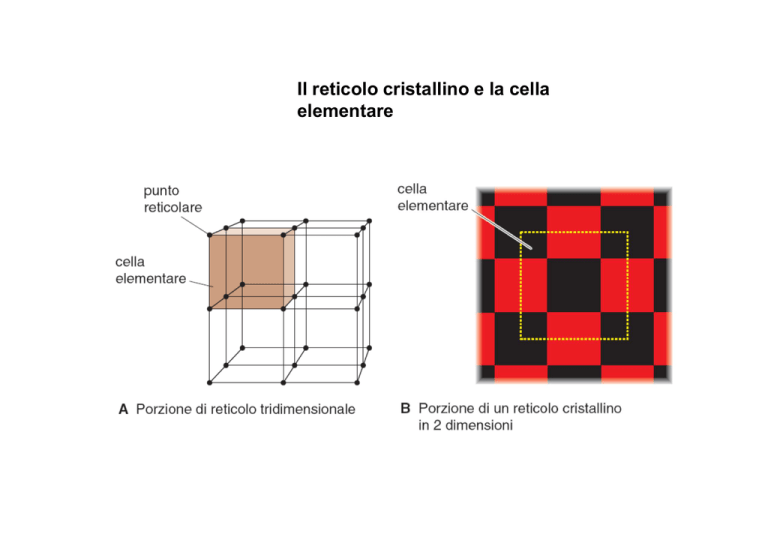
Il reticolo cristallino e la cella
elementare
Nei solidi gli atomi o molecole che li compongono solo vibrano, cioè oscillano intorno a
un punto di equilibrio.
SOLIDI
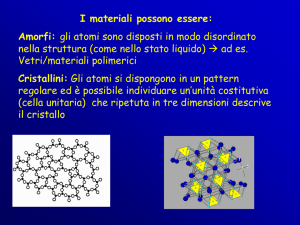
AMORFI : con forme mal definite xchè privi di un vasto ordine
delle loro particelle a livello molecolare
CRISTALLINI : con forme ben definite xchè le loro particelle
sono in una disposizione ordinata
SOLIDI MACROMOLECOLARI possono essere cristallini, semicristallini o amorfi
O POLIMERICI
SOLIDI CRISTALLINI
Atomici (gas nobili)
Molecolari (come il ghiaccio e molti altri)
Ionici
duri e fragili
Metallici
da teneri a duri ma non fragili
Reticolari o Network (Covalenti) molto duri, infatti con T di fusione molto alte
(SiO2= quarzo, C = diamante)
La SUPERCONDUZIONE è la conduzione senza dissipazione di E, dovuta all’urto
degli e- quando gli atomi vibrano attorno alle loro posizioni reticolari. Per ridurre al
min. le vibrazioni bisogna raffreddare il conduttore a T molto basse.
Un elemento allo stato elementare può avere diverse FORME ALLOTROPICHE
(L'allotropia si riferisce specificamente alla struttura del legame chimico esistente fra atomi dello
stesso tipo)
X es. O O2 e O3
Nel caso del C alcuni allotropi hanno forme solide diverse:
S. Amorfo
60 C
DIAGRAMMA DI FASE DEL C
C ibridato sp2
Impurezze tra gli strati che scivolano l’uno sull’altro
C ibridato sp3
Diossido di silicio cristallino e amorfo
Fusione a una T
Fusione completa in un intervallo di T
Il legame Si-O è molto forte e responsabile
della stabilità chimica e fisica della superficie
Strutture degli anioni silicato
in alcuni minerali
solida della Terra.
I silicati sono i + importanti minerali del pianeta,
infatti l’O è l’elemento + abbondante sulla terra
e il Si il 2°.
SiO2 esiste in molte forme amorfe (vetrose)
e cristalline, di cui il quarzo è la + comune.
E’ usato per la produzione del vetro.
L’unità costitutiva dei silicati è il gruppo tetraedrico ortosilicato: -SiO4-.
Costituiscono la sabbia, l’argilla e pietre + dure come l’ametista xes. Formano quindi
polveri o fibre, non reattive e insolubili in acqua. La silicosi è una malattia dovuta al
deposito di queste fibre nei polmoni, per es. fibre di amianto o polveri di silicati nelle
fabbricazione di ceramiche.
Oppure formano strati o doppi strati o da ultimo impalcature di vario tipo, come nel
quarzo.
=asbesto
L’argilla è un
alluminosilicato
I siliconi sono invece polimeri
sintetici in cui oltre all’O
legato al Si vi sono anche 2
gruppi organici come metili
xes.
CH3
----O-Si---CH3
unità costitutiva della catena
di poli(dimetil silossano)
E hanno proprietà sia delle
materie plastiche sia dei
minerali. I gruppi organici
conferiscono la flessibilità e
le deboli forze
intermolecolari tra le catene
mentre lo scheletro O-Si-O
conferisce la stabilità
termica e l’ininfiammabilità di
un minerale.
I materiali ceramici sono solidi non metallici, non polimerici, che vengono induriti dal
riscaldamento alle alte T.
I ceramici a base argillosa (l’argilla è principalmente alluminosilicato) sono microcristalli
di silicati in un mezzo cementante vetroso. Durante il riscaldamento la struttura si
riorganizza formando un reticolo esteso di tetraedri di atomi di O con al centro
Si e Al.
Sono materiali caratterizzati da elevata durezza e resistenza al calore e agli agenti
chimici.
Un cristallo perfetto si forma in tempi lunghi. Se si formano + rapidamente si
creano difetti cristallini.
La formazione di leghe metalliche introduce difetti ma anche nuove proprietà
come una maggior durezza, ciò è dovuto al fatto che un secondo metallo può
fornire elettroni di valenza addizionali x il legame metallico.
Il Si puro è cattivo conduttore a T ambiente. Si può aumentare la sua
conduttività mediante il DROGAGGIO (= aggiunta di piccole quantità di altri
elementi x aumentare o diminuire il n° di e- di valenza nelle bande)
La giunzione p-n
Il transistore n-p-n è costituito dall’interposizione di un semiconduttore di tipo
p tra 2 semiconduttori di tipo n.
Un chip (microprocessore) può contenere in un piccolissimo spazio milioni di
giunzioni p-n sotto forma di transistori, permettendo una grande amplificazione
del segnale.
CRISTALLI LIQUIDI : fluiscono come i liquidi ma come i solidi cristallini sono
impaccati in un alto grado di ordine.
Strutture di due tipiche molecole liquido-cristalline
I tre tipi comuni di fasi liquido-cristalline
Fase
nematica
Fase
colesterica
Fase
smettica
Cambiamento di fase indotto
da cambiamenti di T (fase termotropica)
oppure di concentrazione
(fase liotropica) o dalla corrente.