STRUTTURA DEI SOLIDI
I solidi possono essere classificati in funzione della regolarità con cui gli
atomi o gli ioni si dispongono nello spazio.
Un materiale è detto cristallino se caratterizzato da configuarazioni
atomiche ordinate a lungo raggio, nelle 3 direzioni dello spazio.
Gli atomi si dispongono in modo da formare un reticolo tridimensionale
ordinato e ripetitivo, nel quale ciascun atomo forma legami con gli atomi
a lui più vicini.
Se la solidificazione avviene in condizioni normali, tutti i metalli, molti
ceramici e solo alcuni polimeri formano strutture cristalline.
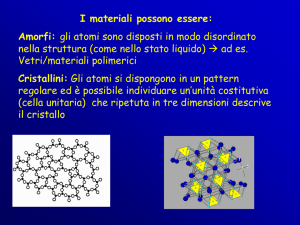
I materiali che non presentano una struttura ordinata a lungo raggio sono
detti non cristallini o amorfi.
Alcune proprietà dei solidi dipendono dalla loro struttura cristallina,
ovvero dalla modalità in cui atomi/ioni/molecole si dispongono nello spazio.
Vi sono diverse strutture cristalline, molto semplici nei metalli, molto
complesse per alcuni ceramici e polimeri.
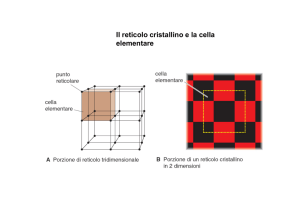
Per una struttura, il reticolo è una griglia (modello)
tridimensionale nella quale i punti di intersezione delle diverse
linee coincidono con i centri delle posizioni occupate dagli
atomi.
L’ordine atomico presente nelle strutture cristalline deriva dalla
presenza di gruppi di atomi che si dispongono secondo una
disposizione geometrica ripetitiva.
Pertanto e’ molto conveniente conviene descrivere le strutture
cristalline come la ripetizione della piu’ piccola unita’ ordinata
ripetitiva (cella unitaria).
Nella maggior parte delle strutture cristalline le celle unitarie hanno la
forma geometrica di un parallelepipedo o di un prisma con tre coppie
di facce parallele.
È caratterizzata dagli angoli α, β, γ
e dalle lunghezze dei lati a,b,c.
Le strutture cristalline
possibili sono molto
numerose.
Tuttavia si puo’ dimostrare
che sono necessari solo
sette sistemi cristallini
diversi per dare origine a
tutti i possibili tipi di
reticolo
(ortorombico)
(trigonale)
Nel 1848, A.Bravais dimostrò che vi
sono in tutto 14 possibili distribuzioni
spaziali degli atomi nei
sette sistemi cristallografici
Alcuni materiali possono presentare più di una struttura cristallina.
Questo fenomeno è detto polimorfismo o, se compare nei solidi
elementari, allotropia.
Esempio di polimorfismo:.
Esempio di allotropia:
il C a temperatura ambiente è sotto forma di grafite, ad elevate pressioni
prevale la forma allotropica del diamante.
La grafite è composta da strati di atomi di carbonio organizzati in strutture
esagonali, dove ogni atomo di carbonio è fortemente legato ai tre atomi vicini
nello stesso strato e debolmente legato agli atomi degli strati adiacenti. Nel
diamante, invece, ogni atomo di carbonio è fortemente legato ai quattro atomi di
carbonio vicini nella struttura cristallina cubica che lo compone.
Le diverse geometrie delle strutture cristalline di diamante e
grafite sono l’unica causa delle enormi differenze tra le proprietà
di questi due materiali.
I MONOCRISTALLI
Se in un solido cristallino gli atomi sono perfettamente ordinati secondo una
ripetizione periodica per tutto il solido senza interruzione, si ha un
monocristallo.
Monocristalli esistono in natura, ma possono anche essere prodotti
artificialmente, benchè la loro sintesi sia estremamente difficile in quanto
richiede processi altamente controllati.
I monocristalli sono importanti in molte tecnologie avanzate, in particolare
nei microcircuiti elettronici, che impiegano monocristalli di Si o di altri
semiconduttori.
Se le estremità di un
monocristallo possono
crescere senza vincoli
esterni, il cristallo assume
forma geometrica regolare
con facce piane e con
forma indicativa della
struttura cristallina.
MATERIALI POLICRISTALLINI
Gran parte dei solidi cristallini, però, sono costituiti da aggregati di cristalli
molto piccoli (grani).
Inizialmente si formano
piccoli cristalli (grani) in
posizioni diverse, con
orientazioni casuali. I
grani crescono e quando
il processo si avvicina al
termine, le estremità dei
grani adiacenti si urtano.
La regione dove i grani
entrano in contatto sono
detti bordi di grano.
Schematizzazione del processo di solidificazione di un
materiale policristallino
ANISOTROPIA
È il fenomeno per cui le proprietà fisiche di alcuni monocristalli dipendono
dalla direzione lungo la quale vengono misurate; ciò è dovuto alla differente
distanza fra gli atomi/ioni nel cristallo nelle differenti direzioni.
I materiali per cui le proprietà invece non dipendono dalla direzione di misura
sono detti isotropi.
I materiali policristallini (con i grani orientati casualmente) si comportano
come materiali isotropi; infatti, anche se ogni grano è isotropo, la proprietà
misurata rappresenta la media dei valori nelle differenti direzioni.
SOLIDI NON CRISTALLINI
I solidi non cristallini (amorfi o liquidi sottoraffreddati) mancano di una disposizione
sistematica e regolare degli atomi su distanze atomiche relativamente grandi.
Il fatto che si formi un solido cristallino o amorfo dipende dalla facilità con cui un una
struttura atomica, che nel liquido ha disposizione casuale, possa trasformarsi nella
solidificazione in un sistema ordinato.
I metalli e alcuni ceramici sono cristallini, altri, come i vetri inorganici, amorfi. I polimeri
sono o completamente amorfi o parzialmente cristallini (con diversi gradi di cristallinità)