004/97
A.A. 1997/98
UNIVERSITA' DEGLI STUDI DI TRIESTE
_____________________________________________________________________
CORSO DI LAUREA
INGEGNERIA AMBIENTALE, CIVILE,
EDILE, MECCANICA E NAVALE
PROGRAMMA DEL CORSO DI
DOCENTE
CHIMICA
Dore Augusto CLEMENTE
Il corso tratta sistematicamente le leggi fondamentali della chimica, la struttura degli
atomi e delle molecole. Parte del corso è volta alla descrizione dei composti
inorganici, delle loro trasformazioni e delle relazioni quantitative che intervengono in
tali trasformazioni.
Saranno svolte lezioni teoriche ed esercitazioni di calcoli chimici (con richiamo di
nozioni di matematica).
CHIMICA GENERALE:
Introduzione: Fenomeni fisici e fenomeni chimici. Stati di aggregazione della
materia. Sistemi omogenei ed eterogenei, fasi. Separazione dei sistemi eterogenei in
fasi. Separazione dei sistemi omogenei. Elementi e composti.
Costituzione della materia: Teoria di Dalton e struttura atomica della materia.
Natura degli atomi. Costituenti fondamentali dell'atomo: l'elettrone, sua scoperta e
proprietà. Nuclei degli atomi: protoni, neutroni e struttura dei nuclei. Numero
atomico, numero di massa, unità di massa chimica, atomica e molecolare. Materia ed
energia, contrazione di massa.
Fondamenti: Nomi e simboli degli elementi. Grammoatomo e numero di Avogadro.
Aggregati di atomi: molecole e cristalli. Peso molecolare, peso formula,
grammomolecola, grammoformula, mole. Significato qualitativo e quantitativo dei
simboli e delle formule chimiche. Nomenclatura sistematica. Spettrometro di massa e
misura diretta della masse atomiche (cenni).
Teoria quantistica della struttura atomica: Natura ondulatoria della luce.
Radiazione del corpo nero ed effetto fotoelettrico. Spettro dell'idrogeno atomico e di
altri atomi. Modello atomico secondo Bohr-Sommerfeld, nascita e declino. Nuova
teoria quantistica, natura ondulatoria dell'elettrone, relazione di De Broglie, analogia
tra elettrone e fotone. Equazione d'onda di Schroedinger, soluzioni e stati stazionari,
interpretazione fisica e valore medio delle osservabili. Meccanica quantistica
dell'atomo di idrogeno e suoi orbitali. Estensione agli atomi polielettronici e
approssimazione del potenziale medio. Ipotesi dello spin dell'elettrone. Principio di
esclusione di Pauli. Regola della massima molteplicità di Hund. Configurazione
elettronica degli elementi, principio di costruzione degli atomi (aufbau), periodicità
della configurazione esterna, tabella di Mendeleyeev, sistema periodico degli
elementi.
Legame chimico: Generalità sui vari tipi di legami e regola del gas nobile. Legame
ionico, solidi cristallini ionici ed energie reticolari, raggi ionici. Legame covalente,
singolo, doppio, triplo, legame multiplo. Solidi cristallini covalenti, raggi covalenti e
forze di legame. Elettronegatività, momento dipolare. Rotazione attorno al legame
covalente, isometri geometrici.
Teoria della risonanza: Legame dativo o di coordinazione. Stati derivati dalla
configurazione elettronica e stati di valenza. Orbitali ibridi. Criterio della
sovrapposizione degli orbitali come forza di legame. Teoria dell'orbitale di legame,
MO e LCAO (cenni). Proprietà magnetiche delle molecole. Legame idrogeno intra e
intermolecolare. Energie di coesione dei metalli.
Strutture molecolari: Molecole biatomiche omonucleari ed eteronucleari. Molecole
poliatomiche e legame policentrico. Energie di legame. Polarità di legami e molecole.
Relazioni tra stereochimica e natura del legame. Teoria VSEPR=Valence Shell
Electron Pair Repulsion.
Stato aeriforme: Proprietà generali della materia allo stato aeriforme: pressione,
volume, temperatura. Leggi di Boyle, Charles e Gay-Lussac. Scala delle temperature
assolute. Principio di Avogadro. Equazioni dei gas ideali e conseguenze. Miscugli
gassosi, pressione parziale e legge di Dalton. Determinazione del peso molecolare.
Teoria cinetica dei gas. Gas reali, equazione di van der Waals. Fenomeni critici e
temperatura critica, stato critico. Liquefazione dei gas, diagramma di Andrews.
Dissociazione.
Stato liquido: Natura di un liquido, ordine-disordine. Tensione superficiale.
Equilibrio liquido-vapore, tensione di vapore e punto di ebollizione. Dipendenza della
tensione di vapore dalla temperatura, energia cinetica.
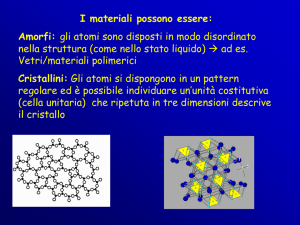
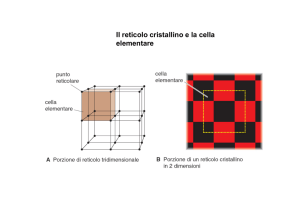
Stato solido: Proprietà generali dei solidi, solidi cristallini e amorfi. Sistemi cristallini
e reticoli. Elementi di simmetria e gruppi puntuali e gruppi spaziali (cenni).
Classificazione dei solidi in base alla simmetria. Classificazione dei solidi in base ai
tipi di legame. Cristalli ionici, covalenti, molecolari. Solidi metallici. Stato vetroso,
polimorfismo e allotropia.
Termodinamica: Natura della termodinamica, processi reversibili e irreversibili.
Calore ed energia. Primo principio della termodinamica. Entalpia e calore di reazione,
sua misura. Calori di combustione. Legge di Hess. Entropia e secondo principio.
Energia libera di un sistema e di una reazione chimica, equazione di Gibbs-Helmoltz.
Energia libera e spontaneità di una reazione. Valutazione delle energie libere,
potenziale chimico. Equilibrio chimico.
Equilibri eterogenei a un componente: Fasi e cambiamenti di stato, equilibrio
solido-vapore, solido-liquido, liquido-vapore. Curve di riscaldamento e di
raffreddamento, calori latenti. Equazioni di Clausius-Clapeyron. Trasformazioni
polimorfe, punto di transizione e relativa pressione. Punto triplo. Sublimazione.
Regola delle fasi.
Proprietà delle soluzioni: Tipi di soluzioni, nomenclatura. Solubilità, concentrazione
e sue unità. Dipendenza della solubilità dalla temperatura. Relazione tra solubilità e
struttura molecolare del solvente e del soluto. Ripartizione di un soluto tra due
solventi. Soluzioni ideali, proprietà colligative. Legge di Raoult.Crioscopia ed
ebullioscopia. Pressione osmotica. Misura del peso molecolare, associazione e
dissociazione del soluto.
Equilibri eterogenei a più componenti: Sistema liquido-gas. Legge di ripartizione di
Henry. Solubilità di miscele gassose. Sistemi liquidi binari. Legge di Raoult,
deviazioni positive e negative. Composizione del liquido e del vapore. Distillazione
frazionata. Miscele azeotropiche. Liquidi completamete immiscibili, distillazione in
corrente di vapore. Sistema solido-liquido. Componenti completamente miscibili allo
stato liquido e solido. Componenti completamente miscibili allo stato liquido e
immiscibili in solido, punto eutettico. Componenti completamente miscibili allo stato
liquido e parzialmente miscibili allo stato solido. Componenti solo parzialemente
miscibili allo stato liquido e fasi solide costituite da componenti puri. Formazione di
un composto con punto di fusione congruente e incongruente. Componenti formanti
una serie continua di soluzioni solide.
Equilibrio chimico: Equilibrio stabile e metastabile. Legge dell'azione di massa.
Equazione generale per le costanti di equilibrio, Kc, Kp, Kx. Relazioni tra le costanti
di equilibrio. Variazione della costante di equilibrio con la temperatura, equazioni di
van't Hoff. Principio dell'equilibrio mobile e sue applicazioni. Equilibri omogenei in
fase gassosa e liquida, dissociazione elettrolitica. Equilibri eterogenei, prodotto di
solubilità.
Acidi e basi: Definizione generalizzata di acido e base. Costante di dissociazione e
grado di dissociazione. Coppia coniugata acido-base. Prodotto ionico dell'acqua.
Acidi e basi poliprotiche. Relazione tra forza di un acido o una base e sua struttura
molecolare. Titolazione e neutrallizzazioni. Soluzioni tampone e loro scelta.
Indicatori. Misura del pH.
Elettrochimica: Equazioni ossido-riduttive. Conduttori elettrolitici. Energia chimica
ed elettrica. Conducibilità specifica ed equivalente e loro misura. Titolazioni
conduttometriche. Elementi ed elettrodi reversibili. Pile. Elettrodi di prima, seconda e
terza specie. Espressione generale della f.e.m. di una cella reversibile, equazione di
Nernst. Potenziale all'elettrodo, potenziale standard, elettrodi di riferimento, f.e.m.
standard e costanti di equilibrio. Misura del prodotto di solubilità e del pH per via
elettrochimica. Elettrolisi. Leggi di Faraday. Elettrolisi degli alogenuri alcalini.
Cinetica chimica: Fattori che influenzano la velocità di reazione. Molecolarità e
ordine di una reazione. Esempi di reazione di primo e di secondo ordine. Velocità di
reazione e temperatura. Equazione di Arrhenius, energia di attivazione. Catalisi.
ELEMENTI DI CHIMICA INORGANICA:
Lo studente dovrà conoscere per ogni elemento: collocazione nella tavola periodica,
configurazione elettronica, stati di ossidazione principali, stato normale di esistenza,
metodi principali di preparazione, preparazione dei composti più comuni (es.: NH3,
HNO3, H2SO4, ecc.), e dovrà discutere il tipo di legame in essi presente, il
comportamento chimico e ossido-riduttivo.
Elementi di chimica organica:
Struttura e proprietà generali; suddivisione dei composti organici; idrocarburi alifatici
(alcani, alcheni, alchini, aliciclici), idrocarburi aromatici. Derivati degli idrocarburi:
alogenuri, alcoli, fenoli, eteri, aldeidi, chetoni, acidi carbossilici, esteri (grassi e olii,
saponificazione, idrogenazione), ammidi, ammine, nitroderivati, amminoacidi,
carboidrati.
TESTI CONSIGLIATI:
CHIMICA MODERNA Casa Editrice EDISES - Napoli
ed uno dei seguenti libri della STECHIOMETRIA:
P. Nylen, N. Wigren, STECHIOMETRIA, Edizioni CEDAM - PADOVA
M. Freni, A. Sacco, STECHIOMETRIA, Casa Editrice Ambrosiana
R. Breschi, A. Massagli, STECHIOMETRIA, Ets Editrice