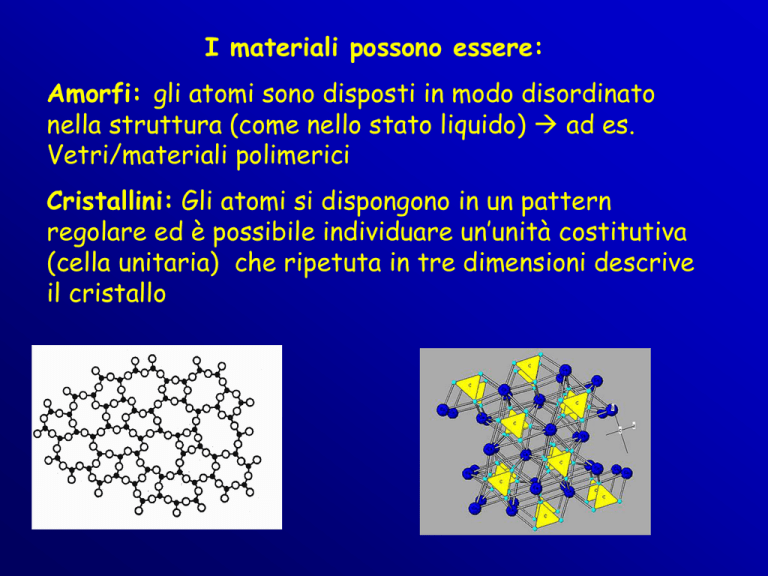
I materiali possono essere:
Amorfi: gli atomi sono disposti in modo disordinato
nella struttura (come nello stato liquido) ad es.
Vetri/materiali polimerici
Cristallini: Gli atomi si dispongono in un pattern
regolare ed è possibile individuare un’unità costitutiva
(cella unitaria) che ripetuta in tre dimensioni descrive
il cristallo
Sistemi amorfi
Si definiscono amorfi i sistemi in cui
non vi è un ordine strutturale
periodico
Le molecole costituenti il solido
risultano essere orientate in modo
essenzialmente disordinato (casuale)
tra loro
M
M
M
M
M
M
M
M
M
M
M
M
M
Sistemi cristallini
Un solido è definito cristallino
quando è possibile riconoscere in
esso una regolarità strutturale
(ordine
spaziale)
che
si
riproduce periodicamente nello
spazio
Lo stato solido
Distinguiamo essenzialmente quattro classi di sistemi
solidi in base ai legami che sussistono tra le loro
particelle:
Solidi
Solidi
Solidi
Solidi
ionici
molecolari
covalenti o reticolari
metallici
Solidi metallici
metalli: sono costituiti da cationi metallici tenuti
insieme da un mare di elettroni; malleabili,duttili,
conducono l'elettricità ed il calore
Legame metallico
Opacità e lucentezza
Densità elevata
Conducibilità elettrica e
termica
Duri, duttili, malleabili,
elastici
Struttura compatta
Struttura esagonale compatta
Numero di
coordinazione
12
Struttura cubica compatta
Numero di
coordinazione
12
Lega di sostituzione
Conducibilità
elettrica e
termica
inferiori
Lega interstiziale rA ≤ 60% rB
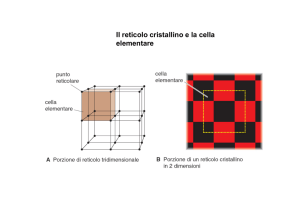
Reticoli di Bravais
Il tipo di cella elementare adottato da un
metallo si determina mediante misure di densità
Solidi ionici
Sono contraddistinti essenzialmente dalle
seguenti proprietà:
Cristallini
Fragili
Altobollenti
Conduttori allo stato fuso
NaCl, KNO3, CuSO4·5H2O
Numero di coordinazione 6,6
Numero di coordinazione 8,8
Solidi molecolari
BeCl2, S8,
P4, I2,
ghiaccio,
glucosio
Sono solidi in cui, nel caso cristallino, le unità molecolari si
impaccano ordinatamente in un reticolo cristallino (si riscontra
periodicità spaziale) e sono tenute insieme dalle diverse
interazioni intermolecolari operanti nel cristallo.
Solidi covalenti
Diamante
Grafite
Sono strutture costituite da un reticolo indefinito di
atomi legati fra loro in modo covalente, come ad esempio
avviene per gli atomi di carbonio negli allotropi del
diamante e dei piani reticolari della grafite.
Fase nematica
Fase smectica
Fase colesterica
Cristalli liquidi Liotropici
Lo stato liquido
Le molecole dei liquidi sono a contatto tra loro,
dato che le interazioni sono più forti che nei gas,
ma libere di scorrere e rotolare rispetto alle
proprie vicine.
All'aumentare delle interazioni aumenta
viscosità del liquido, fino alla solidificazione.
la
In un recipiente chiuso:
Vevaporazione = Vcondensazione
Quando si raggiungono le condizioni di equilibrio, la
pressione esercitata dalle molecole nella fase vapore è
chiamata Pressione di vapore del liquido.
Equazione di Clausius-Clapeyron
Si definisce viscosità di un liquido la sua resistenza allo scorrimento
Lo zolfo fa eccezione!