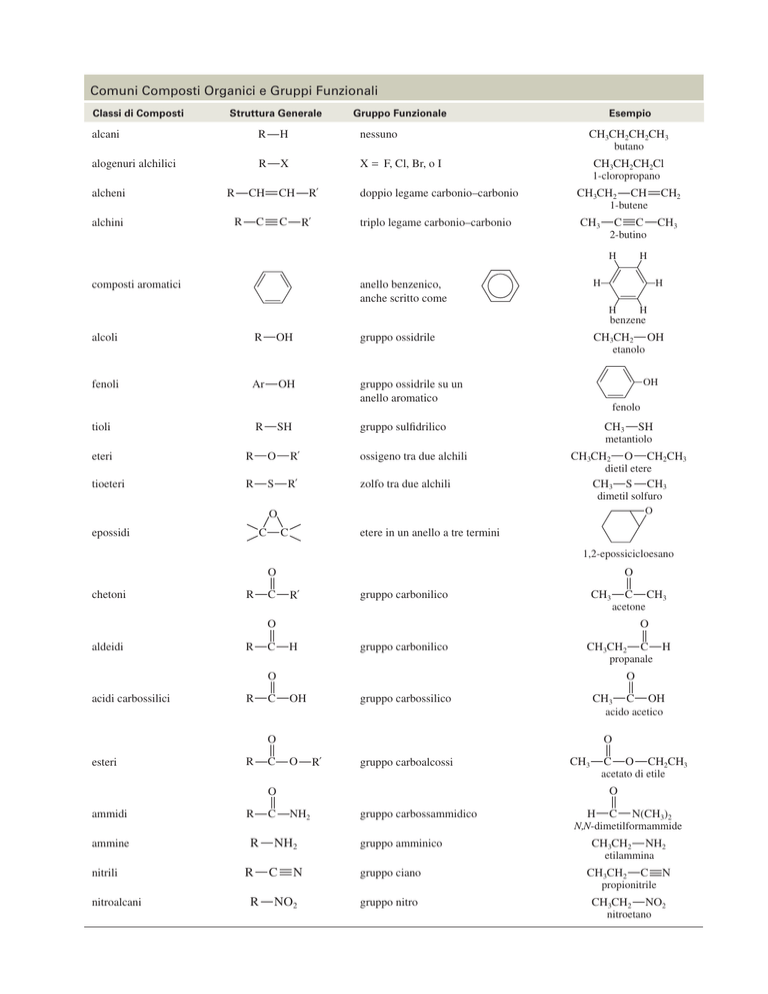
Comuni Composti Organici e Gruppi Funzionali
Classi di Composti
Struttura Generale
Gruppo Funzionale
alcani
R
H
nessuno
alogenuri alchilici
R
X
X = F, Cl, Br, o I
alcheni
alchini
R
CH
R
R´
CH
C
R´
C
Esempio
CH3CH2CH2CH3
butano
CH3CH2CH2Cl
1-cloropropano
doppio legame carbonio–carbonio
CH3CH2
triplo legame carbonio–carbonio
CH3
CH
CH2
C
CH3
1-butene
C
2-butino
H
composti aromatici
H
H
anello benzenico,
anche scritto come
H
H
H
benzene
alcoli
R
OH
gruppo ossidrile
fenoli
Ar
OH
gruppo ossidrile su un
anello aromatico
tioli
R
SH
gruppo sulfidrilico
eteri
R
O
R´
ossigeno tra due alchili
tioeteri
R
S
R´
zolfo tra due alchili
CH3CH2
OH
fenolo
SH
CH3
metantiolo
CH3CH2
O
CH2CH3
CH3
S
CH3
dietil etere
dimetil solfuro
O
O
epossidi
C
OH
etanolo
etere in un anello a tre termini
C
1,2-epossicicloesano
O
O
chetoni
R
C
R´
CH3
gruppo carbonilico
C
acetone
O
aldeidi
R
C
O
H
gruppo carbonilico
CH3CH2
R
C
C
propanale
O
acidi carbossilici
CH3
H
O
OH
CH3
gruppo carbossilico
C
OH
acido acetico
O
esteri
R
C
O
O
R´
gruppo carboalcossi
CH3
C
ammine
nitrili
nitroalcani
R
R
R
R
C
NH2
NH2
C
CH2CH3
O
O
ammidi
O
acetato di etile
N
NO2
gruppo carbossammidico
H
C
N(CH3)2
N,N-dimetilformammide
gruppo amminico
gruppo ciano
gruppo nitro
CH3CH2
NH2
etilammina
CH3CH2
C
propionitrile
CH3CH2
N
NO2
nitroetano
Gruppi Comuni in Chimica Organica
Abbreviazione
Significato
Ac
acetile
Reagenti e Solventi Comuni
Struttura
Abbreviazione
Struttura
O
O
CH3
allile
H2C
C
CH
R
CH2
R
O
Boc
terz-butilossicarbonile
Bn
benzile
Bu
i-Bu
butile
isobutile
s-Bu
sec-butile
(CH3)3C
Ph
O
C
CH2
R
R
CH3 CH2 CH2 CH2
(CH3)2CH CH2 R
CH3
CH2
CH
R
(CH3)3C
terz-butile
Ph
benzoile
benzilossicarbonile
Et
etile
c-Es
cicloesile
Me
metile
Ph
fenile
Pr
propile
i-Pr
R
Sia
isopropile
alchile
isoamile
Ph
C
CH3
idruro di diisobutilalluminio
1,2-dimetossietano
diglyme
bis(2-metossietil) etere
DMF
C
CH2
R
C
N
C
N
O
(CH3
CH2CH2
O
R
R
H
C
N (CH3)2
DMSO
dimetilsolfossido
CH3
EtOH
EtO−
etanolo
CH3CH2OH
CH CH
O−
Et2O
dietil etere
LAH
idruro di litio e alluminio
LiAlH4
LDA
diisopropilammide di litio
[(CH3)2CH]2N− Li+
ione etossido
S
3
CH3CH2
CH3
2
O
O
(i-Pr)3Si
Ts
para-toluensolfonile, “tosile”
CH3
R
MCPBA
acido-metacloroperbenzoico
MeOH
MeO−
metanolo
ione metossido
MVK
metil vinil chetone
C
O
CH3OH
O−
CH3
CH3
C
CH
CH2
O
O
R
NBS
N-bromosuccinimmide
PCC
clorocromato di piridinio
Py o Pyr
piridina
t-BuOH
alcol terz-butilico
t-BuOK
terz-butossido di potassio
THF
tetraidrofurano
TMS
tetrametilsilano
N
H
R
Non tutte queste abbreviazioni sono usate in questo testo, ma possono comunque
essere utili come riferimento.
Br
O
O
C
O
Cl
R
S
H 2C
CH2CH3
O
tetraidropiranile
vinile
O
O
CH3 CH2 CH2 R
(CH3)2CH R
generica
(CH3)2CH C H R
triisopropilsilil
CH3
CH2CH2)2O
R
TIPS
O
AcO OAc
I OAc
O
periodinano di Dess–Martin
dimetilformammide
CH3
[(CH3)2CHCH2]2AlH
CH3
C H3
THP
O
O
R
CH3
DIBAL-H
DME, “glyme”
O
C
O
R
O
CH2
dicicloesil carbodiimmide
CH3
R
O
Cbz (o Z)
DCC
DMP
O
Bz
anidride acetica
R
C H3
t-Bu
Ac2O
pyr CrO3 HCl
N ••
(CH3)3C
(CH3)3C
OH
O− K +
O
(CH3)4Si
H
FONDAMENTI
DI CHIMICA
ORGANICA
L.G. WADE, JR.
W H I T M A N
C O L L E G E
I edizione italiana ridotta e rielaborata della VIII americana
a cura di
Orazio Taglialatela Scafati
Professore Associato di Chimica Organica
Dipartimento di Farmacia
Università degli Studi di Napoli Federico II
Authorized translation from the English language edition,
entitled ORGANIC CHEMISTRY, 8th Edition by LEROY G. WADE, JR.,
published by Pearson Education, Inc.,
publishing as Prentice Hall,
Copyright © 2013
All rights reserved
No part of this book may be reproduced or transmitted in any form or by any means,
electronic or mechanical, including photocopying, recording or by any information storage retrieval system,
without permission from Pearson Education, Inc.
Traduzione autorizzata dall’Edizione in lingua inglese,
intitolata ORGANIC CHEMISTRY, 8th Edition di LEROY G. WADE, JR.,
pubblicata da Pearson Education, Inc.,
per i tipi della Prentice Hall,
Copyright © 2013
Tutti i diritti sono riservati
È VIETATA PER LEGGE LA RIPRODUZIONE IN FOTOCOPIA E IN QUALSIASI ALTRA FORMA
È vietato riprodurre, archiviare in un sistema di riproduzione o trasmettere sotto qualsiasi forma o con qualsiasi
mezzo elettronico, meccanico, per fotocopia, registrazione o altro, qualsiasi parte di questa pubblicazione
senza autorizzazione scritta dell’Editore.
Ogni violazione sarà perseguita secondo le leggi civili e penali.
ISBN 978-88-299-2300-7
Stampato in Italia
Edizione italiana © 2014, by Piccin Nuova Libraria S.p.A., Padova
www.piccin.it
Traduzione italiana a cura di:
Carmela Dell’Aversano
Ricercatore di Chimica Organica
Dipartimento di Farmacia
Università degli Studi di Napoli Federico II
Martino Forino
Ricercatore di Chimica Organica
Dipartimento di Farmacia
Università degli Studi di Napoli Federico II
Orazio Taglialatela Scafati
Professore Associato di Chimica Organica
Dipartimento di Farmacia
Università degli Studi di Napoli Federico II
Luciana Tartaglione
Ricercatore di Chimica Organica
Dipartimento di Farmacia
Università degli Studi di Napoli Federico II
V
Prefazione all’Edizione Italiana
Questo testo costituisce la prima edizione italiana tratta dal libro “Organic Chemistry” di L.G. Wade, tanto apprezzato negli
Stati Uniti da essere giunto all’ottava edizione. Insieme alla casa editrice Piccin, abbiamo concordato un progetto editoriale
piuttosto ambizioso, che non si limitasse alla traduzione del testo americano, ma ne costituisse una rielaborazione e soprattutto uno snellimento, da cui il titolo di “Fondamenti di Chimica Organica”.
La riduzione delle pagine, circa 1300 nella versione americana e 700 nella nostra edizione, ha richiesto un lavoro attento e
scrupoloso. Sono stati eliminati i tre capitoli di spettroscopia/spettrometria di massa e gli esercizi su questi argomenti presenti anche negli altri capitoli: benché molto interessanti, essi non rientrano quasi mai nei programmi dei corsi di Chimica
Organica. Sono stati inoltre accorpati alcuni capitoli, eliminati alcuni esercizi troppo elaborati, raggruppati e riposizionati
alcuni concetti. È stata invece mantenuta l’impostazione generale, incluso l’accurato riepilogo dei concetti di chimica generale trattati nei primi tre capitoli, imprescindibili per una comprensione corretta dei meccanismi di reazione, ai quali viene
dedicato poi un intero capitolo tematico (Cap. 4). È stato inoltre mantenuto l’approccio meccanicistico per le varie reazioni
e lo sforzo fatto dall’Autore di razionalizzare i diversi meccanismi, evidenziando sempre chiaramente il ruolo di nucleofili
ed elettrofili.
Questo impegnativo lavoro ha avuto l’obiettivo di produrre un testo più agile, ma che mantenesse i diversi pregi dell’edizione americana. I docenti e gli studenti apprezzeranno la chiarezza e la precisione dell’esposizione, completata da numerosi
esempi ed illustrazioni. Un esempio del rigore del testo di Wade si può evidenziare nell’uso dei descrittori stereochimici:
lo studente troverà uno stile che è meno frequentemente adoperato negli altri testi, ma che è visivamente più immediato e
razionale. Un altro esempio riguarda la nomenclatura dei composti organici. Il testo segue infatti in maniera rigorosa le raccomandazioni IUPAC del 1993, secondo le quali il numero riferito alla posizione del gruppo funzionale va inserito appena
prima del suffisso che lo indica (es. pentan-2-olo). In quest’ultimo caso abbiamo preferito adoperare in maniera relativamente più frequente, rispetto all’edizione americana, la nomenclatura IUPAC più tradizionale, secondo la quale il numero
si può scrivere all’inizio del nome del composto (es. 2-pentanolo).
L’organizzazione di questo testo lo rende ideale per i corsi di studio (CdS) in cui la Chimica Organica viene insegnata in un
singolo modulo, come ad esempio i CdS triennali, o anche CdS quinquennali come quelli in Farmacia, Agraria e diversi CdS
ad indirizzo bio-medico. Gli studenti di tali corsi troveranno particolarmente interessanti gli esempi e le applicazioni (“In
pratica”) presi dal mondo della medicina, della biologia e della tossicologia. Per tali studenti saranno anche molto utili gli
ultimi due capitoli (Capp. 20 e 21), in cui vengono illustrate le strutture e le proprietà dei composti bio-organici: carboidrati,
acidi nucleici, amminoacidi, peptidi e lipidi.
Ringrazio la casa editrice Piccin, che ha assistito con competenza e professionalità la preparazione di questa versione, ed il
gruppo di colleghi che mi ha coadiuvato. Spero vivamente che questo testo accompagni e faciliti lo studio della Chimica Organica per tanti studenti e che dalla sua lettura risulti chiaro che esso è stato preparato per l’edizione americana, ed adattato
per l’edizione italiana, da chimici organici innamorati di questa disciplina.
VI
Orazio Taglialatela Scafati
Ai miei studenti e colleghi del Whitman College
Notizie sull’Autore
Leroy G. “Skip” Wade decise di diventare un chimico
durante il secondo anno alla Rice University, mentre seguiva il corso di
chimica organica tenuto dal Prof. Ronald M. Magid. Dopo la laurea alla
Rice, conseguita nel 1969, Wade si spostò all’Università di Harvard, dove
si appassionò alla ricerca sotto la guida del Prof. James D. White. Ad Harvard si occupò anche dei corsi di laboratorio di chimica organica e fu fortemente influenzato dai metodi di insegnamento dei Prof.ri Leonard K. Nash
e Frank H. Westheimer.
Dopo aver completato il dottorato ad Harvard nel 1974, il Dr. Wade si
spostò alla facoltà di chimica della Colorado State University. Nel corso
di quindici anni alla Colorado State, il Dr. Wade ha insegnato chimica
organica a migliaia di studenti formandoli per le loro carriere nelle aree
della biologia, chimica, medicina umana e veterinaria e scienze ambientali.
È stato autore di diversi lavori scientifici in chimica organica e in didattica
chimica, oltre ad undici libri riportanti le ricerche più aggiornate nel campo
della sintesi organica. Dal 1989, il Dr. Wade è diventato professore di chimica al Whitman College, dove insegna chimica organica e segue ricerche
nel campo della sintesi organica e della chimica forense. Nel 1993, il Dr.
Wade ha ricevuto il Premio A. E. Lange per l’Eccellenza nell’Insegnamento Scientifico al Whitman.
Gli interessi del Dr. Wade nella scienza forense l’hanno portato a testimoniare come esperto in diversi processi riguardanti l’uso di armi o stupefacenti, ed ha anche lavorato come istruttore e consulente delle forze di polizia per questi aspetti. Inoltre, gli piace molto riparare e restaurare vecchi
violini, cosa che ha fatto in maniera professionale per molti anni.
VII
Sommario
1 Introduzione 1
2Struttura e Proprietà
delle Molecole Organiche 29
3Struttura e Conformazione degli
Alcani 57
4
Lo Studio delle Reazioni Chimiche 87
5 Stereochimica 108
6Alogenuri Alchilici: Sostituzione
Nucleofila ed Eliminazione 139
7
Struttura e Sintesi degli Alcheni 190
8
Reazioni degli Alcheni 215
9 Alchini 254
10 Alcoli 273
11
Eteri, Epossidi e Solfuri 329
12
La Chimica dei Dieni 353
13
Composti Aromatici 378
14
Reattività dei Composti Aromatici 404
15
Aldeidi e Chetoni 446
16 Ammine 485
17
Acidi Carbossilici 528
18
Derivati degli Acidi Carbossilici 552
19Alfa Sostituzioni e Condensazioni
dei Composti Carbonilici 589
VIII
20
Carboidrati ed Acidi Nucleici 630
21
Amminoacidi, Peptidi e Lipidi 661
Risposte ad Alcuni Problemi 691
Indice Analitico 695 Indice Generale
1 Introduzione 1
1-1 Le Origini della Chimica Organica 1
1-2 Principi della Struttura Atomica 3
1-3 Formazione del Legame: la Regola dell’Ottetto 5
1-4 Strutture di Lewis 6
1-5 Legami Multipli 7
Riepilogo: Legami e Coppie Solitarie di Alcuni Atomi 8
1-6 Elettronegatività e Polarità dei Legami 8
1-7 Cariche Formali 9
Riepilogo: Legami Comunemente Presenti nei Composti
Organici 10
1-8 Risonanza 11
1-9 Formule Strutturali 14
1-10 Acidi e Basi di Arrhenius 16
1-11 Acidi e Basi di Brønsted-Lowry 17
1-12 Acidi e Basi di Lewis 23
Glossario 25
Problemi di Riepilogo 26
Struttura e Proprietà
delle Molecole Organiche 29
2
2-1 Proprietà Ondulatorie degli Elettroni 29
2-2 Orbitali Molecolari 30
2-3Legame p 32
2-4 Ibridazione e Forme Molecolari 33
2-5 Come Rappresentare Molecole Tridimensionali 36
2-6 Regole Generali di Ibridazione e Geometria 36
2-7 Rotazione dei Legami 39
2-8 Isomeria 40
2-9 Polarità di Legami e Molecole 42
2-10 Forze Intermolecolari 44
2-11 Idrocarburi 48
2-12 Composti Organici Contenenti Ossigeno 50
2-13 Composti Organici Contenenti Azoto 52
Glossario 53
Problemi di Riepilogo 55
Struttura e Conformazione degli
Alcani 57
3
3-1
3-2
3-3
3-4
3-5
Classificazione degli Idrocarburi 57
Formule Molecolari degli Alcani 58
Nomenclatura degli Alcani 59
Riepilogo: Regole di Nomenclatura degli Alcani 63
Proprietà Fisiche degli Alcani 64
Reazioni degli Alcani 65
IX
X Indice Generale
3-6
3-7
3-8
3-9
3-10
3-11
3-12
3-13
4Lo Studio delle Reazioni Chimiche 87
4-1
4-2
4-3
4-4
4-5
4-6
4-7
4-8
4-9
4-10
Introduzione 87
Clorurazione del Metano 87
La Reazione Radicalica a Catena 88
Costanti di Equilibrio ed Energia Libera 91
Entalpia ed Entropia 91
Cinetica di Reazione 93
Energia di Attivazione e Relazione tra Cinetica e Temperatura 94
La Cinetica della Reazione di Alogenazione 97
Il Postulato di Hammond 101
Intermedi Reattivi 102
Glossario 106
5 Stereochimica 108
5-1
5-2
5-3
5-4
5-5
5-6
5-7
5-8
5-9
5-10
5-11
Struttura e Conformazione degli Alcani 67
Conformazioni del Butano 70
Cicloalcani 72
Isomeria Cis-trans nei Cicloalcani 74
Stabilità dei Cicloalcani; Tensione d’Anello 74
Conformazioni del Cicloesano 77
Conformazioni dei Cicloesani Sostituiti 80
Molecole Bicicliche 82
Glossario 83
Problemi di Riepilogo 85
Introduzione 108
Chiralità 109
Nomenclatura (R) ed (S) degli Atomi di Carbonio Asimmetrici 114
Attività Ottica 117
Miscele Racemiche 120
Eccesso Enantiomerico e Purezza Ottica 121
Composti Chirali senza Atomi Asimmetrici 122
Proiezioni di Fischer 123
Riepilogo: Le Proiezioni di Fischer ed il Loro Uso 127
Diastereoisomeri 127
Riepilogo: Classi di Isomeri 129
Stereochimica di Molecole con Due o Più Carboni Asimmetrici 130
Risoluzione degli Enantiomeri 133
Glossario 135
Problemi di Riepilogo 137
Alogenuri Alchilici: Sostituzione
Nucleofila ed Eliminazione 139
6
6-1
6-2
6-3
6-4
6-5
6-6
Introduzione 139
Nomenclatura degli Alogenuri Alchilici 140
Impieghi Comuni degli Alogenuri Alchilici 142
Struttura degli Alogenuri Alchilici 143
Proprietà Fisiche degli Alogenuri Alchilici 143
Preparazione degli Alogenuri Alchilici 145
Indice Generale XI
Riepilogo: Metodi di Preparazione degli Alogenuri Alchilici 146
6-7 Reazioni degli Alogenuri Alchilici: Sostituzione ed Eliminazione 147
6-8 Sostituzioni Nucleofile di Secondo Ordine: le Reazioni SN2 148
Meccanismo Chiave 6-1: La reazione SN2 149
Riepilogo: Reazioni SN2 di Alogenuri Alchilici 150
6-9 Fattori che Influenzano le Reazioni SN2: Forza del Nucleofilo 152
Riepilogo: Nucleofilicità 153
6-10 Reattività dei Substrati nelle Reazioni SN2 156
6-11 Aspetti Stereochimici della Reazione SN2 159
Meccanismo 6-2: Inversione di Configurazione
nella Reazione SN2 159
6-12 Sostituzione Nucleofila di Primo Ordine: La Reazione SN1 161
Meccanismo Chiave 6-3: La Reazione SN1 162
6-13 Aspetti Stereochimici della Reazione SN1 165
Meccanismo 6-4: Racemizzazione in Una Reazione SN1 167
6-14 Riarrangiamenti nelle Reazioni SN1 167
Meccanismo 6-5: Trasposizione di un Idruro
in Una Reazione SN1 168
Meccanismo 6-6: Trasposizione di un Metile
in una Reazione SN1 169
6-15 Confronto tra la Reazione SN1 e la Reazione SN2 170
Riepilogo: Sostituzioni Nucleofile 171
6-16 Eliminazione del Primo Ordine: La Reazione E1 171
Meccanismo Chiave 6-7: La Reazione E1 172
Meccanismo 6-8: Riarrangiamento in una Reazione E1 174
Riepilogo: Reazioni dei Carbocationi 174
6-17 Regioselettività della Reazione di Eliminazione:
La Regola di Zaitsev 175
6-18 Eliminazione di Secondo Ordine: La Reazione E2 175
Meccanismo Chiave 6-9: La Reazione E2 176
6-19 Aspetti Stereochimici della Reazione E2 177
6-20 Confronto tra i Meccanismi delle Eliminazioni E1 e E2 179
Riepilogo: Reazioni di Eliminazione 180
Riepilogo: Reazioni di Alogenuri Alchilici 183
Glossario 185
Problemi di Riepilogo 188
7 Struttura e Sintesi Degli Alcheni 190
7-1 Introduzione 190
7-2 Descrizione degli Orbitali del Doppio Legame degli Alcheni 191
7-3 Nomenclatura degli Alcheni 192
7-4 Nomenclatura degli Isomeri Cis-Trans 194
Riepilogo: Regole per Assegnare la Nomenclatura agli Alcheni 196
7-5 Stabilità degli Alcheni 197
7-6 Proprietà Fisiche degli Alcheni 200
7-7 Sintesi di Alcheni per Eliminazione da Alogenuri Alchilici 201
Meccanismo 7-1: Deidroalogenazione Mediante
un Meccanismo E2 202
Meccanismo 7-2: Stereochimica della Reazione E2 203
7-8 Sintesi di Alcheni per Disidratazione di Alcoli 206
Meccanismo Chiave 7-3: Disidratazione di un Alcol
Acido-Catalizzata 207
Strategie per la Risoluzione dei Problemi: Proporre
meccanismi di reazione 209
XII Indice Generale
Riepilogo: Metodi di Sintesi degli Alcheni 212
Glossario 213
Problemi di Riepilogo 214
8Reazioni Degli Alcheni 215
8-1 Reattività del Doppio Legame Carbonio-Carbonio 215
8-2 Addizione Elettrofila agli Alcheni 216
Meccanismo Chiave 8-1: Addizione Elettrofila ad Alcheni 217
8-3 Addizione di Alogenuri di Idrogeno (Acidi Alogenidrici) ad Alcheni 218
Meccanismo 8-2: Addizione di HX ad un Alchene 219
Meccanismo 8-3: Addizione Radicalica di HBr ad Alcheni 221
8-4 Addizione di Acqua: Idratazione degli Alcheni 224
Meccanismo 8-4: Idratazione di un Alchene Acido-Catalizzata 225
8-5 Idratazione Mediante Ossimercuriazione - Demercuriazione 226
8-6 Idroborazione degli Alcheni 227
Meccanismo 8-5: Idroborazione di un Alchene 229
8-7 Addizione di Alogeni agli Alcheni 232
Meccanismo 8-6: Addizione di Alogeni agli Alcheni 232
8-8 Formazione di Aloidrine 234
Meccanismo 8-7: Formazione di Aloidrine 234
8-9 Idrogenazione Catalitica degli Alcheni 237
8-10 Epossidazione degli Alcheni 238
Meccanismo 8-8: Epossidazione degli Alcheni 238
8-11 Apertura degli Epossidi Acido-Catalizzata 239
Meccanismo 8-9: Apertura degli Epossidi Acido-Catalizzata 240
8-12 Di-ossidrilazione Sin di Alcheni 241
8-13 Scissione Ossidativa di Alcheni 242
8-14 Metatesi delle Olefine 244
Strategie per la Risoluzione dei Problemi: Sintesi Organiche 246
Riepilogo: Reazioni degli Alcheni 246
Glossario 250
Problemi di Riepilogo 252
9 Alchini 254
9-1 Introduzione 254
9-2 Nomenclatura degli Alchini 255
9-3 Proprietà Fisiche degli Alchini 256
9-4 Struttura Elettronica degli Alchini 257
9-5 Acidità degli Alchini; Formazione di Ioni Acetiluro 257
9-6 Sintesi di Alchini a partire da Acetiluri 259
9-7 Sintesi di Alchini mediante Reazioni di Eliminazione 261
Riepilogo: Sintesi di Alchini 262
9-8 Reazioni di Addizione ad Alchini 262
Meccanismo 9-1: Riduzione con Metallo-Ammoniaca
di un Alchino 265
Meccanismo 9-2: Tautomeria Cheto-Enolica Acido-Catalizzata 267
Meccanismo 9-3: Tautomeria Cheto-Enolica Base-Catalizzata 268
Riepilogo: Reazioni degli Alchini 269
Glossario 271
Problemi di Riepilogo 271
Indice Generale XIII
10 Alcoli 273
10-1 Introduzione 273
10-2 Struttura e Classificazione degli Alcoli 273
10-3 Nomenclatura di Alcoli e Fenoli 275
10-4 Proprietà Fisiche degli Alcoli 278
10-5 Acidità degli Alcoli e dei Fenoli 280
10-6 Sintesi degli Alcoli: Introduzione e Riepilogo 283
Riepilogo: Sintesi degli Alcoli Già Esaminate 283
10-7 Reattivi Organometallici nella Sintesi degli Alcoli 285
10-8 Addizione di Reattivi Organometallici a Composti Carbonilici 287
Meccanismo Chiave 10-1: Reazioni di Grignard 288
Riepilogo: Reazioni di Grignard 292
10-9 Riduzione del Gruppo Carbonilico: Sintesi di Alcoli Primari
e Secondari 293
Meccanismo 10-2: Riduzione Mediante Idruri
di un Gruppo Carbonilico 293
Riepilogo: Reazioni di LiAlH4 e NaBH4 295
Riepilogo: Sintesi degli Alcoli Mediante Addizione Nucleofila a
Gruppi Carbonilici 296
10-10 Tioli (Mercaptani) 297
10-11 Reazioni degli Alcoli 299
10-12 Stati di Ossidazione degli Alcoli e Gruppi Funzionali ad Essi
Correlati 299
10-13 Ossidazione degli Alcoli 301
10-14 Ossidazione Biologica degli Alcoli 304
10-15 Alcoli come Nucleofili e Elettrofili: Formazione dei Tosilati 304
Riepilogo: Reazioni SN2 degli Esteri Tosilati 306
10-16 Reazioni degli Alcoli con gli Acidi Alogenidrici 307
Meccanismo 10-3: Reazione di un Alcol Terziario con HBr (SN1) 308
Meccanismo 10-4: Reazione di un Alcol Primario con HBr (SN2) 308
10-17 Reazioni degli Alcoli con Alogenuri del Fosforo 310
Meccanismo 10-5: Reazione di Alcoli con PBr3 311
10-18 Reazioni degli Alcoli con Cloruro di Tionile 311
10-19 Reazioni di Disidratazione degli Alcoli 312
Meccanismo 10-6: Disidratazione Acido-Catalizzata di un Alcol 313
10-20 Reazioni Tipiche dei Dioli 316
Meccanismo 10-7: Il Riarrangiamento Pinacolico 317
10-21 Esterificazione degli Alcoli 318
10-22 Reazioni degli Alcossidi 319
Meccanismo Chiave 10-8: La Sintesi degli Eteri di Williamson 319
Strategie per la Risoluzione dei Problemi: Sintesi Multistadio 320
Riepilogo: Reazioni degli Alcoli 322
Glossario 324
Problemi di Riepilogo 326
11 Eteri, Epossidi e Solfuri 329
11-1
11-2
11-3
11-4
11-5
Introduzione 329
Proprietà Fisiche degli Eteri 330
Nomenclatura degli Eteri 332
La Sintesi degli Eteri di Williamson 335
Sintesi degli Eteri per Alcossimercurazione-Demercurazione 336
XIV Indice Generale
11-6 S
intesi Industriale degli Eteri: Condensazione Bimolecolare
degli Alcoli 337
Riepilogo: Sintesi degli Eteri 337
11-7 Scissione degli Eteri con HBr e HI 338
11-8 Tioeteri (Solfuri) 339
11-9 Sintesi degli Epossidi 341
Riepilogo: Sintesi degli Epossidi 342
11-10 Apertura Acido-Catalizzata degli Epossidi 343
Meccanismo 11-1: Apertura Acido-Catalizzata degli Epossidi in
Acqua 343
Meccanismo 11-2: Apertura Acido-Catalizzata di un Epossido in
soluzione alcolica 344
11-11 Apertura Base-Catalizzata degli Epossidi 346
Meccanismo 11-3: Apertura Base-Catalizzata degli Epossidi 347
11-12 Orientazione dell’Apertura d’Anello degli Epossidi 348
11-13Reazioni degli Epossidi con Reattivi di Grignard
e di Organolitio 349
Riepilogo: Reazioni degli Epossidi 350
Glossario 351
Problemi di Riepilogo 352
12La Chimica dei Dieni 353
12-1 Introduzione 353
12-2 Stabilità dei Dieni 353
12-3 Orbitali Molecolari di un Sistema Coniugato 355
12-4 Cationi Allilici 359
12-5 Addizioni 1,2 e 1,4 ai Dieni Coniugati 359
Meccanismo 12-1: Addizione 1,2 e 1,4 ad un Diene Coniugato 360
12-6 Controllo Cinetico e Termodinamico nell’Addizione di HBr
all’1,3-butadiene 361
12-7 Radicali Allilici 362
Meccanismo 12-2: Bromurazione Radicalica Allilica 362
12-8 La Reazione di Diels-Alder 364
Meccanismo Chiave 12-2: La Reazione di Diels-Alder 365
12-9 La Diels-Alder come Esempio di Reazione Periciclica 371
Glossario 374
Problemi di Riepilogo 376
13Composti Aromatici 378
13-1
13-2
13-3
13-4
13-5
13-6
13-7
13-8
13-9
13-10
13-11
Introduzione: La Scoperta del Benzene 378
La Struttura e le Proprietà del Benzene 378
Gli Orbitali Molecolari del Benzene 382
Il Modello degli Orbitali Molecolari del Ciclobutadiene 385
Composti Aromatici, Antiaromatici, e Non Aromatici 386
La Regola di Hückel 387
Ioni Aromatici 389
Composti Eterociclici Aromatici 391
Idrocarburi Policiclici Aromatici 394
Composti Eterociclici Fusi 397
Nomenclatura dei Derivati del Benzene 397
Indice Generale XV
13-12 Proprietà Fisiche di Benzene e Derivati 399
Glossario 400
Problemi di Riepilogo 401
14Reattività dei Composti Aromatici 404
14-1 Sostituzione Elettrofila Aromatica 404
Meccanismo Chiave 14-1: Sostituzione Elettrofila Aromatica 405
14-2 Alogenazione del Benzene 405
Meccanismo 14-2: Bromurazione del Benzene 405
14-3 Nitrazione del Benzene 407
Meccanismo 14-3: Nitrazione del Benzene 408
14-4 Solfonazione del Benzene 409
Meccanismo 14-4: Solfonazione del Benzene 409
14-5 Nitrazione del Toluene: L’effetto dei sostituenti alchilici 410
14-6 Sostituenti Attivanti, Orto, Para-Orientanti 412
Riepilogo: Attivanti, Orto, Para-Orientanti 415
14-7 Sostituenti Disattivanti, Meta-Orientanti 415
Riepilogo: Disattivati, Meta-Orientanti 418
14-8 Alogeni: Disattivanti, ma Orto, Para-Orientanti 419
Riepilogo: Effetti Orientanti dei Sostituenti 420
14-9 Effetto di Sostituenti Multipli sulla Sostituzione
Elettrofila Aromatica 420
14-10 Alchilazione di Friedel-Crafts 422
Meccanismo 14-5: Alchilazione di Friedel-Crafts 423
14-11 Acilazione di Friedel-Crafts 426
Meccanismo 14-6: Acilazione di Friedel-Crafts 427
Riepilogo: Confronto tra Alchilazione e Acilazione
di Friedel-Crafts 428
14-12 Sostituzione Nucleofila Aromatica 429
Meccanismo 14-7: Sostituzione Nucleofila Aromatica
(Addizione-Eliminazione) 430
Meccanismo 14-8: Sostituzione Nucleofila Aromatica
(Meccanismo via Benzino) 432
14-13 Sostituzioni Aromatiche Mediate da Reattivi Organometallici 433
14-14 Reazioni in Catena Laterale dei Derivati del Benzene 435
14-15 Reazioni dei Fenoli 438
Riepilogo: Reazioni dei Composti Aromatici 440
Glossario 442
Problemi di Riepilogo 443
15 Aldeidi e Chetoni 446
15-1
15-2
15-3
15-4
15-5
15-6
15-7
15-8
Composti Carbonilici 446
Struttura del Gruppo Carbonilico 447
Nomenclatura di Aldeidi e Chetoni 448
Proprietà Fisiche di Aldeidi e Chetoni 450
Riepilogo dei Metodi di Sintesi di Aldeidi e Chetoni 452
Sintesi di Aldeidi e Chetoni dai Nitrili 455
Sintesi di Aldeidi e Chetoni dai Cloruri Acilici e dagli Esteri 456
Riepilogo: Sintesi di Aldeidi e Chetoni 457
Reazioni di Aldeidi e Chetoni: Introduzione
all’Addizione Nucleofila 460
XVI Indice Generale
Meccanismo Chiave 15-1: Addizioni Nucleofile
al Gruppo Carbonilico 461
15-9 La Reazione di Wittig 462
Meccanismo 15-2: La Reazione di Wittig 463
15-10 Idratazione di Aldeidi e Chetoni 465
Meccanismo 15-3: Idratazione di Aldeidi e Chetoni 465
15-11 Formazione delle Cianidrine 466
Meccanismo 15-4: Formazione di Cianidrine 467
15-12 Formazione delle Immine 468
Meccanismo Chiave 15-5: Formazione di Immine 468
15-13 Condensazione con Idrossilammina e Idrazine 470
Riepilogo: Condensazione delle Ammine con Aldeidi
e Chetoni 471
15-14 Formazione degli Acetali 471
Meccanismo Chiave 15-6: Formazione degli Acetali 473
15-15 Ossidazione delle Aldeidi 476
15-16 Riduzione di Aldeidi e Chetoni 476
Meccanismo 15-7: Riduzione di Wolff-Kishner 478
Riepilogo: Reazioni di Aldeidi e Chetoni 479
Glossario 481
Problemi di Riepilogo 483
16 Ammine 485
16-1 Introduzione 485
16-2 Nomenclatura delle Ammine 486
16-3 Struttura delle Ammine 488
16-4 Proprietà Fisiche delle Ammine 490
16-5 Basicità delle Ammine 491
16-6 Effetti sulla Basicità delle Ammine 492
16-7 Sali di Ammonio 495
16-8 Sostituzione Aromatica di Arilammine e Piridina 497
Meccanismo 16-1: Sostituzione Elettrofila Aromatica
della Piridina 498
Meccanismo 16-2: Sostituzione Nucleofila Aromatica
della Piridina 499
16-9 Alchilazione di Ammine con Alogenuri Alchilici 500
16-10 Acilazione di Ammine Mediante Cloruri Acilici 501
Meccanismo 16-3: Acilazione di un’Ammina ad Opera
di un Cloruro Acilico 501
16-11 Ammine come Gruppi Uscenti: L’Eliminazione di Hofmann 502
Meccanismo 16-4: Eliminazione di Hofmann 503
16-12 Ossidazione delle Ammine; L’Eliminazione di Cope 505
Meccanismo 16-5: Eliminazione di Cope
di un Ammino Ossido 506
16-13 Reazioni delle Ammine con Acido Nitroso 507
Meccanismo 16-6: Diazotazione di un’ammina 508
16-14 Reazioni dei Sali di Arendiazonio 509
Riepilogo: Reazioni delle Ammine 512
16-15 Sintesi delle Ammine Mediante Amminazione Riduttiva 515
16-16 Sintesi delle Ammine attraverso Acilazione-Riduzione 517
16-17 Sintesi Limitate alle Ammine Primarie 518
Riepilogo: Sintesi di Ammine 521
Glossario 523
Problemi di Riepilogo 525
Indice Generale XVII
17 Acidi Carbossilici 528
Introduzione 528
Nomenclatura degli Acidi Carbossilici 529
Struttura e Proprietà Fisiche degli Acidi Dicarbossilici 531
Acidità degli Acidi Carbossilici 532
Sali degli Acidi Carbossilici 536
Sintesi degli Acidi Carbossilici 537
Riepilogo: Sintesi di Acidi Carbossili 539
Reazioni di Acidi Carbossilici e Derivati; Sostituzione Nucleofila
Acilica 540
Meccanismo 17-1: Sostituzione Nucleofila Acilica
di un Estere in Catalisi Basica 540
17-8 Condensazione di Acidi Carbossilici con Alcol: Esterificazione di
Fischer 541
Meccanismo Chiave 17-2: Esterificazione di Fischer 541
17-9 Esterificazione con Diazometano 543
Meccanismo 17-3: Esterificazione con Diazometano 544
17-10 Condensazioni di Acidi Carbossilici con Ammine: Sintesi Diretta
di Ammidi 544
17-11 Riduzione di Acidi Carbossilici 544
17-12 Sintesi ed Utilizzo dei Cloruri Acilici 546
Riepilogo: Reazioni degli Acidi Carbossilici 548
Glossario 549
Problemi di Riepilogo 550
17-1
17-2
17-3
17-4
17-5
17-6
17-7
18Derivati degli Acidi Carbossilici 552
18-1 Introduzione 552
18-2 Struttura e Nomenclatura dei Derivati degli Acidi 553
18-3Punti di Ebollizione e Punti di Fusione
dei Derivati degli Acidi 558
18-4 Interconversione dei Derivati degli Acidi per Sostituzione
Nucleofila Acilica 559
Meccanismo Chiave 18-1: Meccanismo di AddizioneEliminazione della Sostituzione Nucleofila Acilica 560
Meccanismo 18-2: Trasformazione di un Cloruro Acilico
in un’Anidride 562
Meccanismo 18-3: Trasformazione di un Cloruro Acilico
in un Estere 562
Meccanismo 18-4: Trasformazione di un Cloruro Acilico
in Ammide 563
Meccanismo 18-5: Trasformazione di un Estere in
un’Ammide (Ammoniolisi di un Estere) 563
MECCANSIMO 18-6: Transesterificazione 565
18-5 Idrolisi dei Derivati degli Acidi Carbossilici 566
Meccanismo 18-7: Saponificazione di un Estere 566
Meccanismo 18-8: Idrolisi Acida di un’Ammide 568
Meccanismo 18-9: Idrolisi Base-Catalizzata di un Nitrile 569
18-6 Riduzione dei Derivati degli Acidi 569
Meccanismo 18-10: Riduzione di un Estere Mediata da Idruro 570
Meccanismo 18-11: Riduzione di un’Ammide ad Ammina 571
18-7
Reazioni dei Derivati degli Acidi con Reagenti
Organometallici 572
XVIII Indice Generale
Meccanismo 18-12: Reazione di un Estere con due Equivalenti
di un Reattivo di Grignard 572
18-8 Riepilogo della Chimica dei Cloruri Acilici 573
18-9 Riepilogo della Chimica delle Anidridi 575
18-10 Riepilogo della Chimica degli Esteri 576
18-11 Riepilogo della Chimica delle Ammidi 579
18-12 Riepilogo della Chimica dei Nitrili 581
18-13 Tioesteri 583
18-14 Esteri ed Ammidi dell’Acido Carbonico 584
Glossario 585
Problemi di Riepilogo 586
Alfa Sostituzioni e Condensazioni
dei Composti Carbonilici 589
19
19-1 Introduzione 589
Meccanismo 19-1: Alfa Sostituzione 589
Meccanismo 19-2: Addizione di un Enolato ad Aldeidi e Chetoni
(Reazione di Condensazione) 590
Meccanismo 19-3: Sostituzione di un Enolato su un Estere (Condensazione) 590
19-2 Enoli e Ioni Enolato 590
Meccanismo 19-4: Tautomeria Cheto-Enolica
Base-Catalizzata 591
Meccanismo 19-5: Tautomeria Cheto-Enolica
Acido-Catalizzata 591
19-3 Alchilazione degli Ioni Enolato 594
19-4 Formazione e Alchilazione delle Enammine 595
19-5 Alfa Alogenazione di Chetoni e Acidi Carbossilici 597
Meccanismo 19-6: Alogenazione Base-Promossa 597
Meccanismo 19-7: Alfa Alogenazione Acido-Catalizzata 598
19-6 La Condensazione Aldolica di Aldeidi e Chetoni 599
Meccanismo Chiave 19-8: Condensazione Aldolica
Base-Catalizzata 599
Meccanismo 19-9: Condensazione Aldolica Acido-Catalizzata 602
19-7 Disidratazione degli Aldoli 602
Meccanismo Chiave 19-10: Disidratazione Base-Catalizzata
di un Aldolo 603
19-8 Condensazioni Aldoliche Incrociate 603
Strategie per la Risoluzione dei Problemi: Proporre
un Meccanismo di Reazione 604
19-9 Pianificare una Sintesi Mediante Condensazione Aldolica 606
19-10 La Condensazione di Claisen 607
Meccanismo Chiave 19-11: La Condensazione di Claisen 607
19-11
La condensazione di Dieckmann: Una Ciclizzazione
di Claisen 610
19-12 Condensazione di Claisen Incrociata 611
19-13 Reazioni dei Composti b-Dicarbonilici 614
19-14 La Sintesi Malonica 615
19-15 La Sintesi Acetoacetica 618
19-16 Addizioni Coniugate: La Reazione di Michael 620
Meccanismo 19-12: Addizione-1,2 e Addizione-1,4
(Addizione Coniugata) 621
19-17 L’Anellazione di Robinson 623
Indice Generale XIX
Riepilogo: Addizione di Enolati e Condensazioni 625
Glossario 626
Problemi di Riepilogo 627
20Carboidrati ed Acidi Nucleici 630
20-1 Introduzione 630
20-2 Classificazione dei Carboidrati 631
20-3 Monosaccaridi 632
20-4 Diastereoisomeri Eritro e Treo 635
20-5 Epimeri 636
20-6 Strutture Cicliche dei Monosaccaridi 636
Meccanismo 20-1: Formazione di un Emiacetale Ciclico 637
20-7 Anomeri dei Monosaccaridi; la Mutarotazione 640
20-8 Riduzione dei Monosaccaridi 642
20-9 Ossidazione dei Monosaccaridi; Zuccheri Riducenti 643
20-10 Zuccheri Non Riducenti: Formazione di Glicosidi 644
20-11 I Disaccaridi 646
20-12 I Polisaccaridi 649
20-13 Gli Acidi Nucleici: Introduzione 651
20-14 Ribonucleosidi e Ribonucleotidi 652
20-15 Le Strutture dell’RNA e del DNA 654
Glossario 658
21 Amminoacidi, Peptidi e Lipidi 661
21-1
21-2
21-3
21-4
21-5
21-6
21-7
21-8
21-9
21-10
21-11
21-12
21-13
21-14
Amminoacidi, Peptidi e Proteine 661
Struttura e Stereochimica degli a-Amminoacidi 662
Proprietà Acido-Base degli Amminoacidi 666
Punti Isoelettrici ed Elettroforesi 668
Struttura e Nomenclatura di Peptidi e Proteine 669
Classificazione delle Proteine 673
Livelli di Organizzazione Strutturale delle Proteine 674
I Lipidi 676
Le cere 677
Trigliceridi 678
Saponificazione dei Grassi e degli Oli; Saponi e Detergenti 681
Fosfolipidi 684
Steroidi 684
Terpeni 687
Glossario 689
Risposte ad Alcuni Problemi 691
Indice Analitico 695 XX Indice Generale
sezioni dei meccanismi chiave
CAPITOLO 6 La reazione SN2 149
La Reazione SN1 162
La Reazione E1 172
La Reazione E2 176
CAPITOLO 7 Disidratazione di un Alcol Acido-Catalizzata 207
CAPITOLO 8 Addizione Elettrofila ad Alcheni 217
CAPITOLO 10 Reazioni di Grignard 288
La Sintesi degli Eteri di Williamson 319
CAPITOLO 12 La Reazione di Diels-Alder 365
CAPITOLO 14 Sostituzione Elettrofila Aromatica 405
CAPITOLO 15 Addizioni Nucleofile al Gruppo Carbonilico 461
Formazione di Immine 468
Formazione degli Acetali 473
CAPITOLO 17 Esterificazione di Fischer 541
CAPITOLO 18Meccanismo di Addizione-Eliminazione della Sostituzione
Nucleofila Acilica 560
CAPITOLO 19 Condensazione Aldolica Base-Catalizzata 599
Disidratazione Base-Catalizzata di un Aldolo 603
La Condensazione di Claisen 607
sezioni dei meccanismi
CAPITOLO 6 Inversione di Configurazione nella Reazione SN2 159
Racemizzazione in Una Reazione SN1 167
Trasposizione di un Idruro in Una Reazione SN1 168
Trasposizione di un Metile in una Reazione SN1 169
Riarrangiamento in una Reazione E1 174
CAPITOLO 7 Deidroalogenazione Mediante un Meccanismo E2 202
Stereochimica della Reazione E2 203
CAPITOLO 8 Addizione di HX ad un Alchene 219
Addizione Radicalica di HBr ad Alcheni 221
Idratazione di un Alchene Acido-Catalizzata 225
Idroborazione di un Alchene 229
Addizione di Alogeni agli Alcheni 232
Formazione di Aloidrine 234
Epossidazione degli Alcheni 238
Apertura degli Epossidi Acido-Catalizzata 240
CAPITOLO 9 Riduzione con Metallo-Ammoniaca di un Alchino 265
Tautomeria Cheto-Enolica Acido-Catalizzata 267
Tautomeria Cheto-Enolica Base-Catalizzata 268
CAPITOLO 10 Riduzione Mediante Idruri di un Gruppo Carbonilico 293
Reazione di un Alcol Terziario con HBr (SN1) 308
Reazione di un Alcol Primario con HBr (SN2) 308
Reazione di Alcoli con PBr3 311
Disidratazione Acido-Catalizzata di un Alcol 313
Il Riarrangiamento Pinacolico 317
CAPITOLO 11 Apertura Acido-Catalizzata degli Epossidi in Acqua 343
Apertura Acido-Catalizzata di un Epossido in soluzione alcolica 344
Apertura Base-Catalizzata degli Epossidi 347
Indice Generale XXI
sezioni dei meccanismi (continua)
CAPITOLO 12 Addizione 1,2 e 1,4 ad un Diene Coniugato 360
Bromurazione Radicalica Allilica 362
CAPITOLO 14 Bromurazione del Benzene 405
Nitrazione del Benzene 408
Solfonazione del Benzene 409
Alchilazione di Friedel-Crafts 423
Acilazione di Friedel-Crafts 427
Sostituzione Nucleofila Aromatica (AddizioneEliminazione) 430
Sostituzione Nucleofila Aromatica (Meccanismo via
Benzino) 432
CAPITOLO 15 La Reazione di Wittig 463
Idratazione di Aldeidi e Chetoni 465
Formazione di Cianidrine 467
Riduzione di Wolff-Kishner 478
CAPITOLO 16 Sostituzione Elettrofila Aromatica della Piridina 498
Sostituzione Nucleofila Aromatica della Piridina 499
Acilazione di un’Ammina ad Opera di un Cloruro
Acilico 501
Eliminazione di Hofmann 503
Eliminazione di Cope di un Ammino Ossido 506
Diazotazione di un’ammina 508
CAPITOLO 17Sostituzione Nucleofila Acilica di un Estere in Catalisi
Basica 540
Esterificazione con Diazometano 544
CAPITOLO 18 Trasformazione di un Cloruro Acilico in un’Anidride 562
Trasformazione di un Cloruro Acilico in un Estere 562
Trasformazione di un Cloruro Acilico in Ammide 563
Trasformazione di un Estere in un’Ammide (Ammoniolisi di
un Estere) 563
Transesterificazione 565
Saponificazione di un Estere 566
Idrolisi Acida di un’Ammide 568
Idrolisi Base-Catalizzata di un Nitrile 569
Riduzione di un Estere Mediata da Idruro 570
Riduzione di un’Ammide ad Ammina 571
Reazione di un Estere con due Equivalenti di un Reattivo di
Grignard 572
CAPITOLO 19 Alfa Sostituzione 589
Addizione di un Enolato ad Aldeidi e Chetoni (Reazione di
Condensazione) 590
Sostituzione di un Enolato su un Estere
(Condensazione) 590
Tautomeria Cheto-Enolica Base-Catalizzata 591
Tautomeria Cheto-Enolica Acido-Catalizzata 591
Alogenazione Base-Promossa 597
Alfa Alogenazione Acido-Catalizzata 598
Condensazione Aldolica Acido-Catalizzata 602
Addizione-1,2 e Addizione-1,4 (Addizione Coniugata) 621
CAPITOLO 20 Formazione di un Emiacetale Ciclico 637
Prefazione all’Edizione
Americana
Per lo studente
All’inizio dello studio della chimica organica, ci si può sentire sopraffatti dal numero di
composti, nomi, reazioni e meccanismi con i quali ci si deve confrontare. Ci si può anche
chiedere se si sarà mai capaci di imparare tutto questo materiale in un anno, o addirittura
in un semestre. La più importante funzione di un libro di testo è quella di organizzare il
materiale e mostrare che molto della chimica organica è costituito da pochi principi di base
e molte estensioni ed applicazioni di questi principi. Se si afferrano i concetti principali
e si sviluppa la capacità di utilizzarli in maniera flessibile, allora è richiesto un limitato
lavoro di memorizzazione. Francamente, non ho una buona memoria ed odio memorizzare
elenchi di informazioni. Anch’io non ricordo tutti i dettagli di molte delle reazioni e dei
meccanismi di questo libro, ma posso arrivarci ricordando pochi principi base, come ad
esempio “la disidratazione degli alcoli procede con meccanismi di tipo E1”.
Nonostante ciò, nel corso dello studio sarà necessario imparare alcuni fatti e principi
fondamentali che serviranno come “dizionario” di lavoro per ciascun capitolo. Da studente,
mi sono scontrato con questa necessità quando ho preso una D (mediocre) al mio secondo
esame di chimica organica. Pensavo che la chimica organica potesse essere come la chimica generale, dove si poteva memorizzare un paio di equazioni e cavarsela negli esami. Per
esempio, nel capitolo dei gas ideali, memorizzando PV = nRT , sarei stato pronto. Quando
ho provato ad adottare lo stesso approccio con la chimica organica, ho preso una D. Noi
tutti dobbiamo imparare dai nostri errori, ed io ho imparato tanto in chimica organica.
Nello scrivere questo libro, ho provato ad evidenziare un piccolo numero di fatti e
principi importanti che bisogna imparare per risolvere i problemi. Per esempio, delle centinaia di meccanismi di reazione mostrati in questo libro, solo una ventina sono gli stadi
meccanicistici fondamentali che si combinano poi in più lunghi e complicati meccanismi.
Nel testo, questi meccanismi fondamentali sono evidenziati come Meccanismi Chiave per
attirare l’attenzione sulla loro importanza.
Quindi, non bisogna provare a memorizzare tutto di questo corso. Non funzionerebbe; bisogna capire quello che si studia e solo così lo si può applicare. Ma, allo stesso tempo,
non bisogna pensare (come feci io) che si può studiare questa materia senza memorizzare
niente. Bisogna leggere i capitoli, seguire con attenzione le lezioni e lavorare ai problemi.
I problemi evidenzieranno bene il grado di conoscenza della materia e saranno un buon
indicatore in vista dell’esame.
Questa è una serie di suggerimenti che fornisco ai miei studenti all’inizio del corso:
1. Leggere il materiale del libro prima della lezione. Sapere cosa ci si aspetta e cosa c’è
nel libro può aiutare a prendere meno appunti ed utilizzare il tempo per ascoltare e
capire la lezione.
2.Dopo la lezione, riguardare gli appunti ed il libro e svolgere i problemi presenti nel
testo. Dopo, leggere il materiale per la lezione successiva.
3.Se ci si rende conto di non aver capito qualcosa, rivolgersi immediatamente al docente. Infatti, poiché i concetti sono strettamente concatenati, non è possibile andare
avanti senza aver completamente chiari gli argomenti precedenti.
XXII
4. Per preparare un esame, cominciare con il rivedere ciascun capitolo insieme agli
appunti e poi provare a risolvere i problemi di fine capitolo. Può anche essere utile
disporre dei testi di vecchi esami scritti. Infine, molti studenti trovano utile lavorare
in gruppi di studio.
Prefazione all’Edizione Americana XXIII
Ricordate sempre le due “regole d’oro” della chimica organica.
1. Mai rimanere indietro! Il corso procede velocemente ed è difficile raggiungerlo.
2. Risolvere molti problemi. Tutti hanno bisogno di fare pratica, ed i problemi evidenziano dove è necessario altro lavoro.
Sono sempre interessato a conoscere l’opinione degli studenti sul libro. Se avete suggerimenti su come migliorare il testo, o avete trovato un errore, per favore fatemelo sapere
(L.G. Wade, Whitman College, Walla Walla, WA 99362: E-mail: [email protected]).
Io prendo i suggerimenti degli studenti con molta serietà e molti di questi sono presenti nel
testo che state per studiare.
Buona fortuna con lo studio della chimica organica. Sono certo che questo corso vi
piacerà, specialmente se susciterà il vostro interesse su come i composti organici influenzano
le nostre vite. Il mio obiettivo nello scrivere questo libro è stato quello di rendere questo
processo un po’ più facile: costruire i concetti in maniera logica uno sull’altro, in maniera
tale che essi possano fluire in maniera naturale. Anche se la vostra memoria è peggiore della
mia (altamente improbabile), dovreste essere in grado di cavarvela bene in chimica organica!
Per il docente
Nello scrivere la prima edizione di questo testo il mio obiettivo è stato quello di produrre
un testo moderno, leggibile che usasse le tecniche più efficaci per presentare i vari argomenti. Volevo un testo che presentasse la chimica organica al livello richiesto per studi superiori di chimica e biochimica, ma che allo stesso tempo porgesse il materiale in maniera
tale da essere utile per tutti gli altri tipi di studenti che si avvicinano alla chimica organica.
Le edizioni successive hanno esteso e raffinato questi obiettivi, con una vasta riorganizzazione e con l’aggiunta di molti nuovi aspetti. Questa ottava edizione incorpora tutti questi
miglioramenti e, rispetto alla settima, presenta ulteriori revisioni nell’organizzazione, nella
scrittura e nei grafici.
Per esempio, per aiutare lo studente a studiare in maniera più efficace, sono stati
aggiunti, all’inizio di ciascun capitolo, gli Obiettivi del capitolo. Questi riflettono gli argomenti principali e gli scopi del contenuto del capitolo. Una serie di applicazioni dei vari
concetti, indicate con In pratica, riportano vari esempi di tossicologia, chimica verde, biochimica, e medicina in cui i concetti espressi trovano applicazione. I loro titoli descrittivi
aiutano lo studente a capire l’importanza dell’esempio e la relazione con quanto stanno
imparando nel testo. Allo stesso tempo, il contenuto del testo è stato aggiornato per garantire che questa edizione costituisca una fonte di informazioni il più aggiornata possibile.
Tra i contenuti caratteristici del testo, in aggiunta alle classiche reazioni, ci sono molti
argomenti che solo recentemente sono diventati di uso comune tra i chimici. La teoria degli
orbitali molecolari viene spiegata abbastanza dettagliatamente ed utilizzata per razionalizzare
gli effetti elettronici nei sistemi coniugati e aromatici e le reazioni pericicliche. Molte delle
nuove tecniche sintetiche, come la metatesi delle olefine, sono state incluse nel testo.
I meccanismi di reazione sono importanti in tutte le aree della chimica organica,
ma essi presentano difficoltà per molti studenti. Spesso gli studenti cadono nella trappola
di memorizzare un meccanismo senza razionalizzare perché esso proceda proprio in quel
modo. Questo libro sottolinea spesso i principi usati per prevedere i meccanismi e le tecniche da utilizzare per affrontare problemi sui meccanismi, cercando di vincere la tendenza
alla memorizzazione. Queste tecniche prevedono la discriminazione tra una reazione acida,
basica o radicalica e l’utilizzo corretto della simbologia delle frecce ricurve per illustrare
i singoli stadi. I meccanismi più importanti sono evidenziati nelle sezioni Meccanismi o
Meccanismi Chiave.
I vantaggi e gli svantaggi di usare l’alogenazione radicalica degli alcani per introdurre
i meccanismi di reazione sono stati dibattuti per molti anni. La principale obiezione contro
l’alogenazione radicalica è che non si tratta di una reazione sinteticamente utile. Ma le reazioni utili, come la sostituzione nucleofila e le addizioni elettrofile agli alcheni sono complicate
dalla partecipazione del solvente e da altri effetti. L’alogenazione radicalica in fase gassosa
consente una trattazione più chiara di cinetica e termodinamica, posto che i suoi svantaggi e
limitazioni come reazione sintetica vengano chiaramente illustrati agli studenti.
XXIV Prefazione all’Edizione Americana
La sintesi organica è trattata con grande attenzione in questo testo, con discussioni di
difficoltà progressivamente maggiore dei processi coinvolti nello sviluppo di una sintesi.
L’analisi retrosintetica è specialmente enfatizzata e lo studente impara come muoversi
all’indietro dal composto da ottenere al materiale di partenza.
Per molte reazioni sintetiche vengono fornite le rese di reazione, anche se gli studenti
non dovrebbero utilizzare male questi numeri. Troppo spesso gli studenti considerano la
resa di una reazione come una caratteristica definita, alla stregua del punto di fusione di
un composto. Nella pratica, sono molteplici i fattori che influenzano le rese dei prodotti,
ed i valori presenti in letteratura per reazioni apparentemente simili spesso differiscono di
E1:
un fattore 2 o anche di più. Le rese Hriportate
in questo libro sono
valori tipici, che un bravo
CH CH
H CH CH
H
CH CH
CH OH
CH OH
studente con una buona tecnica può
ottenere.
H C
C CH CH
H C C CH CH
C C
+
HC
CH CHla
In questo libro viene utilizzata
anche la più recente nomenclatura
IUPAC,
ma
CH Br
CH
Br −
+
CH
O H
vecchia nomenclatura e quella
comune
sono
comunque
riportate
ed
utilizzate.
Insegnare
172
Alogenuri Alchilici: Sostituzione Nucleofila ed Eliminazione
H
solo la nomenclatura IUPAC più recente potrebbe essere una scelta teoricamente giusta,
E2:
ma questo approccio renderebbe allo
studente la vita difficileCHnei
suoi studi futuri e nell’uso
CH O −
O H
della letteratura.
H
CH CH
H
CH CH
2
3
2
3
3
2
3
3
2
3
2
3
2
3
3
3
3
3
CA PITO L O 6
3
3
2
H
C
C
CH3
Br
3
CH2CH3
C
3
C
H3C
CH2CH3
Br −
6–16A
Meccanismo e Cinetica della Reazione E1
L’abbreviazione E1 sta per Eliminazione monomolecolare. Il meccanismo è definito
monomolecolare perché lo stato di transizione limitante la velocità di reazione coinvolge una sola specie anziché la collisione tra due specie. Lo stadio lento di una reazione E1 è lo stesso della reazione SN1: la ionizzazione monomolecolare che porta
alla formazione di un carbocatione. In un secondo stadio veloce, la base strappa un
protone dal carbonio adiacente al C+. Gli elettroni che inizialmente formavano il legame carbonio-idrogeno sono liberi di formare un legame p tra i due atomi di carbonio.
Il meccanismo generale di una reazione E1 è descritto nel Meccanismo Chiave 6–7
Sezioni dei Meccanismi Chiave
I Meccanismi Chiave racchiudono i principi meccanicistici fondamentali che ricorrono in tutto il corso. Questi sono i
meccanismi che compongono molti dei meccanismi più lunghi e complessi. Queste sezioni hanno lo scopo di rinforzare
la comprensione dello studente con spiegazioni dei vari stadi,
illustrazione di uno specifico esempio per quel meccanismo e,
spesso, con un problema o una domanda finale, così lo studente
può verificare la propria comprensione.
2
Na+ −OCH3
CH3OH
MeCCanisMO Chiave 6–7
La Reazione E1
La reazione E1 richiede la ionizzazione che comporta la formazione di un intermedio carbocationico come nella SN1,
sicché essa segue il medesimo ordine di reattività: 3°72°771°.
6-11
159
Aspetti Stereochimici della Reazione SN2
Una base (di solito debole) deprotona il carbocatione generando
un alchene.
difficile.
gruppi alchilici
lo rendono impossibile.
Anche
un carbocatione
solo gruppo alchilico
Stadio 1:Tre
Ionizzazione
monomolecolare
con formazione
di un
(stadio lento).
può determinare un considerevole ingombro sterico, nel caso del gruppo
+ terz-butile o
neopentile.
+ −X
C C
C C
La Figura 6–5 illustra la reazione SN2 tra uno ione idrossido e un bromuro di etile
H eX
(alogenuro 1°), bromuro di isopropile (2°)
bromuro di terz-butileH(3°). Il nucleofilo si
avvicina
facilmente
all’atomo
di carbonio
elettrofilo
bromuro
di etile. Nel
Stadio 2:
Deprotonazione
mediante
una base
deboledel
(spesso
il solvente)
conbromuro
formazione di un alchene (stadio veloce).
di isopropile l’avvicinamento è ostacolato ma comunque possibile. Invece, l’attacco
+
di
terz-butile
è
reso
impossibile
dall’ingombro
SN2 al carbonio terziario del bromuro
−
C C
B H +
C C
sterico dei tre gruppi metilici. B
H
p R Ob l e Ma 6-10
Tra le righe
ESEMPIO: Eliminazione E1 del bromocicloesano in metanolo.
Non bisogna scrivere reazioni SN2 in
Disporre i seguenti composti in ordine decrescente di reattività nelle reazioni SN2 con etossicui siano
alogenuri
alchilici
Stadio
1: Ionizzazione
con
conseguente
formazione di un carbocatione e dello ione bromuro
in uncoinvolti
unico stadio
lento.
) in
etanolo.
do di sodio
(Na+ -OCH2CH
3
cloruro di metile
ioduro di terz-butile
bromuro di neopentile
H
+ H
ioduro di metile Br
cloruroCH
di etile
3OH, calore
bromuro di isopropile
terziari.
+
Br
−
p R Ob l 2:
e Ma
6-11 strappa un protone per formare il cicloesene in uno stadio veloce.
Stadio
Il metanolo
Per ciascuna coppia di composti, individuare quale composto è un miglior substrato nelle
H
reazioni SN2.
+ H
+
(a) 2-metil-1-iodopropano o ioduro di terz-butile
+ CH3OH2
(b) bromuro di cicloesile o 1-bromo-1-metilcicloesano
H CH OH
3
H
(c) 2-bromobutano o bromuro di isopropile H
(d) 1-cloro-2,2-dimetilbutano o 2-clorobutano
(e) 1-iodobutano
o 2-iodopropano
PROBLEMA:
Descrivere
cosa accade nello stadio 2 dell’esempio (Eliminazione E1 del bromocicloesano in metanolo) se il solvente si comporta da nucleofilo invece che da base.
Sezioni dei Meccanismi
Le sezioni sui Meccanismi aiutano gli studenti a capire
come avvengono le reazioni focalizzando l’attenzione sui
singoli stadi di ciascuna reazione. Queste sezioni sono evidenziate con un colore blu in maniera tale che gli studenti
possano localizzarle facilmente mentre sfogliano le pagine
del capitolo.
6–11
Come abbiamo visto, la reazione SN2 richiede l’attacco del nucleofilo dalla parte posteriore di un atomo di carbonio elettrofilo (Figura 6–6). Un atomo di carbonio può
avere solo quattro orbitali di legame completamente occupati da elettroni (un ottetto),
sicché il gruppo uscente deve andar via man mano che il nucleofilo si lega al carbonio.
Gli elettroni del nucleofilo vanno ad inserirsi nel lobo posteriore dell’orbitale del carbonio ibrido sp3 nella sua combinazione di antilegame con l’orbitale del gruppo uscente, dal momento che l’orbitale molecolare di legame risulta già pieno. Questi elettroni
nell’orbitale molecolare di antilegame contribuiscono ad indebolire il legame C ¬ Br
man mano che il bromuro si allontana. Nello stato di transizione il carbonio presenta
legami parziali sia con il nucleofilo che con il gruppo uscente.
L’attacco da retro inverte la struttura tetraedrica del carbonio esattamente come
avviene per un ombrello investito da una folata di vento (Figura 6–6). Nel prodotto
di reazione, il nucleofilo assume una posizione stereochimica opposta alla posizione
inizialmente occupata dal gruppo uscente. Definiamo questo processo inversione di
configurazione dell’atomo di carbonio.
Aspetti
Stereochimici
della Reazione SN2
MeCCanisMO
6–2 Inversione di Configurazione nella Reazione S 2
L’attacco da retro inverte la configurazione dell’atomo di carbonio.
N
−
+
+
Nuc −
C
Nuc
X
C
X
Nuc
X
C
−
ESEMPiO:
−
+
+
H
H
HO −
C
CH3
CH3CH2
Br
(S)-2-bromobutano
HO
H3C
C
Br
CH2CH3
H
HO
C
CH3
CH2CH3
(R)-2-butanolo
Br −
riorità per il carconviene prose-
ello in entrambe
ovare un punto
usare questa
rminare quale lato
orità sull’altra.
4
C
3
H
NH2
H3C
4
1
1
(S)-alanina naturale
H C
H2N
CH3
COOH
3
Figura 5–15
C
(R)-alanina non naturale
La proiezione di Fischer utilizza una
croce per rappresentare un atomo
di carbonio asimmetrico. Le linee
orizzontali si proiettano verso l’osservatore, mentre quelle verticali si
allontanano dall’osservatore.
HO
COOH
=
CH
3
Prefazione
H
COOH
=
H
all’Edizione Americana XXV
HO
C
H
HO
CH3
vista da
questo angolo
CH3
Sezioni dei Problemi
Scrivere gli enantiomeri dell’1,3-dibromobutano ed assegnare la nomenclatura (R) e (S).
*
CH2 CH2 CH CH3
e quelli orizzontali (che puntano avanti) rimangono orizzontali.
Br
SOluziOne
pRO bl e M a 5-8
Il terzo atomo di carbonio dell’1,3-dibromobutano è asimmetrico. L’atomo di bromo ha la priorità più alta, il gruppo ¬CH2CH2Br ha priorità 2, il gruppo metilico ha priorità 3 e l’idrogeno
priorità 4. Le seguenti immagini speculari sono scritte con l’atomo di idrogeno che punta all’indietro (si trova sulla linea a strisce) e quindi sono pronte per l’assegnazione di (R) e (S).
2
2
CH2CH2Br
C* H
1
Br 3 CH3
H
H3C
(R)
Per ciascuno dei seguenti esempi indicare la relazione che esiste tra la prima struttura e ciascuna delle tre seguenti. Le possibilità sono: stesso composto, enantiometro, isomero strutturale.
(a)
COOH
COOH
H
CH2CH2Br
HO
OH
H
H
H3C
CH3
CH3
C*
3
(S)-acido lattico
proiezione di Fischer
Centinaia di problemi forniscono un’immediata opportunità allo
Risolvendo il Problema 5–8 si può notare come le proiezioni di Fischer che diffestudenteriscono
di rafforzare
ed approfondire
il composto.
materiale
cheruotiamo
hannounastuper una rotazione
di 180° sono lo stesso
Quando
prodi Fischerprima
di 180° idi
legami
verticali
(che
verticali
116
C Apuntano
P I T Oindietro)
L O 5 rimangono
Stereochimica
diato neliezione
paragrafo,
andare
avanti.
pR O bl eMa RiS Ol tO 5-2
Br
(S)-acido lattico
formula prospettica
CH3
HO
COOH
OH
H
COOH
1
Br
(b)
(S )
CH2CH3
H
CH3
Br
Br
CH3
Br
CH2CH3
(R)-2-butanolo
H
HO
Br
CH2CH3
CH2CH3
CH3
OH
CH2CH3
Qui sotto è mostrata la struttura di uno dei due enantiomeri del carvone. Trovare l’atomo di
carbonio asimmetrico e determinare se ha configurazione (R) o (S).
CH3
H
H
CH3
CH3
(c)
pR O bl eMa RiS Ol tO 5-3
CH2CH3
H
conf
ha il
del ¬
tilico
l’idro
in se
H
H
CH2CH3
OH
CH3
Una rotazione di 180° è consentita.
O
COOH
COOH
OH =
H
H
C
OH
CH
Strategie
per la Risoluzione dei Problemi
SOluziOne
246
C API TOL O 8 Reazioni Degli Alcheni
L’atomo di carbonio asimmetrico è uno dei carboni dell’anello, indicato dall’asterisco nella
struttura seguente. Anche se a questo carbonio sono legati due gruppi ¬CH2, si tratta di ¬CH2
differenti. Uno è un gruppo ¬CH2CO¬ e l’altro è un gruppoSt¬CH
Rate2¬CH“C.
G ie pe R Dopo
la Riaver
S O lU ZiO N e d ei p R O b leM i
assegnato le priorità ai gruppi come mostrato sotto, si può determinare che si tratta dell’enanSintesi
Organiche
tiomero (S).
(Continua)
Le Strategie per la Risoluzione
dei Problemi aiutano gli studenti
a frazionare la moltitudine di problemi complessi in pezzi semplici
e a stabilire metodi per affrontare
problemi che richiedono di proporre un meccanismo o sviluppare una
sintesi in più passaggi.
routare di 180°
=
C
H
COOH
CH3
3
CH3
CH3
HO
=
HO
H
COOH
Gli alogenuri alchilici e gli alcheni possono essere agevolmente preparati a partire da altri composti e al tempo stesso possono essere
facilmente trasformati in altri gruppi funzionali. Tale versatilità rende queste due classi di composti piuttosto utili nel campo delle
sintesi organiche. Gli alcheni in particolare, essendo poco costosi e disponibili in grosse quantità, trovano largo impiego nelle sintesi
industriali.
Per sintesi organica si intende la preparazione di un dato composto a partire da reagenti facilmente reperibili. Una sintesi può
essere costituita da un’unica e semplice reazione, oppure da una sequenza più complessa di reazioni.
In questo libro sono proposte diverse sintesi organiche sotto forma di problemi per gli studenti. Talvolta, la risoluzione delle
sintesi proposte prevede una sola reazione; altre volte sono invece necessarie più reazioni e potrebbero esserci anche diverse soluzioni
per eseguire la medesima sintesi. Nell’affrontare le cosiddette sintesi multistep (che richiedono cioè una sequenza di reazioni) è spesso
utile analizzare il problema andando a ritroso. In altri termini, può essere conveniente partire dal prodotto desiderato e individuare
la strategia giusta per trasformarlo via via fino ad arrivare al materiale di partenza. Tale approccio è definito analisi retrosintetica.
I seguenti suggerimenti potranno essere utili nell’affrontare le sintesi organiche:
1. Non provare a tirare ad indovinare o a considerare ogni possibile reazione per trasformare il materiale di partenza nel prodotto
desiderato. Prova piuttosto a partire dal prodotto desiderato e ad utilizzare un’analisi retrosintetica.
2. Nel descrivere una reazione, fai uso di equazioni semplificate, scrivendo i reagenti sopra e sotto le frecce. In tal modo, le reazioni
non dovranno essere bilanciate, ma tutti i reagenti e le condizioni indispensabili al successo delle reazioni saranno descritti.
A
Br2, luce "
B
NaOH, alcol
calore
" C
pR
Scr
SOl
Il t
rità
pri
die
H+, H2 O "
D
3. Focalizza l’attenzione sui gruppi funzionali e non utilizzare reagenti che possano interferire con i gruppi funzionali che non intendi
modificare.
La risoluzione di sintesi multistep a volte non è immediata, per questo è d’aiuto sia l’analisi retrosintetica che il prendere in
considerazione vie sintetiche alternative.
Tra le righe
RiepilOGO
Reazioni
degli Alcheni
Le sezioni denominate Tra le righe si trovano ai margini
del testo
ed evidenziano agli stu1. Addizioni
Elettrofile
denti i fatti o i concetti che possono essere
più utili
per risolvere i comuni tipi di problemi.
Sono dei suggerimenti che normalmente ia.docenti
danno
ai propri studenti per aiutarli in
Addizione di
acidi alogenidrici
vista dell’esame.
C
C
+
H
X
(HX = HCl, HBr, or HI)
C
C
H
X
orientazione di Markovnikov
(anti-Markovnikov con HBr e perossidi)
Esempio
Tra le righe
Nell’assegnare le priorità per il carbonio di un anello conviene proseguire intorno all’anello in entrambe
le direzioni fino a trovare un punto
di differenza e poi usare questa
differenza per determinare quale lato
dell’anello ha la priorità sull’altra.
pR
Qu
car
CH3
CH3
senza perossidi
CH3
C
CH
+
HBr
C
CH3
Br
bromuro di tert-butile
(orientazione di Markovnikov)
SOl
L’a
ziona i
da una
esemzatore,
di idrodotto è
onano
essario.
forma ossidata
Pt
forma ridotta
+forma
H2ossidata
O
N
+
H
CH3
l’alcano prodotto è
rilasciato
dal catalizzatore all’Edizione
XXVI
Prefazione
R = (CH2Americana
CH C CH2)10
In pratica
forma ridotta N
14–15B
H
+ H2O
N
Figura 13–10
Sostituzione Elettrofila
Aromatica
deidi Fenoli
La piridina è basica,
con elettroni
N
+
In pratica: L’annerimento della frutta
non reattivi
legame disponibili
strappare un elettrofila aromatica L’annerimento della frutta è un tipico
I fenoli sono substrati altamente
verso la asostituzione
piridina dell’ossigeno
protonata (ione piesempio di ossidazione dei fenoli a ione piridinio, pK = 5,2
in quanto la coppia di elettroniprotone.
di nonLalegame
del gruppopiridina,
ossidrilico
pKb = 8,8
a
ridinio)
continua
ad essere
aromatica.
Le sezioni denominate Instabilizza
pratica ilhanno
lo scopo
dimostrare
l’importanza
della
complesso
sigmadiformato
dall’attacco
in posizione
ortoChimie para. Pertanto, chinoni. Mele, pere, patate, etc. conl’ossidrile
è unegruppo
fortemente
orto, para-orientante.
I fenoli sono
ca Organica per le vite degli
studenti
per diverse
areeattivante
di interesse
come la Biochimica,
i substra- tengono la polifenolo ossidasi (PPO), un
eccellenti Verde.
per le reazioni di alogenazione, nitrazione, solfonazione, e alcune delle enzima che catalizza l’ossidazione dei
Farmaci, l’Ambiente, o latiChimica
reazioni di Friedel-Crafts. Generalmente, a causa della loro elevata reattività, i fenoli derivati del catecolo (1,2-benzendiolo)
vengono alchilati o acilati utilizzando catalizzatori deboli di Fridel-Crafts (come HF) presenti in natura mediante ossigeno
In pratica: Biochimica
In pratica: Antibiotici
13–8B
Pirroloatmosferico. I prodotti sono degli ortoproprio per evitare la polialchilazione
e la poliacilazione.
Il porfobilinogeno, un pirrolo sostituito,
La riduzione enzimatica di un doppio legachinoni, che sono instabili e tendono
Il
pirrolo
è
un
eterociclo aromatico a cinque termini, con un atomo di az
è il costituente principale
me è lo stadio chiave nella formazione di OH
OH
OHdell’anello
rapidamente a formare polimeri scuri.
legami (Figura 13–11). Sebbene il pirrolo sembri possedere solamente
dell’eme, una porfirina che svolge
un acido grasso che viene poi incorporato
OH
L’annerimento può essere controlla)
CH(CH
3 2azoto ha una coppia di elettroni non condivisa. L’atom
ni p, l’atomo di
numerose
nella parete del batterio che provoca la
HFfunzioni fisiologiche, come il
2to tramite l’aggiunta di agenti riducenti
,
e
il
suo orbitale p non ibrido si sovrappone con gli
pirrolo
è
ibridato
sp
+ CH 3 CH CH 3trasporto e il deposito dell’ossigeno.
+
tubercolosi. Il farmaco antitubercolare isoo di soluzioni acide che inibiscono
atomi di carbonio a formare un anello continuo. La coppia solitaria de
COOH CH2NH2
niazide blocca questo enzima, impedendo
l’attività dell’enzima PPO. Comunel’orbitale p, e (a differenza della coppia solitaria della piridina) quest
H2C
la riduzione del doppio legame. Senza una
mente alla frutta fresca tagliata sono
)
CH(CH
partecipano al sistema p di legame. Questi due elettroni, insieme ai qua
3 2
NH
parete cellulare integra, il batterio muore.
aggiunte soluzioni di bisolfito di sodio,
dei due doppi legami, costituiscono un sestetto aromatico. Il pirrolo h
O
acido ascorbico (vitamina C), e succo di
Lo ione fenossido, generato facilmente per trattamento
del fenolo con idrossido
CH2CH2COOH
risonanzadidisodio,
92 kJ/mol (22 kcal/mol).
è ancora più reattivo del fenolo verso la sostituzione elettrofila aromatica. In quanto cari- limone per ritardarne l’annerimento.
C
N
so / Pt
Il pirrolo (pKb = 13,6) è una base molto più debole della piridina (p
porfobilinogeno
NHNH2 chi negativamente, gli ioni fenossido reagiscono con elettrofili carichi positivamente
sta differenza èper
dovuta alla struttura del pirrolo OH
protonato (Figura 13–1
isoniazide
4
dare complessi sigma neutri le cui strutture somigliano a quelle dei chinoni.
derivatiè richiesto l’impiego di una coppia di elet
un legame con un protone
del catecolo
CH2CH2COO––
H3C
–
– aromatico. Nel pirrolo protonato, l’atomo di azoto è legato
nel
sestetto
O
O
OH
O
O
diversi (due atomi di carbonio e R
due atomi di OH
idrogeno), ciò richiede
excess
Br
Br
3
che
non
presenta
orbitali
p
non
ibridi.
Il
pirrolo
protonato non è aro
N
Br2 –Brsp
Br2
NaOH
2
H2C CH
CH2CH2COO
un acido con adeguata forza, protonerà
O2il pirrolo
PPO in posizione 2, su uno
H2O
N
Fe
–
carbonio dell’anello, e non sull’atomo di azoto.
OH N
H
Br
Br
H3CBr
ione fenossido
H
N
CH3
Br
Br
complesso sigma
13–8C
Lo Studio
delle Reazioni
Chimiche
O
orto-chinone
Pirimidina
e Imidazolo
(instabile)
CH
H2C attivati
CH3subiscono reazione di sostituzione
Gli ioni fenossido sono così fortemente
che
La pirimidina è un eterociclo a sei
R termini conO due atomi di azoto s
elettrofila aromatica con anidride carbonica
(reazione
di Kolbe), un debole
elettrofilo.
1,3.
Entrambi
gli
atomi
di
azoto
sono simili all’azoto della piridina.
orbitale
p
gruppo
eme,
presente
in
emoglobina
5–9
129
Diastereoisomeri
deboleè una sintesi industriale dell’acido saliInfatti, la carbossilazione degli ioni vuoto
fenossido
e mioglobina
coppia di elettroni di non legame nell’orbitale ibrido sp2 nello stesso p
sovrapposizione
cilico, il quale a sua volta viene successivamente convertito
in aspirina,
come mostrato
H
aromatico.
Queste coppie non condivise non servono al sestetto aroma
no di essi ha un enantiometro. Quindi esistono quattro 2-bromo-3-clorobutani stereoinelle pagine precedenti.
polimeroproprio
di colorecome
marrone
sto conferiscono basicità agli atomi,
accade per la coppia
sp3
somerici: due coppie di enantiomeri. Ciascun membro di una coppia di enantiomeri
è
+
H
C
C
3
della
piridina.
sp
O dell’altra coppia.
un diastereoisomero di ciascun membro
H
H
sp3
O
C
O
O–
OH
O– O
CH3
CH3
CH3
CH3 H
–
–
O
C
H O
COOH
C Ocarbocatione
gruppo alchilico
Obiettivi del
Gli
del Capitolo aiutano gli studenti a
H+ Obiettivi
H
H
H
Br
H
H
Br
Br
H
H
Br
H
CapitOlO 4
focalizzare
l’attenzione
sugli argomenti che è inH2O H
Cl
H
Cl
Cl
H
Cl
H – OH H
Obiettivi del Capitolo
1 Proporre meccanismi che descrivano i diversi stadi di
2
reazioni semplici, come l’alogenazione radicalica.
3
Costruire un diagramma
della coordinata 3di reazione
CH
CH
ed utilizzarlo per identificare i fattori che controllano
(2S,3R)
(2R,3S)
termodinamica e cinetica di una reazione.
enantiomeri
3 Usare meccanismo, termodinamica e cinetica di rea-
zione per prevedere quale tra i suoi possibili prodotti è
quello principale.
3
3
CH
CH
4 Identificare gli(2S,3S)
intermedi reattivi e spiegare le loro
(2R,3R)
proprietà.
enantiomeri
dispensabile comprendere durante lo studio di ciaacido salicilico
N H
H
N
H
scun capitolo.
H
Riepilogo
Uno degli aspetti più utili ed interessanti della chimica organica è lo studio delle reazioni. È impossibile ricordare migliaia di specifiche diastereoisomeri
reazioni organiche mentre è pos- Introduzione
sibile organizzare queste reazioni in gruppi basati sul modo in cui esse hanno luogo e
quali intermedi coinvolgono. Cominciamo questo studio considerando l’alogenazione
degli alcani,
una reazione
relativamente
prevede che
la sostituzione
un
Abbiamo
ora visto
tutti isemplice
tipi diche
isomeri
bisognadi conoscere
e possiamo riportaidrogeno con un alogeno in fase gassosa, senza solventi che complichino lo studio
re in
un diagramma
loro
e riassumere
definizioni.
della
reazione.
È conveniente le
partire
da relazioni
questa reazione
perché abbiamo le
giàloro
studiato
struttura e proprietà degli alcani. Tuttavia, va ricordato che, in pratica, gli alcani sono
così poco reattivi da essereClassi
usati raramente
come materiali di partenza per le sintesi
di Isomeri
organiche di laboratorio.
Scrivere l’equazione complessiva di una reazione, con i reagenti sulla sinistra ed
gli isomeri
i prodotti sulla destra è solo il primo passo nello studio di una reazione.tutti
Se veramente
si vuole capire una reazione bisogna conoscerne il meccanismo, cioè il percorso che
porta passo dopo passo dai reagenti ai prodotti. Inoltre, per capire la tendenza dei
reagenti a trasformarsi in prodotti, la posizione dell’equilibrio e l’energia coinvolta
bisogna studiare la termodinamica della
reazione.strutturali
isomeri
stereoisomeri
Anche se l’equilibrio dovesse favorire la formazione di un prodotto, la reazione
potrebbe non avvenire ad una velocità accettabile. Per utilizzare una reazione in un
tempo ragionevole (o per evitare che diventi esplosiva) ne va studiata la cinetica,
cioè l’andamento della velocità della reazione al variare di diverse condizioni, tra cui
le concentrazioni dei reagenti. La comprensione della cinetica aiuta anche a proporre
diastereoisomeri
enantiomeri
meccanismi di reazione che siano in accordo con il comportamento osservato.
RiepilOGO
H
H
4–1
pirrolo
struttura orbitalica del pirrolo
(sei elettroni p, aromatico)
Figura
13–11
I Riepiloghi, sistemati in posizioni strategiche
all’interno
dei capitoli, sottolineano le inStruttura di legame p del pirrolo. L’atomo di azoto del pirrolo è ibridato sp2, c
formazioni importanti usando diagrammi e grafici,
quando
possibile.
pia solitaria di elettroni nell’orbitale p. Questo orbitale p si sovrappone con gl
isomeri cis-trans
(isomeri geometrici)
4–2
restanti atomi di carbonio in modo da formare una nube circolare continua. Co
quattro elettroni dei doppi legami e i due elettroni nell’orbitale p dell’azoto, il
in totale sei elettroni p.
altri diastereoisomeri
(due o più centri di chiralità)
La clorurazione del metano è un’importante reazione industriale, con un meccanismo
relativamente semplice e che può essere utilizzato per illustrare molti dei principi im- Clorurazione
portanti
di una reazione.
La reazionedifferenti
del metanocon
con illacloro
produce
una miscela
di del Metano
Isomeri
sono composti
stessa
formula
molecolare.
prodotti clorurati la cui composizione dipende dalla quantità di cloro aggiunto e dalle
Isomeri
strutturali
sono
isomeri
che
differiscono
per
l’ordine
condizioni di reazione. La luce o il calore sono necessari per far avvenire la reazione con il quale gli atomi sono legati tra di
ad una velocità accettabile. Quando si aggiunge cloro al metano, la prima reazione è
Stereoisomeri sono isomeri che differiscono solo per l’orientazione degli atomi nello spazio.
87
loro.
Enantiomeri sono isomeri immagini speculari l’uno dell’altro.
Diastereoisomeri sono stereoisomeri che non sono immagini speculari l’uno dell’altro.
Isomeri cis-trans (isomeri geometrici) sono diastereoisomeri che differiscono per la disposizione cis-trans su un anello o su un
doppio legame.
Ringraziamenti
È un piacere ringraziare tutte le persone che mi hanno aiutato nella revisione di questo testo. Più degli altri, Jan William Simek
mi ha dato una serie di eccellenti consigli e valutazioni fondate per tutte le diverse edizioni di questo libro. In questa edizione, Jan
mi ha dato dei suggerimenti sulle revisioni dei vari capitoli e mi ha aiutato a scrivere e correggere tutti i nuovi paragrafi. Ha anche
preparato molti dei nuovi problemi e tutte le Risposte ai Problemi a fine libro. Particolari ringraziamenti sono anche dovuti a John
Murdzek, Developmental Editor, che mi ha dato migliaia di utili suggerimenti durante il processo di scrittura e revisione, che ha
contribuito a definire la struttura di questa nuova edizione.
Vorrei ringraziare i revisori per i preziosi commenti e suggerimenti. Anche se non li ho adottato tutti, i loro suggerimenti sono stati comunque utili ed hanno contribuito alla qualità del prodotto finale.
Revisori dell’Ottava Edizione
David A. Boyajian
Hasan Palandoken
Susan Schelbe
Alline Somlai
Jon Antilla
Eric Brown
Timothy B Clark
James Fletcher
Keith Osbourne Pascoe
Anthony J Pearson Owen Priest
K.C. Russell
Solomon Weldegirma
Palomar College
California Polytechnic State University
Metro State College of Denver
Delta State University
University of South Florida
Loyola University Lake Shore
Western Washington University
Creighton University
Georgia State University
Case Western Reserve
Northwestern University
Northern Kentucky University
University of South Florida
Revisori delle Edizioni Precedenti
Jung-Mo Ahn
David Alonso
Merritt B. Andrus
Arthur J. Ashe
Bill Baker
Dan Becker
John Berger
Bob Bly
Mary Boyd
Hindy Bronstein
David Brown
Philip Brown
Christine Brzezowski
Patrick Buick
David Cantillo
Dee Ann Casteel
Amber Charlebois
Cai Chengzhi
Barry Coddens
Jamie Lee Cohen
Barbara Colonna
Richard Conley
Robert Crow
Maria de Graca Vicente
Chris Gorman
Geneive Henry
William Jenks
Przemyslaw Maslak
Kristen Meisenheimer
Stephen A. Miller
Guillermo Moyna
Rabi Musah
Anthony J. Pearson
Allan Pinhas
University of Texas at Dallas
Andrews University
Brigham Young University
University of Michigan
University of South Florida
Loyola University
Montclair State University
University of South Carolina
Loyola University, Chicago
Fordham College at Lincoln Center
St. John’s University
North Carolina State University
University of Alberta
Florida Atlantic University
Hillsborough Community College
Bucknell University
William Paterson University
University of Houston
Northwestern University
Pace University
University of Miami
Middlesex County College
St. Louis College of Pharmacy
Louisiana State University
North Carolina State University
Susquehanna University
Iowa State University
Pennsylvania State University
Cal Polytechnic at San Luis Obispo
University of Florida
University of the Sciences in Philadelphia
University at Albany
Case Western Reserve University
University of Cincinnati
XXVII
XXVIII Ringraziamenti
Stanley Raucher
Suzanne Ruder
David Son
Joseph B. Wachter
University of Washington
Virginia Commonwealth University
Southern Methodist University
Michigan State University
Infine, voglio ringraziare le persone alla Pearson, la cui dedizione e flessibilità hanno contribuito al completamento
di questo progetto. Jeanne Zalesky, Executive Editor, e Jennifer Hart, Senior Project Editor, hanno garantito che il progetto
andasse avanti, assicurando le risorse necessarie ed hanno proposto molti utili commenti e suggerimenti. Marisa Taylor,
Kate Thomas e Shari Toron, Project Managers, hanno organizzato il processo di produzione con la giusta tempistica. È stato
un piacere lavorare con tutte queste persone professionali e competenti.
Mi è piaciuto molto lavorare a questa nuova edizione e spero che venga percepita come un utile miglioramento rispetto
alla settima edizione. Ho provato a rendere questo libro il più possibile privo di errori, ma sono sicuro che alcuni errori sono
comunque sfuggiti. Se trovate errori o avete suggerimenti su come migliorare questo libro, per favore fatemelo sapere (L.G.
Wade, Whitman College, Walla Walla, WA 99362; e-mail: [email protected]). Ho già preparato un file con possibili
variazioni e miglioramenti per la prossima edizione e spero che molti di quelli che useranno questo testo possano contribuire a questo file. Spero che questo libro renda il vostro lavoro più facile, sia che voi siate studenti che docenti. Questa è la
ragione più importante per la quale l’ho scritto.
L. G. Wade, Jr.
Walla Walla, Washington












