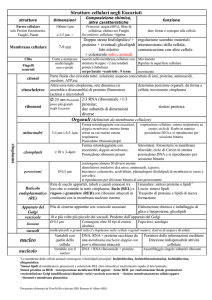
Tipologia dei meccanismi di danno cellulare
Tossico
A
Interazione con
Molecole bersaglio
Disfunzione
cellulare, danno
Riparazione
insufficiente o errata
B
C
TOSSICITÀ
Presenza
nell’organismo
A: la sola presenza provoca
tossicità
senza
specifiche
interazioni
con
molecole
bersaglio;
B:
l’effetto
deriva
da
interazione con specifiche
molecole bersaglio;
C: il danno e correlato a
meccanismi di riparazione
Descrizione e terminologia degli effetti tossici
Gli effetti tossici sono estremamente variabili per natura,
meccanismo d’azione, organismo e struttura bersaglio
In base al luogo d’azione si distinguono :
Effetti locali,
Effetti sistemici.
In base alla latenza di comparsa si distinguono:
Effetti immediati,
Effetti ritardati.
In base alla persistenza si distinguono:
Effetti reversibili,
Effetti irreversibili.
Effetti locali: sono quelli prodotti nel sito primario di contatto
tra agente tossico e organismo ( es: lesioni gastrointestinale da
sostanze caustiche ingerite, effetti polmonari di gas e vapori
irritanti)
Effetti sistemici: sono quelli prodotti in organi, cellule, tessuti
lontani dal luogo di assorbimento (necessitano di processi di
distribuzione operato dal sistema circolatorio)
Effetti immediati: si sviluppano in tempi brevissimi in seguito a
una singola esposizione/dose ( da non confondere con effetto
acuto, che denota una singola esposizione, ma non
necessariamente un effetto immediato)
Effetti ritardati: si sviluppano in seguito a una singola
esposizione/dose o ad un accumulo di più di esse e si
manifestano comunque a distanza temporale (latenza) dalla
prima esposizione. (da non confondere col termine Effetto
cronico)
EFFETTO ACUTO = conseguente ad una unica
esposizione a relativamente elevate concentrazioni o
ad esposizioni di breve durata (poche ore).
EFFETTO CRONICO = conseguente all’esposizione
prolungata o ripetuta nel tempo per più giorni
Effetti reversibili: sono quelli che scompaiono in tempi più o
meno brevi cessata l’esposizione.
Effetti irreversibili: sono quelli che permangono anche cessata
l’esposizione. La reversibilità può essere anche correlata alla
capacità di riparazione del tessuto leso.
Un tipo particolare di effetto sono l’Allergia e
l’Idiosincrasia
L’allergia è una risposta indesiderata su base
immunologica ed è il risultato di una percedente
esposizione alla medesima sostanza o a sostanze
analoghe.
L’idiosincrasia è una risposta anomala agli agenti
chimici su base genetica. Un esempio è, in soggetti
geneticamente carenti dell’enzima glucosio-6-fosfatodeidrogenasi, l’ipersensibilità a sostanze ossidanti come
I nitroaromatici, i clorati e gli anti malarici con
conseguente manifestazione di anemia emolitica .
La natura e la gravità degli effetti tossici
prodotti da un agente tossico dipende da molti
fattori:
1. La sua proprietà chimico fisica
2. La sua bio-attivazione
3. Le condizioni di esposizione
4. La presenza di meccanismi di bio-protezione
Le sostanze tossiche possono avere struttura
chimico-fisica tale da poter reagire con le
strutture biologiche bersaglio o possono
acquisire tale capacità solo dopo un processo di
bio-attivazione
Reazioni enzimatiche di Attivazione
1. Formazione di elettroflili
2. Formazione di Nucleofili
3. Formazione di Radicali
4. Formazione di sostanze red-ox-attive
Gli elettrofili sono molecole povere di elettroni che
tendono a combinarsi con macromolecole
nucleofile (es. DNA, emoglobina ecc.). La
Formazione di elettrofili avviene spesso in reazioni
catalizzate da monoossigenasi (es. P450), reazioni di
ossidazione e riduzione di metalli, ri-arrangiamenti
spontanei, ma posso essere assunti anche come tali.
I nucleofili: Sono prodotti più raramente e sono molecole
ricche di elettroni. Esempi: il CO formato nel processo di
dealogenazione ossidativa del di cloro metano; il CN formato
da batteri intestinali. Poiché la cellula è povera di siti elettrofili
i nucleofili formatisi nel metabolismo sono molto meno
pericolosi per la cellula degli elettrofili o dei radicali liberi.
I radicali liberi sono molecole o frammenti di esse che
hanno uno o più elettroni spaiati nell’orbitale esterno.
Poiché sono instabili ed altamente reattivi tendono a
reagire con altre molecole per accoppiare l’elettrone
spaiato e raggiungere la stabilità. Si formano in seguito
all’acquisizione o perdita di un elettrone o in seguito alla
scissione di un legame covalente con suddivisione simmetrica
degli elettroni (questa reazione può essere innescata da
radiazioni, particolari condizioni di temperatura, reazioni
redox in presenza di metalli di transizione: Cu, Fe ecc…)
I radicali liberi possono essere cationici ( es . L’anione superossido) o neutri
(es.l’ossido nitrico , NO ) e possono essere generati dagli xenobiotici con
meccanismi diversi:
a) Per accettazione di elettroni da una riduttasi ( es. L’ebicida Paraquat)
PQ++
O2
PQ+
O2
b) Per dealogenazione riduttiva ( es. Il tetracloruro di carbonio)
CCl4
Cl3C
O2
Cl3COO (triclorometilperossido)
c) Composti nucleofili come fenoli, idrochinoni, idrazine, tioli
possono cedere elettroni in reazioni catalizzate dalle perossidasi,
generando radicali
d) Durante la reazione di Fenton catalizzata da metalli di transizione
come: Fe(II), Cu(II), Cr(V), Ni(II), Mn(II)
Reazione di Fenton
O2
SOD
HOOH
Fe(II), Cu(II), Cr(V), Ni(II), Mn(II)
2H+
Fe(III), Cu(III), Cr(VI), Ni(III), Mn(III)
HO
OH-
I radicali dell’ossigeno possono innescare a cascata
numerosi eventi tossici che prendono genericamente
il nome di Stess Ossidativo e che avvengono in
sequenza nella cellula (vedi più oltre)
La formazione dei radicali liberi dall’ossigeno (ROS) nella
cellula avviene :
•Nei mitocondri (durante al fosforilazione ossidativa il 2-3%
dell’ossigeno accettore finale d’elettroni viene convertito in
radicali)
•Nei perossisomi ( durante la beta-ossidazione degli acidi
grassi si forma H2O2 che origina radicali dell’ossigeno. I
proliferatori dei perossisomi aumentano enormemente il
fenomeno)
•Nel REM (P450)
•Nel citosol (Xantina ossidasi)
•Nella membrana ( ad opera della Ciclossigenasi che
sintetizza prostaglandine a partire dall’acido arachidonico nel
passaggio da PGG a PGH si producono ingenti quantità di
ROS) .
Formazione di sostanze che attivano cicli red-ox:
a)
i nitriti formati dai Nitrati nell’intestino ad opera di batteri portano alla
fomazione di metemoglobina (emoglobina ossidata);
b) Cr(VI) può essere ridotto a Cr(V) da Acido ascorbico e flavine NADPH
dipendenti con conseguente formazione di OH .
Formazione di metemoglobina
Interazione con molecola bersaglio ( meccanismo B)
La tossicità è determinata dall’interazione dello xenobiotico con una molecola
bersaglio, segue una reazione che determina alterazioni della molecola bersaglio
queste si manifestano poi a diversi livelli (Molecola, organulo cellulare, cellula,
tessuto, organo, organismo)
Tipi di reazione: 1-Legame non covalente;
2-Legame covalente; 3-Estrazione di H; 4Trasferimento di e-; 5-Reazioni enzimatiche
Tossico
Bersaglio
Attributi: accessibilità,
reattività, funzione
critica
Effetti sulla molecola
bersaglio:
•Disfunzione
•Distruzione
•Formazione di Antigeni
Per conoscere gli effetti tossici di uno xenobiotico bisogna
conoscere: la sua reattività con molecole bersaglio, l’effetto che
ne consegue e gli attributi del bersaglio.
TIPI DI REAZIONE
A-Legami non covalenti: -Legami elettrostatici; -ponti idrogeno;
-ponti ionici; -forze deboli di van der Waals
T +B
TB
EFFETTO
Questi legami possono generalmente essere reversibili e
avvengono con recettori di membrana o intracellulari per
sostanze endogene mimando o antagonizzando gli effetti degli
agonisti naturali (ormoni, neurotrasmettitori) Esempio particolare
il legame delle TCDD, IPA ecc col il recettore citosolico Ahr.
Molto spesso l’azione tossica che consegue è stimolazione o
inibizione di una funzione fisiologica in tempi e modi
inappropriati. Esempi: La stricnina occupa il recettore per la
glicina e produce tetania; DDT agisce sui canali del Na
prolungandone l’apertura , riduce il trasporto nei canali del K,
ecc…)
B-Legami Covalenti:
T +B
TB
EFFETTO
Questi coinvolgono:
1. Sostanze elettrofile o cationi radicalici con macromolecole
nucleofile (proteine, enzimi, acidi nucleici);
2. Radicali neutri come OH e Cl3COO con atomi di C dei
lipidi e delle basi del DNA;
3. nucleofili come CN, CO, H2S con le emoproteine.
Generalmente sono irreversibili e portano ad
inattivazione permanente o distruzione della
molecola bersaglio
La formazione di un legame covalente a macromolecole dipende
dalla reattività dei metaboliti elettrofili ma anche dalla loro
lipofilia o idrofilia. Si legano a gruppi sulfidrici o aminici delle
proteine e a gruppi con azoto e ossigeno degli acidi nucleici.
ESEMPI DI ALCUNI LEGAMI COVALENTI DI
XENOBIOTICI ATTIVATI DA BIOTRASFORMAZIONI
1-Gli epossidi di eteni alogenati (cloruro di vinile) ai gruppi SH di
apoproteine e alla guanina, adenina e citosina del DNA.
2-L’ossido di etilene ai gruppi istidinici delle proteine (emoglobina) e al
DNA.
3-I metaboliti chinonici di benzene e bromobenzene, naftalina ai gruppi
SH delle proteine in addizione 1,4.
4-Le amine aromatiche al residuo cisteinico di sieroproteine e al C8 della
guanina nel DNA.
5-Il radicale triclorometilico degli idrocarburi tetraclorurati al P450
C-Estrazione di H:
1- I radicali neutri estraggono H da tioli (R-SH )
producendo R-S che possono essere ossidati a
R-SOH o a disolfuri (RS-SR);
2- L’OH rimuove H da i gruppi –CH2 di
aminoacidi e proteine trasformandoli in gruppi
carbonilici che possono interagire con le ammine
(alterazione per cross-linking di DNA e
proteine);
3- Estrazione di H da acidi grassi determina la
perossidazione lipidica
Perossidazione dei lipidi da radicali o radiazioni
D-Trasferimento di e-:
ES: Nitriti, fenoli, idrossilammina 5idrossiprimachina, fenilidrazina ossidano (FeII )a
(FeIII) nell’emoglobina;
E-Reazioni enzimatiche: tossine di origine animale,
vegetale, micotica o batterica possono produrre
reazioni enzimatiche specifiche:
1. Frammentazione dei ribosomi;
2. Frammentazione di proteine strutturali;
3. Attivazione di G-protein;
4. Fosforilazione o defosforilazione di proteine e
altre macromolecole.
Trasferimento di elettroni
Effetti sulla molecola bersaglio:
1-Distruzione o frammentazione della molecola per:
a-Formazione di radicali liberi; b-Perossidazione; c-Idrolisi.
2-Disfunzione per: a-Attivazione della molecola bersaglio
mimando il ligando endogeno (es: gli xenormoni); b-Inibizione della funzione ( es chiusura / apertura di canali ionici ad
opera di veleni animali e insetticidi clororganici); c-Inibizione
enzimatica ( es insetticidi organo fosforici); d-Formazione di
addotti che distorcono la struttura; e-Alterazione dello stato di
polimerizzazione di proteine citoscheletriche; f-Blocco del
trasporto di elettroni nella catena ossidativa mitocondriale .
3-Formazione di neoantigeni: alterazioni proteiche spesso indotte
da nucleofili ( ammine aromatiche, idrazine, tioli) possono
evocare risposte immunitarie.
Struttura bersaglio
bersaglio molecolare. proteine, (coenzimi), acidi nucleici,
lipidi
bersaglio cellulare: nucleo, mitocondri, RER, membrana
plasmatica
Attributi della Molecola bersaglio
Tutte le molecole endogene potenzialmente possono essere il bersaglio,
però generalmente lo sono macromolecole come proteine e acidi
nucleici . L’interazione diretta con ATP e cofattori è rara. Per esser
bersaglio di xenobiotici la molecola endogena deve:
1.
Possedere reattività e conformazione sterica che consentano
l’interazione;
2.
Essere in un sito accessibile;
3.
Avere una funzione critica.
Il danno o la disfunzione a livello molecolare
origina danno o disfunzione della struttura o
funzione cellulare (bersaglio cellulare)
La mancanza o l’insufficienza di riparazione o
compensazione determina danno a livello di
tessuto/organo o di funzione fisiologica.
Ciò determina la patologia più o meno grave
in funzione dell’entità/ estensione del danno
e della sua eventuale reversibilità
Un esempio della sequenza di danni generati a
cascata da interazione tossico molecola bersaglio e lo
stress ossidativo innescato dai radicali dell’ossigeno,
messi in sequenza temporale:
1. Perossidazione lipidica delle membrane
2. Ossidazione e deplezione del Glutatione ridotto
3. Ossidazione dei tioli proteici
4. Alterazione dell’omeostasi ionica (pompe di
membrana)
5. Danno al DNA
6. Alterazioni citoscheletriche
7. Danni mitocondriali e deplezione ATP
8. Aumento della fragilità di membrana
9. Morte cellulare
Ruolo della molecola bersaglio 1
La attività coordinata di un sistema biologico
multicellulare sussiste in quanto ciascuna cellula porta
a termine un programma ben definito.
I programmi a lungo termine determinano il destino
delle cellule cioè se esse devono procedere verso la
divisione
cellulare piuttosto
che verso la
differenziazione o la apoptosi
I programmi invece a breve termine controllano le
attività
di cellule differenziate specializzate
determinando cioè la maggior o minor attività
secretore, la contrazione o il rilassamento, la maggior o
minor velocità di trasporto o di metabolismo.
Ruolo della molecola bersaglio 2
Per la coordinazione di questi programmi cellulari le
cellule posseggono una rete di regolazione che può
essere attivata o inattivata da molecole segnale esterne.
Per eseguire i programmi le cellule sono dotate di
sistemi organizzati in complessi macromolecolari,
membrane cellulari e organelli che si occupano di sintesi,
cinetica, trasporto, metabolismo, produzione energetica.
Tutti questi processi servono a mantenere l’integrità
cellulare (funzioni interne) o a supportare e mantenere
l’attività di altre cellule ( funzioni esterne)
Ruolo della molecola bersaglio 3
Il tipo di disfunzione causata dal tossico dipende dal ruolo che
ha nel sistema multicellulare la macromolecola bersaglio:
1. Se è una molecola coinvolta nella regolazione cellulare,
primariamente si verifica una sregolazione dell’espressione
genica, e/o la sregolazione di una attività temporanea
cellulare
2. Se la molecola bersaglio è coinvolta principalmente nel
mantenimento delle funzioni interne l’effetto risultante è una
disfunzione che può compromettere la sopravvivenza della
cellula stessa
Quando comunque la molecola bersaglio cellulare è importante
per regolare funzioni esterne si verifica una influenza
sull’attività di altre cellule dell’organo o di un sistema di
organi integrati tra loro nelle funzioni vitali per l’organismo.
SREGOLAZIONE CELLULARE
Le cellule sono regolate da segnali molecolari che attivano
specifici recettori di membrana o intracellulari che sono
collegati a un rete di trasduzione del segnale che trasmette il
segnale a precise regioni regolatorie dei geni e/o di proteine
funzionali
La attivazione del recettore può comportare da parte di una
xenobiotico:
1. Una alterata espressione genica
2. Una modificazione di una specifica proteina (tipica la
fosforilazione che può attivare/ disattivare una proteina)
I programmi che controllano il destino cellulare primariamente
influiscono sull’espressione genica .
Quelli che regolano le attività cellulari specifiche influenzano
principalmente le proteine funzionali
Sregolazione dell’espressione genica
Deriva da azione degli xenobiotici:
•Su elementi direttamente responsabili della trascrizione
•Su componenti delle vie di trasduzione del segnale
•Su sintesi conservazione e rilascio di molecole segnale
Sregolazione delle trascrizione:
La trascrizione dell’informazione genetica dal DNA al mRNA
è controllata da una interazione tra fattori di trascrizione (TFs)
e le regioni regolatorie o promoter dei geni. Legandosi alla
sequenza nucleotidica in questa regione i TFs attivati facilitano
la formazione di complessi di preinizizione, promovendo la
trascrizione del gene adiacente. Uno xenobiotico può interagire
direttamente con la regione promoter del gene o con il TFs o
con altri componenti del complesso di preiniziazione. Il più
comune modo di interazione è una alterata attivazione dei
TFs.
Funzionalmente Sono conosciuti due tipi si TFs : quelli attivati
da ligando e quelli attivati da segnale
Gli Ormoni come gli steroidei e i tiroidei e delle Vitamine
(retinoidi e vitamina D) influenzano l’espressione genica
legandosi ad un attivatore di TFs ( recettore a ligando).
Vari xenobiotici possono mimare il ligando naturale:
DDT
TCDD
PCB
PAH
Esteri degli Ftalati
Cd2+
ecc….
Principali meccanismi dei segnali di trasduzione iniziati nel citosol o
sulla membrana cellulare Da Mayer,1994
I 4 principali tipi di recettori e trasduzione del segnale
1 canali ionici attivati da ligando (recettori ionotropici)
2 recettori accoppiati a proteina G (recettori metabotropici)
3 recettori ad attività chinasica
4 recettori nucleari
da Annunziato L. e Di Renzo G. “Trattato di Farmacologia capitolo 2 , Idelson-Gnocchi 2010
Da Casaret and Doull’s “Toxicology” Va edizione
Sregolazione della trasduzione del segnale
Le molecole segnale extracellulari come citochine,
ormoni e fattori di crescita attivano dei TFs La
fosforilazione è un comune meccanismo di
attivazione
per i TFs che stimolano poi la
trascrizione genica. La fosforilazione di un TFs
attivato da segnale è controllato da protein-chinasi e
fosfatasi. Una qualunque perturbazione del segnale
di trasduzione sul TFs, come per esempio un effetto
sulla fosforilazione/defosforilazione proteica, è in
grado di alterare l’espressione genica regolata dai
TFs.
Tossici che inducono perturbazione dei segnali di
trasduzione
sono responsabili probabilmente
delle
alterate espressioni geniche dopo esposizioni di cellule a
elevate temperature, metalli pesanti, stress ossidativo e a
sostanze chimiche che formano legami covalenti.
Sostanze ossidanti possono attivare la protein-chinasi C
(PKC)) e alcuni TFs, come AP-1 e NFκB. Geni con
elementi responsivi per questi TFs come le metallotioneine
e le emo-ossigenasi
possono essere attivate
dai
sopramenzionati stress.
Perturbazioni delle vie di segnale e alterata regolazione
della espressione genica sono pure coinvolte nel
meccanismo di induzione della apoptosi prodotta di alcuni
tossici (es. vari agenti anti tumorali, epatotossine e
derivati alchilici dello stagno)
Sregolazione della produzione del segnale
Per esempio ormoni della parte anteriore dell’ipofisi
hanno effetto mitogeno su ghiandole endocrine
periferiche agendo su recettori superficiali di
membrana. La produzione degli ormoni ipofisari è
controllata da un meccanismo di feedback negativo:
xenobiotici che inibiscono la produzione di ormoni
tiroidei (Es. l’ebicida amitrolo e il metabolita di
fungicidi carbamati, l’etilentiourea) o aumentano
l’eliminazione degli ormoni tiroidei (es. il fenobarbital)
aumentano la secrezione di TSH con conseguente
stimolo mitototico sulla tiroide (gozzo o tumore)
Sregolazione dell’attività specifica in cellule differenziate
Si riferisce principalmente ad interferenze degli xenobiotici
nelle attività cellulari di trasmissione dei segnali .
Il controllo del funzionamento di cellule specializzate, come
muscoli, neuroni, ghiandole, è esercitato da molecole segnale che
agiscono su recettori di membrana che trasducono il segnale
regolando l’entrata del calcio nel citoplasma o stimolando la
formazione enzimatica intracellulare di secondi messaggeri. Il
Calcio o il secondo messaggero altera quindi la fosforilazione di
proteine funzionali, producendo quasi istantaneamente una
modificazione della loro attività e perciò della funzione cellulare
(attività) specifica.
Gli xenobiotici possono produrre effetti contrastanti l’attivita
fisiologica specifica di cellule specializzate disgregando una più
tappe accoppiate alla trasmissione dei segnali. Tipici sono gli
effetti tossici su cellule elettricamente eccitabili.
Da Casaret and Doull’s “Toxicology” Va edizione
Alterazione dell’attività di cellule eccitabili (nervose, muscolari, cardiache)
La perturbazione può essere dovuta ad alterazioni in:
•
•
•
•
Funzionalità del recettore
Propagazione del segnale
Processi che terminano il segnale
Concentrazione del Neurotrasmettitore( NT)
Esempi più comuni:
a) alterazioni del trasporto o della conservazione delle vescicole (es. il veleno della
vedova nera e quello di alcuni serpenti distruggono il pool di vescicole causandone
un rilascio lento e scoordinato)
b) alterazione del rilascio del NT nello spazio intersinaptico (tossina tetanica e
botulinica)
c) alterazione del re-uptake del NT dopo il rilascio (veleno di alcuni serpenti)
d) alterazione del catabolismo del NT dopo il rilascio (es. inibizione dell'Ach-esterasi da insetticidi organofosforíci e carbammati)
e) legame col recettore sulla membrana postsinaptica (es. atropina e muscarina)
h) interferenza nella conduzione dell'impulso nervoso lungo l’assone (tossine degli
Artropodi, TTX, DDT, insetticidi clororganici, batracotossina
Più rare sono le alterazione nel processo di sintesi del NT o di uptake dei
precursori del NT nel neurone o nelle vescicole
Ruolo della molecola bersaglio ed effetti (mantenimento delle
strutture e funzioni)
Omeostasi cellulare
Alterazione di meccanismi
interni
MORTE CELLULARE
Funzioni di
membrana
Funzioni
microtubulari
Sintesi
proteica
Regolazione
livelli Ca++
Sintesi di
ATP
DANNO
Alterazone di meccanismi
esterni
Difetti della funzionalità
di sistemi integrati come
sanguinamento/coagulazione o trasporto O2
Alterazioni della permeabilità di membrana
a) alterazioni della struttura di membrana operato da
solventi e tensioattivi
b) blocco o apertura dei canali ionici generalmente
operata da tossine animali e vegetali (tetrodotossina
(TTX), conotossina, batracotossina, piretro,
valinomicina)
c) perossidazione dei lipidi di membrana provocata
da radiazioni, radicali liberi o sostanze che
promuovono la formazione di radicali liberi (es.
paraquat e diquat)
Alterazione della sintesi di ATP
Gli xenobiotici che ne alterano la sintesi possono essere
suddivisi in 4 classi:
1. Inibitori della disponibilità di H+ per la catena ossidativa
mitocondriale (es: gli inibitori della glicolisi o gli inibitori
dell’ossidazione di acidi grassi o del piruvato o del succinato);
2. Inibitori del trasporto di elettroni nella catena ossidativa
mitocondriale (es: bloccanti complesso I, III, o IV come il CN);
3. Sostanze che riducono la disponibilità del O2 come CO o
nitriti;
4. Inibitori della fosforilazione dell’ADP per:
•
Blocco dell’ATP sintetasi (es.: il DDT);
•
Disaccopiamento della fosforilazione ossidativa per dissipazione del
gradiante H+ (es dinitrofenoli , dinitrocresoli)
Alterazione dell’omeostasi CALCICA
Basse concentrazioni di CA++ intracellulari sono mantenute meccanismi attivi
che pompano il Ca ++ fuori dalla cellula (1) o nel reticolo endoplamatico (2)
oppure con altri trasporti verso lo spazio extracellulare (3) o i mitocondri (4).
3Na+
Ca++= 1000μM
Ca++= 0,1μM
REL
3
ATP
2
ADP
Ca++
4
1
ATP
ADP
+
+
_ _+ _+
_ _+ _+
_ _MITOCONDRIO
_
___
+++
+++
I tossici che aumentano il calcio intracellulare possono agire con tre meccanismi
differenti:
a-Aumento dell’influsso nel citoplasma;
b-Inibizione dell’esporto dal citoplasma;
c-Alterazione dei processi mitocondriali
A-AUMENTO DELL’INFLUSSO NEL CITOPLASMA per:
1.
Azione sui canali ad apertura a ligando:
2.
Apertura di canali regolata dalpotenziale HO
3.
Apertura di pori nella membrana ( es.: Metilmercurio)
4.
Lesioni nella membrana (es.: detergenti, enzimi idrolitici, perossidanti
lipidici, tossine citoscheletriche
B-INIBIZIONE DELL’ESPORTO DAL CITOPLASMA per:
1.
Legame covalente con proteine o enzimi di membrana (es. CCl4 e CHCl3)
2.
Ossidanti dei tioli ( es: l’ebicida DIQUAT)
C-ALTERAZIONE DI PROCESSI MITOCONDRIALI per:
1.
Blocco della sintesi di ATP
2.
Ossidazione del NAD(P)H (es.: NO )
OMEOSTASI CALCICA
TOSSICO
Alterazione
omeostasi dei tioli
Ossidazione nucleotidi
piridinici
Disturbo sistemi
energetici
AUMENTO Ca++ CITOSOLICO
Attivazione di:
FOSFOLIPASI
DANNO ALLE
MEMBRANE
PROTEASI
PROTEOLISI
ENDONUCLEASI
FRAMMENTAZIONE DEL
DNA
MORTE CELLULARE
Sono identificabili comunque numerose alttre attività tossiche degli
xenobiotici soprattutto su sistemi enzimatici e sui pigmenti respiratori
Sistemi enzimatici
L’interazione di uno xenobiotico con un enzima può causare
inibizione enzimatica:. questa può essere reversibile o irreversibile
e può portare e sintesi letale. L'inibizione enzimatica irreversibile
generalmente avviene per legame covalente (es. il legame dei
metalli con i gruppi --SH). L'inibizione enzimatica reversibile è
operata da sostanze chimicamente simili al substrato naturale.
Es. di sintesi letale: nel ciclo di Krebs l’acido fluoroacetico si
sostituisce all'acido acetico, dando origine all'acido fluorocitrico
che blocca l'enzima aconitasi responsabile della conversione
dell'ac. citrico in isocitrico.
Es di inibizione reversibile di insetticidi Carbamati su l’enzima
acetilcolinesterasi e irreversibile di insetticid organofosforici
Interferenza con acidi nucleici.
a) intercalazione o alchilazione con omologhi delle basi e
conseguente interferenza nella duplicazione dei DNA
b) interferenza con la trascrizione (antibiotici o sostanze
prodotte dei piante e funghi che agiscono da inibitori della
RNA polimerasi)
c) fenomeno di misreading ovvero interferenza nella lettura
dell'informazione contenuta nell'RNAm (es. antibiotici
come la streptomicina)
d) interferenza nella sintesi degli acidi nucleici o nella sintesi
delle proteine
Le sostanze che agiscono con gli acidi nucleici sono quasi
sempre mutagene e possono portare anche a carcinogenesi,
teratogenesi e immunosoppressione
Pigmenti respiratori
•Il legame di alcune sostanze (es. CO) all'Hb
impedisce il trasporto di O2.
•L’ossidazione del ferro dell’emoglobina (es,
anilina, fenazone, sulfonamidi) che perde l'affinità
per O2
•La lisi: (es. tensioattivi, Arsina) dei globuli rossi
provoca fuoruscita delI'Hb nel plasma
inattivandola.
Tossicologia molecolare connessa ai metalli
•Gli agenti chelanti, impiegati nel contrastare
l’intossicazione da Hg, As, Pb possono essere
tossici per sequestro di metalli essenziali
• Metalli non essenziali come Pb, Hg, Cd possono
sostituire metalli essenziali nelle proteine di
trasporto, oppure possono alterarne lo stato
ossidativo in molti sistemi enzimatici dove
agiscono da cofattori (es. il Fe è essenziale per i
citocromi)
•Possono interferire in processi immunomediati
• possono associarsi a proteine diventando
determinanti antigenici.
Reazioni su sistemi complessi:
•Sistema Immunitario: inibizione o iperattività,
connesso anche con reazioni allergiche e
fotoallergiche
•Sistemi ormonali: molte sostanze chimiche
provocano lesioni ad organi endocrini o inducono
formazioni di tumori. Anche i Distruttori Endocrini
sono molecole che agiscono sui sistemi ormonali
•Apparati e processi riproduttivi : diminuzione
della fertilità da clororganici, diossine, estrogeni,
tensioattivi; effetti letali sugli embrioni; effetti
teratogeni; induzione di malattie genetiche
•CARCINOGENESI CHIMICA
RISPOSTE TOSSICHE DEL SISTEMA IMMUNITARIO
Azione
IMMUNODEPRESSIONE
TOSSICI
Idrocarburi aromatici alogenati,
PCB, PBB, TCDD, TCDF, PAH,
Metalli (Pb, As, Hg, Cd, Be, Pt),
Pesticidi (Organofosforici, DDT,
organostannici, Carbammati)
Uretano, Fumo di tabacco, Asbesti,
Irritanti polmonari (Formaldeide, Silicati,
Etilendiammina), Gas ossidanti( O3, SO2,
NO2), Solventi organici ( CCl4),
Immunodepressori, anti-AIDS, citochine
ricombinanti, Cannabinoidi, Cocaina,
Oppioidi,
Etanolo, Siliconi
RISPOSTE TOSSICHE DEL SISTEMA IMMUNITARIO
Azione
Ipersensibilità
TOSSICI
Antibiotici, Poliisocianati, Anidridi acide,
Metalli( Pt, Co, Ni, Cr, Be)
Pesticidi, Cosmetici, Enzimi, Formaldeide
Tossicità Immunomediata
HgCl2, Acetato di Pb,SiO2, TCDD,
Trinitroclorobenzene, Ciclofosfamide,
Bleomicina,
Olio di paraffina
Malattie Autoimmuni
Metil dopa (anemia emolitica) Idralazina,
Isoniazide, Procainamide, Alotano (Lupus
eritematoso)
Cloruro di vinile, Cristalli di Si
(scleroderma)
Hg (nefropatia glomerulare)
Effetti tossici sul sistema endocrino
Molti organi del sistema endocrino sono vulnerabili ai tossici
particolarmente la tiroide, il pancreas, l’ipofisi, le paratiroidi
ma anche il timo, le surrenali, l’ovaio e i testicoli. Vari tumori,
lesioni e disfunzioni di questi organi sono associate all’uso di
farmaci o all’esposizione a contaminanti, quali Al, idrocarburi
clorurati, bifenili polialogenati, diossine, radiazioni ecc..
Gli “Endocrine Disruptors” sono sostanze presenti
nell’ambiente in grado di alterare la funzione riproduttiva.
Tra questi sono classificate sostanze che producono disfunzioni
gonadiche sia maschili che femminili.
•Gravi alterazioni anche letali sulle cellule (Chemioterapici e
radiazioni)
•Alterata produzione di ormoni.
• Attivazione metabolica (IPA ,Diossine e PCB)
•Agonismo a livello recettoriale (DDT,p-clorofenil-etano)
Tossicologia del Sistema riproduttivo
Alterazioni della capacità riproduttiva possono derivare
da:
Alterazioni di sviluppo delle gonadi.
Alterazioni nel comportamento sessuale e nella
Libido.
Alterazioni di processi di Spermatogenesi e/o
Oogenesi.
Alterazione del processo di fertilizzazione.
Alterazione del processo di impianto.
Alterazione di sviluppo embrionale e fetale
(Teratogenesi)
Effetti specifici sulla capacità riproduttiva degli individui
può
spesso avvenire a concentrazioni di xenobiotico
sensibilmente al di sotto della soglia di azione per sintomi
tossici sugli altri organi e sistemi.
Molti xenobiotici possono agire sulla capacità riproduttiva a
causa dei loro effetti come ormono-mimetici o ormonoinibitori, intervenendo nelle fasi di differenziamento,
maturazione e/o comportamento sessuale.
Altri possono intervenire per tossicità diretta sul prodotto del
concepimento, sull’embrione o sul feto durante le fasi di
differenziamento e sviluppo o dopo la nascita, nel caso del
mammifero, durante il periodo della lattazione.
Maturità sessuale
Crescita e
sviluppo
Sviluppo postnatale
Liberazione di
gameti
Maturazione
dei gameti
Fecondazione
Nascita
Trasporto dello
zigote
Fetogenesi
Embriogenesi
Periodo di gestazione umana =267 giorni
pre-impianto: 0-6° giorno
Impianto
Periodo di gestazione del ratto =22
giorni pre-impianto: 0-5° giorno
Impianto: 6°-7°
Impianto: 4°-5°
Embriogenesi : 7°-56°
Embriogenesi : 7°-17°
Organogenesi: 21°-56°
Organogenesi: 8°-17°
Fetogenesi: 57°-267°
Fetogenesi: 17°-22°
Lo stadio di sviluppo delle gonadi è estremamente
sensibile a insulti chimici
Differenziazione sessuale
1. Sesso gonadale : determinato dal cromosoma Y che
converte gonadi indifferenziate in testicoli
2. Sesso genotipico : è necessaria la presenza di due
cromosomi X nelle cellule germinali per lo sviluppo delle
ovaia.
3. Sesso fenotipico (genitale) : lo sviluppo dei dotti
genitali e dei genitali esterni è determinato dalle
secrezioni ormonali. La presenza di testosterone secreto
dai testicoli embrionali determina lo sviluppo dei genitali
maschili. Lo sviluppo di quelli femminili dipende
dall’assenza di testosterone.
Esempi di Xenobiotici embrio e feto-tossici nell’uomo
Alcol
Sindrome embriofetale da alcol
Iodio in eccesso
Disturbi nella maturazione del sistema nervoso
centrale
Metil-Hg
Difetti del sistema nervoso centrale
Pb
Ritardo mentale
Litio
Malformazione di cuore e vasi
CO
Ritardo mentale
Radiazioni
Acefalia , malformazioni multiple, leucemie
Retinoidi
Malformazione dello scheletro, orecchio e del
sistema nervoso centrale
PCB
Ritardo mentale e stranezze
TOSSICITÀ DA FALLIMENTO DI
MECCANISMI RIPARATIVI
L’ultima tappa nello sviluppo della tossicità è
l’inadeguato capacità omeostatica/riparativa
Come i danni sono concatenati a cascata dalla molecola
all’organismo anche le funzioni riparative hanno una
gerarchia.
La riparazione influisce in maniera determinante sulla
progressione del danno
Il primo meccanismo d’arresto della progressione tossica è
dato dai meccanismi enzimatici di detossificazione cui, in
caso di fallimento, seguono i meccanismi di riparazione del
danno propriamente detti
Reazioni enzimatiche detossificanti
1. Per i nucleofili
a. Coniugazioni con solfati, glucosio, acido glicuronico
b. Ossidazioni catalizzate da monoossigenasi
contenenti flavine o da alcol e aldeidi deidrogenasi
c. Specifico meccanismo è la conversione del Cianuro
in Tiocianato ad opera della Rodanasi
Rodanasi (Transulfurasi): enzima mitocondriale
CN- + SO32Cianuro
Tiosolfato
SCN- +
Tiocianato
Solfito
SO32-
Questi meccanismi detossificanti enzimatici
possono fallire per :
•Sovraccarico del sistema con esaurimento degli
enzimi o dei cofattori
•Reversibilità di alcune coniugazioni (in particolare
a livello intestinale)
•Generazione di altri intermedi tossici in processi di
coniugazione
Da JFR Kerr e BV Harmon, 1991
Apoptosi a destra (1, 2, 3, 4) e Necrosi a sinistra (5, 6)
1.cellula normale; 2.addensamento cromatina; 3.frammentazione
nucleare e sviluppo di protuberanze; 4.fagocitosi
5.addensamento cromatina e rigonfiamento di organelli; 6.rottura delle
membrane e disgregamento
A
p53
G0
G1
c Myc
M
G2
S
Eccessi di APOPTOSI portano alla atrofia degli organi
Eccessi di PROLIFERAZIONE RIPAR ATIVA o errata riparazione producono
fibrosi dei tessuti
Errati rapporti PROLIFERAZIONE/APOPTOSI comportano neoplasia o atrofia
dei tessuti
DEFINIZIONE DI CARCINOGENO
CHIMICO
SOSTANZA CHE INDUCE NEOPLASIA
L’induzione è accertata quando:
1. Si verifica un aumento di incidenza di tumori
endemici
2. Si verifica una comparsa precoce di tali tumori
3. Si verifica la comparsa di tumori normalmente
non presenti nella specie
4. Si verifica la comparsa di più tipi di tumori nello
stesso individuo
L’EFFETTO CARCINOGENO È
PECULIARE RISPETTO AGLI ALTRI
EFFETTI TOSSICI
• È cellularmente ereditabile
• È cumulativo e dilazionato nel tempo
• Una sola grande dose in una sola esposizione è
spesso meno efficace di quando è frazionata in più
esposizioni dilazionate nel tempo
• Il meccanismo d’azione è centrato sulle alterazioni
genetiche
• In molti casi non è identificabile la soglia di non
effetto
Da Casarett and Doull’s “Toxicology” Va edizione
Da A.Gasperi-Campani: “Carcinogenesi in Tossicologia Molecolare e Cellulare”,UTET, 2000
Classificazione di carcinogeni chimici in relazione al loro
meccanismo d’azione negli stadi di sviluppo della
carcinogenesi
• Agente iniziatore: carcinogeno incompleto capace
solo di iniziare cellule normali
• Agente promotore: capace di causare l’espansione
di cloni di cellule iniziate (co-carcinogeno)
• Agente progressore: capace di trasformare cellule
iniziate o quelle nello stadio di promozione in
cellule potenzialmente maligne
• Carcinogeno completo: agente capace di indurre
cancro partendo da cellule normali, che possiede
proprietà di agente iniziatore, promotore e
progressore
Carcinogeno non genotossico
s
o
p
r
a
v
vi
v
e
n
z
a
Carcinogeno genotossico
+
-
Danno al DNA
riparazione
riparazione
silente
Replicazione DNA
Mutazione
TrasformazioneNeoplastica
Attivazione di
proteine oncogene
ESPANSIONE CLONALE
TUMORE
m
o
r
t
e
+
Inattivazione di
proteine oncosoppressori
AGENTI GENOTOSSICI
Carcinogeni inorganici diretti (primari)
Nikel, Cromo
Carcinogeni organici diretti (primari)
Agenti alchilanti, Sostanze
elettrofile
Carcinogeni indiretti
IPA, Nitrosamine
AGENTI EPIGENETICI
Materiali solidi
Asbesto, Polimeri
Xenoestrogeni, PCB
Modificatori ormonali
Immunosopressori
Farmaci antirigetto
Citotossici
Acido Nitrilotriacetico
Promotori
Esteri del Forbolo, DTT, CHCl3, Saccarina,
Inibitori di Apoptosi o riparazione DNA
Proliferatori dei
Esteri degli acidi Ftalici, Erbicidi
perossisomi
Fenossiacetici
MODIFICAZIONI AL DNA DA SOSTANZE CHIMICHE O
RADIAZIONI
Da Casarett and Doull’s “Toxicology” Va edizione
SISTEMA
Riparo
per
escissione
Meccanismo
La riparazione per escissione si avvale dell'azione coordinata
di alcuni enzimi costitutivi sempre presenti nella cellula, quali
una endonucleasi che incide l’elica del DNA in prossimità delle
lesioni prodotte da un agente mutageno, una un esonucleasi
che degrada un tratto dei filamento del DNA inciso, una DNApolimerasi che risin-tetizza il frammento degradato utilizzando
come stampo il filamento opposto integro, ed infine una DNAligasi che, ristabilisce !a continuità fra il segmento
neosintetizzato e quello originale. E’ un sistema di riparo
altamente fedele !!
SOS-Repair
Questo sistema opera in condizioni d'emergenza ma con
minor precisione, introducendo un gran di mutazioni ; viene
denominato appunto S.O.S per l'eccezionalità dei casi in cui è
chiamato ad operare,
quando
cioè
venga
posta
l'alternativa di morire oppure di sopravvivere anche a costo dì
mutare.
Fotoriattivazione
Si basa sull'azione della foto-liasi, un enzima che utilizza la
luce visibile. come fonte di energia per scindere i fotodimeri
generati dalle radiazioni UV.
Riparo post
replicativo
E’ una polimerasi di controlio e correzione della replicazione
(Proof-reading) che provvede ad eliminare la sequenza di basi
scorrette basandosi sulla sucessione del filamento parentale,
tramite la semplice risintesi dei tratti di DNA eliminati.
Probabili agenti progressori
Agente
Attività
iniziante
Attività
Clastogenica
Attività
Carcinogena
Sali di As
Asbesto
Benzene
Idrossiurea
Fumo
?
+
+
+
+
+
+
+
+
+
+
+
La progressione è un processo irreversibile denotato da
instabilità cariotipica
Da Casarett and Doull’s “Toxicology” Va edizione
Classificazione di sostanze carcinogene
A- sufficiente evidenza nell’uomo;
B1- limitata evidenze nell’uomo, ma sufficiente
nell’animale;
B2- limitata evidenza nell’animale e molto limitata
o nulla nell’uomo;
C- limitata evidenza nell’animale;
D- potrebbero aver effetti carcinogeni nell’uomo ma
non hanno sufficienti o non hanno per nulla studi
adeguati.